高三化学综合练习(三)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分, 第Ⅰ卷1至4页, 第Ⅱ卷5至8页,共150分。考试时间120分钟。考试结束,将第Ⅱ卷和答题卡一并收回。
第Ⅰ卷(选择题 共72分)
注意事项:
1.答第I卷前,考生务必将自己的姓名、座位号、准考证号、考试科目用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试题卷上。
3.可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24
S 32 Ba 137 Mn 55 Cu 64 Zn 65
一、选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、下列说法中不正确的是:
A、人类历史上最早使用的合金是青铜,目前世界上使用量最大的合金是钢
B、能源、信息、材料通常被称为新科技的革命的三大支柱
C、“绿色食品”是指从绿色植物中得到的食品
D、“纳米材料”广泛用于各个行业,它是指粒子直径在几纳米到几十纳米的材料
2、最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可能过断裂DNA来杀死细胞,从而抑制爱滋病(AIDS)。对于放射性的14C,下列说法中正确的是:
A、与C60中普通碳原子的化学性质不同
B、与14N含有的中子数相同
C、是C60的同素异形体
D、与12C互为同位素
3、下列选项中的“黄色”不属于因化学反应而产生的现象是
A无色试剂瓶中的浓硝酸呈黄色
B蛋白质遇浓HNO3呈黄色
C久置的KI溶液呈黄色
D炒菜时,食盐不小心落入火中,出现黄色火焰
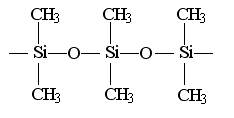
4、硅橡胶的主要成份是
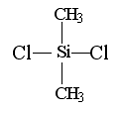
是二氯二甲基硅烷经两种反应制得的,这两种反应是:
A、氧化、缩聚 B、消去、加聚 C、水解、缩聚 D、水解、加聚
5、A将A 、B置于容积为2L的密闭容器中,发生如下反应:
4A(g) + B(g) ≒ 2C(g) ,反应进行到4S末时,测得A为0.8mol,B为0.4mol,C为0.2mol,用反应物表示该反应速率为
A、V(A)=0.05mol/(L•S) B、V(A)=0.0125mol/(L•S)
C、V(A)=0.025mol/(L•S) D、V(A)=0.1mol/(L•S)
6、下列哪一组元素的原子间反应可以形成离子键:
| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A、a和b B、a和f C、c和d D、f和g
7、已知某溶液中有四种离子:X+、Y-、H+、OH-, 下列分析结果肯定错误的是:
A、c(Y-)>c(X+)>c(H+)>c(OH-)
B、c(H+)>c(Y-)>c(OH-)>c(X+)
C、c(H+)>c(Y-)>c(X+)>c(OH-)
D、c(OH-)>c(X+)>c(H+)>c(Y-)
8、将下列物质的量浓度相同的溶液等体积两两混合有白色沉淀生成,加入过量的稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是:
A、Na2CO3和Ca(OH)2 B、Na2CO3和CaCl2
C、Ca(HCO3)2和NaOH D、Na2SO4和Ba(NO3)2
二、选择题(本题包括10小题,毎小题4分共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9、设NA表示阿佛加德罗常数的值,下列叙述中正确的是:
A、1.6克NH2-离子所含电子数为NA
B、在标准状况下,11.2LO3和O2的混合物所含原子数为1.5NA
C、在标准状况下,1.12LBr2的原子数为0.1NA
D、16.8克Fe溶于2L0.4mol/L的硝酸溶液中,失去0.6NA电子
10、下列实验设计方案可行的是:
A、用重结晶的方法分离NaCl与硝酸钾的混合物
B、向某无色未知溶液中加入BaCl2溶液,再加稀硝酸不溶解,证明存在SO42-
C、将H2、O2混合气体通过盛有灼热的氧化铜的试管,以除去氢气
D、将4.9克H2SO4溶于500ml水中配制0.1molL-1的硫酸
11、在室温下,已知酸和碱的pH值之和等于14,两者混合后pH=7,则酸和碱两者体积之比为大于1的是:
A、硫酸跟氢氧化钠 B、醋酸跟氢氧化钾
C、盐酸跟氨水 D、硝酸跟氢氧化钡
12、能够使反应Cu + 2H2O = Cu(OH)2 + H2↑发生的是:
A、铜片做原电池的负极,碳棒做原电池的正极,氯化钠做电解质溶液
B、铜锌合金在潮湿的空气里发生电化学腐蚀
C、用铜片做阴、阳电极,电解硫酸钠溶液
D、用铜片做阴、阳电极,电解硫酸铜溶液
13、工业废气中氮的氧化物是重要的污染源,有一种治理的方法是通入适量的氨气将其还原为无毒物质N2和H2O,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.5L恰好反应完全,则混合气体中NO和NO2的体积分数是:
A、1:4 B、1:3 C、1:2 D、1:1
14、下列各组离子在指定的环境下能大量共存的是:
A、pH>7的溶液中,Na+、K+、S2-、MnO4-
B、pH=7的溶液中,Al3+、Cl-、NH4+、S2-
C、pH>7的溶液中,Na+、K+、AlO2-、NO3-
D、pH=0的溶液中,Fe2+、ClO-、NH4+、Na+
15、已知甲醛(HCHO)分子中4个原子是共平面的,下列分子中所有原子不可能存在于同一平面上的是:
A、苯乙烯 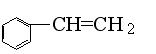
B、苯甲酸 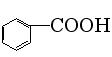
C、苯乙酮 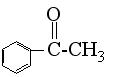
D、苯甲醛 ![]()
16、下列离子方程式书写正确的是:
A、标准状况下,2.24LCO2通入1molL-1100mlNaOH溶液中
CO2 + OH- = HCO3-
B、向漂白粉中通入适量的SO2气体
Ca2+ + 2ClO- + SO2 +H2O = CaSO3↓ + 2HClO
C、等物质的量的NH4HCO3与NaOH在溶液中反应
NH4+ +HCO3- + 2OH- = CO32- + NH3↑ + 2H2O
D、金属铁溶于盐酸中
2Fe + 6H+ = Fe3+ + 3H2↑
17、在常温时,将a1mlb1mol/LCH3COOH溶液加入到a2mlb2mol/LNaOH溶液中。下列结论中正确的是:
A、如果a1=a2、b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
B、如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+)
C、如果混合溶液的pH>7,则a1b1=a2b2
D、如果a1=a2,且混合液的pH<7,则b1>b2
18、在一定温度下,向硫酸铜饱和溶液中加入无水硫酸铜,可以看到粉末由白色变成蓝色,则下列各量中不发生变化的是:
A、溶液质量 B、溶液中溶质的质量
C、溶液的pH值 D、溶液中溶质的质量分数
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共23分)
19、⑴(4分)下表是验证饱和氯水中所含主要微粒的实验操作和实验现象,请根据实验要求将相应的操作和现象的标号填写在答案栏:
| A | B | C | 答案 | ||
| 氯水中的主要微粒 | 实验操作 | 实验现象 | A | B | C |
| a、H+ b、Cl- c、Cl2 d、HClO | ⑴将氯水滴入饱和的氢硫酸中 ⑵将氯水滴入品红溶液中 ⑶在氯水中滴加紫色石蕊试液 ⑷在氯水中滴加硝酸银溶液 ⑸将湿润的淀粉碘化钾试纸置于氯水试剂瓶口上方 | ①有白色沉淀生成 ②有淡黄色沉淀生成 ③白色变蓝色 ④红色变无色 ⑤滴入瞬间溶液显红色,随即又褪色 | a | ||
| b | |||||
| c | |||||
| d | |||||
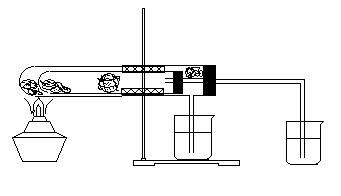
⑵(8分)下图为某学生设计的实验装置图,图中的大试管内装有干燥的碳酸钠,小试管内装有干燥的碳酸氢钠,A、B处均为沾有无水硫酸铜棉花,C、D处为澄清石灰水,请回答以下问题:
①用酒精灯加热时,A处的现象是: B处的现象是: ,C处的现象是 D处的现象是: 。②该实验证明了:
③教材中也有类似的实验,对比教材中的实验,该实验的好处是
④该实验图示中有一个明显的错误,请指出:
|
|
|
|
20、(11分)实验室用稀硝酸与Cu反应来制备NO气体,如果采用(Ⅰ)装置,由于烧瓶内的空气不易排除,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成。既使可用排水法收集到无色的NO,也无说服力,会使人感到是NO2与H2O反应生成的。有人设计了(Ⅱ)装置,用来做该实验可以达到满意的效果。
![]()
![]()
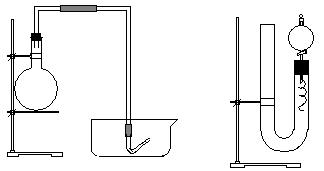
⑴将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到 。
②关闭活塞,用酒精灯在 处加热,当 时,即停止加热。⑵回答下列问题
①写出铜与稀硝酸反应的离子方程式:
②反应在什么时候可以自动停止
在何处可以观察到无色的NO气体?
③如果再将分液漏斗活塞慢慢打开,可立即观察到哪些明显现象
④如果需要再获得NO与已生成的NO2形成鲜明的对照的实验效果,应
四、(本题包括2小题,共19分)
21、⑴(5分)氮可以形成多种离子,如:N3-、N3-、NH4+、NH2-、N2H5+、N2H62+等,已知N2H5+和N2H62+由中性分子结合质子形成的,有类似于NH4+的性质,
①一个N3-含有 电子,
②写出形成N2H5+离子的电子式 ,
③写出N2H62+与足量的强碱溶液共热发生反应的离子方程式
④N2H5Cl溶于水后,溶液中c(OH-) c(H+),
⑵(4分)在人体的血液中,含有一定量的Na2CO3、NaHCO3,能保证血液的pH值变化不大,你分析它的原理可能是:(用离子反应方程式表示)
请你再举出一组类似的溶液:
22、(10分)常温下,A、B、C、D为四种气体单质。在一定条件下,B可以分别和
A、C、D化合生成甲、乙、丙。C和D化合可生成丁。已知甲、乙、丙每个分子含有的电子数相同,并且甲、乙、丙、丁如下关系
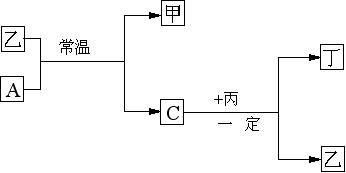
⑴单质B的分子式是 ,单质D的结构式是
⑵单质A跟化合物乙反应的化学方程式是
⑶单质C跟化合物丙反应的化学方程式是
⑷试根据化合物丙、丁中D元素的价态,判断丙和丁能否在一定条件下反应,若能反应,写出化学方程式 ,若不能反应,写出原因
。
五、(本题包括2小题,共22分)
23、⑴(5分)聚苯乙烯的结构为![]() 试回答下列问题:
试回答下列问题:
①聚苯乙烯的链节是: ,单体是:
②实验测得某聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为
③已知聚苯乙烯为线型结构的高分子化合物,试推测: 溶于CHCl3(填“能”或“不能”),具有 (填“热塑”或“热固”)性。
⑵(5分)某烃室温时为气态,完全燃后,生成的H2O和CO2的物质的量之比为3:4,该不饱和烃的链状同分异构体的数目应是 种,它们的结构简式分别为:
。
24、(12分)已知: 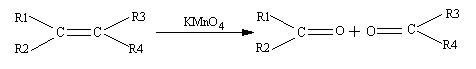
化合物A(C10H16)是一种存在于橘子、柠檬及釉子皮中的一个烯烃。A吸收2mol的氢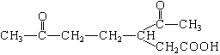 形成烷烃B(C10H20)。A被KMnO4酸性溶液氧化成化合物C(如右图所示);A在催化剂作用下加2mol水,生成一种的醇类D。
形成烷烃B(C10H20)。A被KMnO4酸性溶液氧化成化合物C(如右图所示);A在催化剂作用下加2mol水,生成一种的醇类D。
1.(2分)化合物A的结构中有无环?若有,有几个环?
2.(3分)那些结构可以氧化成C?
3.(3分)写出D的结构式。
4.(2分)A最可能是哪种结构?
5.(2分)B最可能是哪种结构?
六、(本题包括2小题,共14分)
25、(6分)为测定某氧化物(化学式为MO)中的M是何种金属,做如下实验:称取该氧化物8.0克恰好溶于稀硫酸中,再配制成250.0ml溶液。取出50ml用惰性电极进行电解,当刚好电解完全时,电极上析出的金属M是1.28克。通过计算回答如下问题:
⑴M是什么金属?
⑵电解过程中,导线中通过的电子个数是多少?
⑶最初配制的溶液中,该金属离子的物质的量浓度是多少?
⑷若此电解液在电解后的体积是40ml,此时溶液的pH是多少?
26、(8分)将2.6克由两种卤素组成的化合物XX’溶于水,再通入过量的SO2,发生XX’+ 2H2O + SO2 = HX + HX’+ H2SO4然后向生成的溶液中加入足量的Ba(NO3)2溶液,除去沉淀后,将滤液用过理的AgNO3处理,生成了7.46克沉淀,已知AgF可溶于水,试推断该卤素互化物的可能组成?
高三化学
综合练习(三)参考答案
一、二选择题(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | D | D | C | A | B | C | B | A D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A C | C | C | B | C | C | A | B D | C D |
三、19、⑴(4分)(各1分)
| 答案 | ||
| A | B | C |
| a | 3 | 5 |
| b | 4 | 1 |
| c | 1或5(填一组既可,必须对应) | 2或3(填一组既可,必须对应) |
| d | 2或3(填一组既可,必须对应) | 4或5(填一组既可,必须对应) |
⑵(8分)
①白色晶体变成蓝色,无明显变化,无明显变化,澄清的石灰水变浑浊 。(各1分)
② 碳酸钠加热不分解,碳酸氢钠加热分解有水和二氧化碳产生(2分,答完整给全分)
③ 在相同条件下,同时对比碳酸钠和碳酸氢钠加热的变化情况。(1分)
④ 固体加热时,试管口应略向下。(1分)
20、(11分)
⑴
① 稀硝酸与胶塞相接触 。(1分)
② U形管右侧短管 ,(1分) 铜与稀硝酸反应,有气体产生 ,(1分)
⑵
① 3Cu + 8H+ +3NO3- = 3Cu2++ 2NO↑ + 4H2O (2分)
② 反应产生的气体使硝酸离开铜丝时 (1分) U形管的右侧胶塞下方(1分)
③ U形管右侧液面上升,左侧液面下降,分液漏斗内有红棕色气体产生 (2分)
④ 关闭分液漏斗活塞,并适当加热 (2 分)
四、(本题包括2小题,共19分)
21、⑴(5分)
① 22 (1分)
② 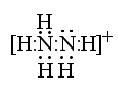 ,(2分)
,(2分)
③ N2H62+ + 2OH- = N2H4↑+ 2H2O (1分) ④ < ,(1分)
⑵(4分) CO32- + H+ ≒ HCO3- HCO3- + OH- ≒ CO32- +H2O (2分)
请你再举出一组类似的溶液: HPO42- 和 H2PO4- (其它符和题意的均可,2分)
22、(10分)
⑴ H2 , N≡N
⑵ 2F2 + 2H2O = 4HF + O2
⑶ 4NH3 + 5O2 = 4NO + 6H2O
⑷ 4NH3 + 6NO2 = 5N2 + 6H2O 。
五、(本题包括2小题,共22分)
23、⑴(5分)(每空1分)
① ![]() ,
, ![]()
② 500
③ 能 热塑 。
⑵(5分) 3 (2分)
CH≡C-CH2-CH3 CH3-C≡C-CH3 CH2=CH-CH=CH2 。(3分)
24、(共12分)
1.有1个环(2分)
2.(3分,答对1个1分,对两个就得3分)![]()
![]()
![]()
3.(3分)![]()
4.(2分)![]()
5.(2分)![]()
六、(本题包括2小题,共13分)
25、(6分)解:
⑴由题意:8.0克的氧化物中含有M的质量是:
m = 1.28g×(250÷50)=6.4g
6.4g÷8g = M/(M+16g/mol)
∴M=64g/mol
该金属是铜
⑵由题意:析出金属铜1.28g则导线中通过的电子是
n(e-)=1.28g÷64g/mol×2×6.02×1023个/mol=2.48×1022
⑶c(Cu2+)=6.4g÷64g/mol÷0.2500L=0.4mol/L
⑷由题意:c(H+)= 2c(Cu2+)=1.28g÷64g/mol×2÷0.040L=1mol/L
∴pH = -lg c(H+)= -lg1 = 0
26、(8分)
解:设XX’的式量为2M,则X和X’的平均式量为M
XX’+2H2O+SO2 = HX + HX’ + H2SO4
讨论:①X’是氟时,则有HX + AgNO3 = AgX↓ + HNO3
XX’---- AgX
2M 108+M
2.6g 7.46g
解得M=22.8 不符合题意
②当X’不是氟时,则有
HX + AgNO3 = AgX↓ + HNO3
HX’+AgNO3 = AgX’↓+ HNO3
XX’------- AgX+ AgX’
2M 2(108+M)
2.6g 7.46g
解得M=57.75 所以其中一种元素一定是氯元素,另一种元素的式量是:57.75×2-35.5=80
所以该卤素互化物是:BrCl
《完》