高 三 化 学
(第二学期第9周)
【高三化学综合练习】
一、选择题(每小题有1~2个正确答案)
1、有关胶体的说法中,正确的是
A、胶体都是均匀透明的液体
B、胶体溶液的电泳现象,证明胶体带有电荷
C、胶体产生丁达尔现象是由胶粒的大小决定的
D、胶粒能透过半透膜,所以可用渗析法提纯胶体
2、下列说法或做法正确的是
A、医生可用三氯化铁溶液作止血剂,原理是电解质使胶体凝聚
B、在蛋白质溶液里加入饱和硫酸铵溶液,可使蛋白质变性
C、用98%的硫酸与纤维素混合后,水浴加热来制取葡萄糖
D、用碱式滴定管盛装高锰酸钾溶液
3、能与铝作用放出H2的溶液中,可以大量共存的离子组是
A、NH4+、Mg2+、SO42-、Cl- B、Cu2+、Na+、HCO3-、Br-
C、Na+、Ba2+、NH4+、NO3- D、K+、Na+、AlO2-、Cl-
4、下列各组离子中,能在水溶液中大量共存,且溶液显酸性的是
![]() ①Na+、NH4+、HCO3-、SO42-、H+ ②Al3+、Na+、H2PO4-、CO32-
①Na+、NH4+、HCO3-、SO42-、H+ ②Al3+、Na+、H2PO4-、CO32-
③H+、Na+、Cl-、 O ④Fe3+、K+、S2-、Cl-
⑤Na+、Al3+、Cl-、AlO2- ⑥Cu2+、NO3-、Mg2+、SO42-
A、②③⑤ B、⑥ C、①⑥ D、①④⑤
5、下列离子方程式中书写正确的是
A、在FeCl3溶液中通入H2S气体: Fe3++H2S=FeS↓+2H+
B、在小苏打溶液中加入过量的Ba(OH)2溶液:Ba2++OH-+HCO-=BaCO3↓+H2O
C、碱式碳酸铜溶于稀硫酸: Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
D、将金属钠加入水中: Na+2H2O=Na++2OH-+H2↑
6、下列离子方程式不正确的是
![]() A、氢氧化铁溶于氢碘酸
Fe(OH)3+3H+=Fe3++3H2O
A、氢氧化铁溶于氢碘酸
Fe(OH)3+3H+=Fe3++3H2O
![]() B、二氧化碳通入苯酚钠溶液中 O -O-+CO2+H2O→ O
-OH+HCO3-
B、二氧化碳通入苯酚钠溶液中 O -O-+CO2+H2O→ O
-OH+HCO3-
C、偏铝酸钠溶液和NaHCO3溶液混合 AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D、氯气通入冷NaOH溶液 2Cl2+2OH-=3Cl-+ClO-+H2O
7、有下列四种溶液,在常温下不用任何试剂就可以将它们区别开的是
A、硫酸钠、氯化钡、碳酸钾、硝酸钾 B、氯化钠、硝酸银、氯化钙、碳酸钠
C、硝酸镁、碳酸氢钾、氯化钡、硫酸铝 D、氢氧化钠、氯化铁、氯化镁、硫酸钾
8、在浓度为C mol·L-1的AgNO3溶液 a mL中,加入一定量的PH=1的盐酸时,恰好将溶液中的Ag+完全沉淀,此时得到PH=2的溶液100mL,(反应前后溶液体积变化忽略不计),则C值应接近于
A、0.002 B、0.011 C、0.11 D、0.2
9、某氨水的PH=a, 其中水的电离度为α1;某硝酸的PH=b,其中水的电离度为α2;已知a+b=14, a>11. 将氨水与硝酸等体积混合后,所得溶液中水的电离度为α3.相同条件下纯水的电离度为α4.则下列关系中正确的是
A、[NO3-]>[NH4+]>[H+]>[OH-] B、α4>α3>α2=α1
C、[NH4+]>[NO3-]>[OH-]>[H+] D、α3>α4>α2=α
10、下列实验的失败是因为缺少必需的步骤造成的是
①锌与稀硫酸反应制取氢气,用排水法收集不到氢气②实验室用无水乙醇和浓硫酸共热1400C,制乙烯时得不到乙烯③验证RX是碘化烷,把RX与NaOH水溶液混合后,加入AgNO3溶液出现褐色沉淀④做醛的还原性实验时,当加入新制的Cu(OH)2悬浊液后,未出现红色沉淀⑤检验淀粉已水解,将淀粉与少量稀H2SO4加热一段时间后,加入银氨溶液后未出现银镜.
A、①②③④⑤ B、①③④⑤ C、③④⑤ D、③⑤
11、某烃的衍生物分子式写成(CH2)m(CO2)n(H2O)p,当它完全燃烧时,生成CO2与消耗O2在同温同压下体积为1:1,则m:n为
A、1:1 B、2:3 C、2:1 D、1:2
12、用石墨作电极电解100mL H2SO4与CuSO4混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中 Cu2+的物质的量浓度为
A、1mol·L-1 B、2mol·L-1 C、3mol·L-1 D、4mol·L-1
13、下列实验操作中,仪器需要插入液面以下的是
①制备Fe(OH)2,胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气简易装置中长颈漏斗的下端管口;③分馏石油时控制温度所用的温度计;④用乙醇制备乙烯时所用的温度计;⑤用水吸收氨气的导气管;⑥向试管中的BaCl2溶液滴加稀H2SO4
A、③⑤⑥ B、②⑤ C、①②④ D、①②③④⑤⑥
14、下列说法中不正确的是
A、氧化镁是优良的耐火材料
B、长期使用的水壶中的水垢主要成分是CaCO3和MgCO3
C、通常焊接钢轨的铝热剂是指铁粉与氧化铁的混合物
D、粗盐在空气中易受潮是因为含有少量MgCl2、CaCl2的缘故
15、设NA为阿伏加德罗常数,下列有关叙述正确的是
A、在标准状况下,22.4LSO3所含分子数约为NA
 B、1mol碳正离子CH5所含电子总数为10NA
B、1mol碳正离子CH5所含电子总数为10NA
C、13g锌和足量稀H2SO4反应,置换出H2分子数为0.2NA
D、0.5mol 1,3—丁二烯分子中含有的C=C双键数为0.5NA
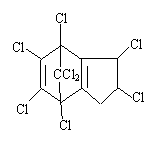
16、氯丹是一种广效性杀虫剂,其结构式如下:
下列关于氯丹组成的叙述中正确的是
A、C、H、Cl的原子个数比5:3:4 B、属于稠环芳香烃
C、分子式为C10H5Cl8 D、含碳量约为30%
17、A、B、C、D四种元素,AB2分子中有22个电子,C离子质子数比中子数少1个,11.5gC与足量水可以放出 5.6L(标况)H2,D与C同周期,D无延展性,但有一定的导电性,且在化合物中主要是共价键,下面叙述正确的是
A、DB2的熔点很低 B、C2B2有非极性键
C、晶体A一定是原子晶体 D、这四种元素的原子序数中只有一个奇数
18、现有苯酚的乙醇溶液,若用该溶液回收苯酚,可供选择的操作有:
①加适量盐酸 ②蒸馏 ③过滤 ④分液 ⑤加足量NaOH溶液 ⑥加足量FeCl3溶液 ⑦加适量乙酸和浓H2SO4混合液 ⑧加足量浓溴水 ⑨加热 ⑩通入过量CO2。
正确的操作步骤是
A、⑦⑨② B、⑤②⑩④ C、⑥②①④ D、⑧③①②
19、在一定温度时,向密闭容器中注入一定量的SO2和O2,引发反应达到平衡时,测得容器内压强为原来的![]() ,则各物质的物质的量(m mol)与反应时间(t min)的关系图中正确的是
,则各物质的物质的量(m mol)与反应时间(t min)的关系图中正确的是
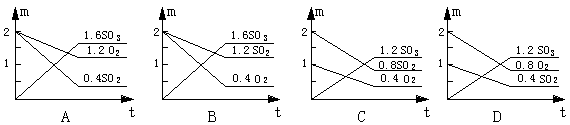
![]() 20、我国拥有世界上最大的稀土矿,品位甚高,以RE表示稀土元素,可以向RE的硫酸盐溶液中加入粉状Na2SO4使稀土转入沉淀,反应为:
20、我国拥有世界上最大的稀土矿,品位甚高,以RE表示稀土元素,可以向RE的硫酸盐溶液中加入粉状Na2SO4使稀土转入沉淀,反应为:
RE2(SO4)3 + Na2SO4 + xH2O RE2(SO4)3·Na2SO4·xH2O(x=1,2)有关叙述正确的是
A、发生的沉淀反应为复分解反应
B、该反应一定在强碱性溶液中进行
C、产生沉淀物属于复盐
D、产生沉淀的反应为物理过程而无化学反应
21、把足量铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原来加入的铁粉质量相等,则原溶液中H+和SO42-的物质的量浓度之比是
A、1:2 B、2:7 C、1:4 D、3:8
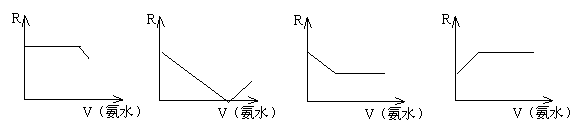 22、在AgNO3溶液中插入一对连接有电阻测量仪的电极,在搅拌下滴加浓氨水,随着氨水的加入(忽略稀释效应),电阻R变化的曲线图中正确的是
22、在AgNO3溶液中插入一对连接有电阻测量仪的电极,在搅拌下滴加浓氨水,随着氨水的加入(忽略稀释效应),电阻R变化的曲线图中正确的是
![]() A
B
C
D
A
B
C
D
23、在25℃,某NH4Cl溶液的PH值为4,下列说法中正确的是
①溶液中[H+]>[OH-],且[H+]·[OH-]=1×10-14 ②由水电离出的[H+]约为1×10-10mol·L-1
③溶液中[Cl-]>[NH4+]>[H+]>[OH-] ④此溶液中水的电离度约为1.8×10-4%
A、①②③ B、①③④ C、②③④ D、①②③④
24、用两支惰性电极插入1000mL CuSO4溶液,通电电解,当电解液的PH由6.0变为3.0时,下列叙述正确的是
A、阳极上析出1×10-3L氧气(标况) B、阴极上析出32mg铜
C、阳极和阴极质量都没有变化 D、阴极上析出11.2mL氢气(标况)
25、已知CuSO4在25℃时的溶液为25g,在此温度下,将50gCuSO4加入100g水中充分搅拌溶解后,所得溶液质量为
A、83.64g B、104.55g C、114.6g D、125g
二、填空
26、实验室用草酸标定氢氧化钠溶液的准确浓度,达到滴定终点时,用酚酞试液作指标剂显浅红色,化学方程式为
![]() H2C2O4
+ 2NaOH
Na2C2O4 + 2H2O
H2C2O4
+ 2NaOH
Na2C2O4 + 2H2O
(1)某学生在用此法测定NaOH溶液浓度的全过程为:
A、为配制0.100mol·L-1的草酸溶液,用电子天平称取H2C2O4·2H2O 1.260g
B、将晶体放入一个500mL的大烧杯中,用蒸馏水溶解,冷至室温
C、将溶液转移至100mL容量瓶中,并洗涤2次,也转移至容量瓶中
D、继续向容量瓶加水,接近标线约2cm时,改用胶头滴管加水至标线
E、反复振荡容量瓶,摇匀。
F、将碱式滴定管用蒸馏水洗3次后注入待测的NaOH溶液
G、调节滴定管液而高度在“0”或“0”刻度以下,同时赶走尖嘴气泡
H、取一锥形瓶,用标准草酸溶液润洗2次,加入20.00mL草酸溶液
I、加入酚酞后滴定,当锥形瓶内溶液颜色由无色至浅红色,且半分钟不褪,滴定终点。
J、根据记录初读数和终读数,NaOH溶液用去23.01mL
指出上述实验过程中的错误之处(填编号)__________________________
(2)另一学生同做该实验,记录有关数据如下:
| 实验次数编号 | 草酸溶液体积V/mL | NaOH溶液体积V/mL |
| 1 | 20.00 | 21.47 |
| 2 | 20.00 | 20.96 |
| 3 | 20.00 | 24.77 |
| 4 | 20.00 | 21.32 |
根据该学生所做实验,请分析NaOH溶液浓度取值合理的是__________________
A、0.0904mol·L-1 B、0.081mol·L-1 C、0.0941mol·L-1 D、0.1880mol·L-1
27、在NaNO2中N元素的化合价为+3价,为证明和研究NaNO2的性质,现有以下几种试剂可供选择:
①KMnO4溶液 ②稀H2SO4 ③稀HNO3 ④稀NaOH溶液
⑤淀粉—KI溶液 ⑥品红溶液
(1)证明NaNO2具有还原性应选择的试剂是______反应的离子方程式为________________
(2)证明NaNO2具有氧化性应选择的试剂是________________反应过程中观察到的实验现象是___________________
(3)在NaNO2溶液中加入稀硫酸时,溶液出现浅蓝色,这说明生成的新物质是_____________,表示这一反应的化学方程式是__________________________
28、重铭酸钾化学式为K2Cr2O7,俗称红矾,有毒。它是可溶性的美丽的红色晶体,将K2Cr2O7跟浓H2SO4混合,发生反应:K2Cr2O7 + H2SO4 == K2SO4 + 2CrO3 + H2O,得到的CrO3是橙红色晶体,与水反应得到红色的溶液。它能将铜件表面处理得很光亮且不易锈蚀。
(1)生成CrO3的反应是由两种基本类型的反应共同完成的,一种是____________反应,另一种是__________反应。
(2)CrO3属于哪一类氧化物_______________
(3)将CrO3的水溶液与过量NaOH反应时,可得到一种类似硫酸钠组成的的黄色盐类,它的化学式为__________________.
29、有甲、乙、丙三种常见单质,在下列反应流程中转化为X、Y、Z三种常见的化合物:
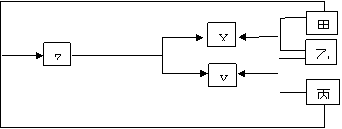 |
![]() O2
O2
![]() 充分燃烧
充分燃烧
(1)在X、Y、Z中一定含有乙元素的有________________________
(2)单质乙是无色气体,它的化学式______________理由是______________________
(3)X、Y、Z的组成(写化学式)可能有二组,它们分别是
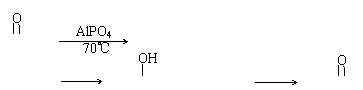 ①________________________②_______________________
①________________________②_______________________
30、已知CH3C—OH CH2=C=O + H2O
CH2=C=O + HCl CH2=C—Cl(极不稳定) CH3—C—Cl,从乙酸出发,
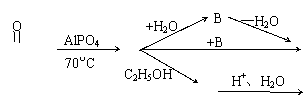 可进行如下图所示的转化
可进行如下图所示的转化
CH3—C—OH A C (C4H6O3)
D B+ ……
(1)上面的乙酸转化图中,取代反应有________________个,加成反应有_________个,消去反应有________________个。
(2)C.D的结构简式为:C _______________D________________
 (3)C的同分异构体甚多,其中含一个—OH的四元环(三个C、一个O构成)的环酯化合物有_________________个。
(3)C的同分异构体甚多,其中含一个—OH的四元环(三个C、一个O构成)的环酯化合物有_________________个。
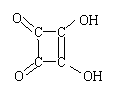
31.1、2—二羟基环丁烯二酮是一种强酸
(1)它的结构简式为
写出它的电离方程式_______________________________
(2)若二个氨基取代了上面化合物中的二个羟基,则变为1,2—二氨基环丁烯二酮。下面是一种叫二氯二氨合铂物质的两种异构体,一个是顺式,简称顺铂,一个是反式,简称反铂。顺铂是一种常用的抗癌药,而反式则无抗癌作用。如果用1,2—二氨基环丁烯二酮代替二个NH3与Pt结合,写出可能存在的新物质的结构简式。
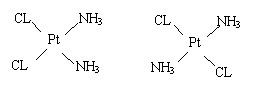 |
___________________________________
(顺 铂) (反 铂)
二、计算
32.现有100mL1moL·L-1的Na2CO3溶液和100moL1.25moL·L-1的盐酸
(1)若将Na2CO3溶液逐滴加入到盐酸中,忽略CO2溶解的量,求收集到CO2的体积(标况)
(2)若将上述盐酸逐滴加入到纯碱溶液中,反应完全后,CO2在溶液中的浓度为0.04moL·L-1 ,假定溶液体积不变。求收集到CO2体积和生成物NaCl的物质的量浓度。
33.用KClO3热分解法制得的O2中常有微量的Cl2和O3,为测定Cl2和O3的含量,将KClO3分解后所得气体V1L通过足量的KI溶液,所得气体干燥后为V2L(标况),再用Na2S2O3滴定KI溶液中生成的I2,反应如下:
O3+2KI+H2O=O2+I2+2KOH ……………………①式
Cl2+2KI=I2+2KCl ……………………②式
I2+2 Na2S2O3=2NaI+ Na2S4O6 ……………………③式
若V1=1.00L,V2=0.98L,滴定时消耗0.10moL·L-1的Na2S2O3溶液0.0267L,求KClO3热分解得到的气体里Cl2和O3的体积分数。
【高三化学综合练习答案】
一、1.C 2.A 3.A D 4.B 5.B C 6.A D 7.C D
8.B 9.B C 10.B 11.C 12.A 13.C 14.B C
15.C D 16.D 17.B D 18.B 19.A C 20.C
21.C 22.A 23.B 24.B 25.B
二、26.(1)B F H (2)D
![]() 27.(1)⑤②,2NO2-+2I-+4H+=I2+2NO +2H2O
27.(1)⑤②,2NO2-+2I-+4H+=I2+2NO +2H2O
(2)①② 紫色褪去
(3)N2O3;2NaNO2+H2SO4=Na2SO4+N2O3+H2O
28.(1)复分解、分解 (2)酸性氧化 (3)Na2CrO4
![]()
![]()
![]() 29.(1)X,Y (2)O2 (3)H2O、SO2、H2S H2O、CO2、CH4
29.(1)X,Y (2)O2 (3)H2O、SO2、H2S H2O、CO2、CH4
30.(1)2,3,1 (2)CH3—C—O—C—CH3、CH3—C—O—C2H5 (3)6
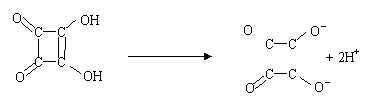 31.(1)
31.(1)
![]() (2)
(2)
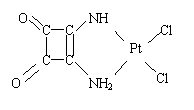 |
32.1.4L 0.381L 0.625moL·L-1
33.CL2%=2% O3%=1%