高三化学组题
一、选择题
1.日本的白川英树、美国的马克迪尔米德和艾伦·黑格尔,由于发现了渗杂聚乙炔具有
良好导电性,因而共同成为2000年诺贝尔化学奖得主,那么关于聚乙炔的以下叙述错误的是:
A 单体为不饱和烃 B 聚乙炔的分子中含有碳碳双键
C 聚乙炔的式量为26 D 聚乙炔中,碳的质量分数为92.3%
2.纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是
A 常温下“纳米铜”比铜片的金属性强 B 常温下,“纳米铜”比铜片更易失电子
C 常温下,“纳米铜”与铜片的还原性相同 D 常温下,“纳米铜”比铜片的氧化性强
3.在星际云中发现一种高对称的有机分子,据分析,该有机分子含碳、氢氮三种原子,分子内有四个氮原子,且4个氮原子排列成四面体,每两个氮原子间都有一个碳原子,且分子内无碳碳单键和碳碳双键,该化合物的分子式为:
A C3H8N4 B C6H12N4 C C6H10N4 D C4H8N4
4.2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成分是![]() 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
(A)它们的表面都电镀上一层耐腐蚀的黄金
(B)环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
(C)铜的金属活动性比氢小,因此不易被氧化
(D)它们是含一定比例金、银、锡、锌的铜合金
![]() 5.毒气沙林的主要成份甲氟磷酸异丙酯的结构为F—P—O—CH
5.毒气沙林的主要成份甲氟磷酸异丙酯的结构为F—P—O—CH![]() ,消除环境的沙林
,消除环境的沙林
CH3
毒气最好喷洒
(A)食盐水 (B)稀盐酸 (C)酒精 (D)肥皂水
|
(A)![]() 的电子式为
的电子式为
(B)![]() 可进行反应,在液态氢中形成
可进行反应,在液态氢中形成![]() 、
、![]() 、
、![]()
(C)![]() 可在液态氢中形成
可在液态氢中形成![]() 、
、![]() 、
、![]() (D)
(D)![]() 广泛存在于固态、液态和气态氢中
广泛存在于固态、液态和气态氢中
7.近来查明,二氧化三碳是金星大气层中的一种组成部分,下列关于二氧化三碳的说法错误的是
A 二氧化三碳的电子式为![]() B C3O2、CO、CO2都是碳的氧化物
B C3O2、CO、CO2都是碳的氧化物
C C3O2和CO一样可以燃烧生成CO2 D C3O2和H2O反应可得H2CO3
8、国外试行用汽水(碳酸饮料)浇灌农田,它的作用是
①对植物呼吸作用有利 ②改良碱性土壤,调节pH值
③有利于土壤中的![]() 被植物吸收 ④加速光合作用进行
被植物吸收 ④加速光合作用进行
(A)只有②、③、④正确 (B)只有②、④正确
(C)只有①、④正确 (D)全部都正确
9、在5支编号的试管里分别装有![]() 溶液,现需要用最少种类的试剂将它们一一区别开来,则所需试剂的种类是
溶液,现需要用最少种类的试剂将它们一一区别开来,则所需试剂的种类是
(A)用1种试剂 (B)用2种试剂 (C)用3种试剂 (D)不用任何试剂
10、2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成分是![]() 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是
(A)它们的表面都电镀上一层耐腐蚀的黄金
(B)环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
(C)铜的金属活动性比氢小,因此不易被氧化
(D)它们是含一定比例金、银、锡、锌的铜合金
11、下列实验方案合理的是
(A)混有乙酸、乙醇杂质的乙酸乙酯用饱和碳酸钠溶液进行除杂
(B)用加入浓溴水的方法分离苯和苯酚的混合物
(C)用点燃的方法除去二氧化碳中混有的少量一氧化碳
(D)用热的氧化铜除去氮气中的少量氧气
12、下列物质在一定条件下,既能和某些非金属单质、金属单质反应,又能和某些金属氧化物,非金属氧化物反应的是
(A)NaOH溶液 (B)稀![]() (C)NaCl溶液 (D)
(C)NaCl溶液 (D)![]()
13、对反应![]()
![]()
![]() ,在一定条件下达到平衡,在温度不变时,欲使
,在一定条件下达到平衡,在温度不变时,欲使![]() 的比值增大,应采取的措施是
的比值增大,应采取的措施是
(A)体积不变,增加![]() 的物质的量(B)体积不变,增加
的物质的量(B)体积不变,增加![]() 的物质的量
的物质的量
(C)使体积增大到原来的2倍 (D)充入![]() ,保持压强不变
,保持压强不变
14、对于弱电解质的稀溶液,温度一定时,加水稀释至原来浓度的![]() 时,其电离度将增大到原溶液电离度的
时,其电离度将增大到原溶液电离度的![]() 倍。现有pH=2的某一元弱酸溶液10mL,加水稀释至1L后,溶液的pH为
倍。现有pH=2的某一元弱酸溶液10mL,加水稀释至1L后,溶液的pH为
(A)等于4 (B)在3—4之间 (C)等于3 (D)在2—3之间
15、一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:![]()
![]() ,有关此电池的推断正确的是
,有关此电池的推断正确的是
(A)电解质溶液中![]() 向正极移动(B)放电一段时间后,KOH的物质的量浓度不变
向正极移动(B)放电一段时间后,KOH的物质的量浓度不变
(C)通乙烷的电极为负极 (D)参加反应的![]() 和
和![]() 的物质的量比为7∶1
的物质的量比为7∶1
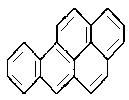 16、苯并[a]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照 物),其结构式中有5个环互相并合如图。每个碳原子上都有1个双键(C=C),分子中共有m个双键,五个环都处在同一平面上,分子中可能同时处于同一平面上的原子数为n个,则m、n分别为
16、苯并[a]芘是一种稠环芳香烃(它的分子是研究致癌效应的参照 物),其结构式中有5个环互相并合如图。每个碳原子上都有1个双键(C=C),分子中共有m个双键,五个环都处在同一平面上,分子中可能同时处于同一平面上的原子数为n个,则m、n分别为
(A)10、30 (B)10、32 (C)11、30 (D)11、32
17、工业上用氨和二氧化碳反应合成尿素:![]() ,已知下列物质在一定条件下均能与水反应产生
,已知下列物质在一定条件下均能与水反应产生![]() 和
和![]() ,
,![]() 是合成氨的原料,
是合成氨的原料,![]() 供合成尿素用。若从充分利用原料的角度考虑,为了使
供合成尿素用。若从充分利用原料的角度考虑,为了使![]() 与
与![]() 的物质的量之比接近3∶1,最好选用
的物质的量之比接近3∶1,最好选用
(A)石脑油(![]() 、
、![]() ) (B)
) (B)![]() (C)CO (D)碳
(C)CO (D)碳
18、氮气是空气的主要组成部分。因此有科学家根据蒸气机的原理,设计制造出了液氮蒸气机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的。其原理的主要依据是
A N2在空气中燃烧放热 B N2与H2反应放热
C N2在空气中约占78%(体积百分数 D 液态氮的沸点为-195.8℃,远低于常温
19、下列说法不正确的是
①往水泥熟料里加石膏,是为了调节水泥的硬化速度 ②医疗上可用碳酸钡作X射线透视肠胃的内服药 ③水玻璃在建筑工业上用作粘合剂 ④炼铜后期向钢水中加入适量的铝或锰铁,是为了除尽钢水中的碳硅等杂质 ⑤氯化铵可用在金属的焊接上,以除去金属表面的氧化物薄层 ⑥“来苏水”是甲醛40%的皂液 ⑦氯化铝、氯化铁、明矾都可用作净水剂
A ②③⑦ B ④⑤⑥ C ①③⑤ D ②④⑥
20、有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3五瓶无标签溶液,为鉴别它们,取四支试管分别各装入一种溶液,再向上述四支试管中加入少许剩下的一种溶液,下列叙述中错误的是
A 若三支试管出现沉淀时,则后加入的是AgNO3溶液
B 若全部没有明显现象时,则后加入的是NH4NO3溶液
C 若一支试管出现气体,两支试管出现沉淀时,则后加入的是HCl溶液
D 若仅有两支试管出现沉淀时,则后加入的是BaCl2溶液
二、填空题
21.(9分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为:1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成极易溶于水的酸性气体Y。X分子与![]() 分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为
分子中的电子数相同、Y分子中的电子数为18,A,B,D形成离子化合物,其化学式为![]() ,其水溶液呈弱酸性;请回答:
,其水溶液呈弱酸性;请回答:
(1)元素符号A 、B 、C 、D 。
(2)写出化学方程式:![]() 和X(过量)反应
。
和X(过量)反应
。
(3)![]() 的化学式
,其水溶液呈酸性的离子方程式 。
的化学式
,其水溶液呈酸性的离子方程式 。
(4)液态X能电离(可根据![]() 电离推知),其阴离子电子式
。
电离推知),其阴离子电子式
。
22.(6分)非整比比合Fe0.95O具有NaCl晶体结构,由于n(Fe):n(O)<1,所以晶体结构存在缺陷。
①Fe0.95O中Fe(II)和Fe(III)各点总铁量的Fe(II) %,Fe(III) %
②写出标明铁价态的化学式
23.为测定碳酸钙纯度(设含杂质SiO2),某学生设计了如下几个实验方案,请回答每个方案中的问题:
方案I:(1)称取碳酸钙样品mg。(2)加入过量盐酸 (3)收集并测定生成气体体积Vml。
问题a:如果你称量样品时,砝码底部有一处未被人发现的残缺,那么测得的碳酸钙纯度会偏 (填高、低、无影响)
方案II(1)称取碳酸钙样品mg(2)高温煅烧1000℃直至质量不再改变,冷却后称量质量为m′g。
问题b:如何确定质量已不再改变?
问题c:本方案中应如何“冷却”?
方案III(1)称取碳酸钙样品mg。(2)用Cmol·L-1盐酸Vml(过量)溶解样品,(3)取溶解后溶液的![]() ,用
,用![]() mol·L-1 NaOH溶液滴定恰好用去
mol·L-1 NaOH溶液滴定恰好用去![]() ml。
ml。
问题d:列出本实验中还需用到的试剂、仪器名称(除铁架台、烧杯、铁架台及附件外)
问题e:加盐酸后,是否需要滤出SiO2后再用NaOH滴定 。
A 需要 B 不需要 C 均可
问题f:碳酸钙纯度计算列式
方案IV(1)称量碳酸钙样品mg(2)加入足量Cmol·L-1HCl
Vml使之完全溶解(3)过滤并取滤液(4)在滤液中加入过量![]() mol·L-1 Na2CO3溶液V′ml(5)将步骤(4)中沉淀滤出,洗涤干燥,称重m′g
mol·L-1 Na2CO3溶液V′ml(5)将步骤(4)中沉淀滤出,洗涤干燥,称重m′g
 问题g:此方案中不需要的数据是
A CV B
问题g:此方案中不需要的数据是
A CV B ![]() C
C ![]() D m
D m
问题h:为减少误差,步骤(4)反应应
A 精确测定Na2CO3溶液体积V′ml B 精确配制Na2CO3溶液浓度C′mol·L-1
C 将步骤(3)所得沉淀洗涤、洗涤液应一起并入(4)中
D 将步骤(3)所得沉淀洗涤、干燥、称重其质量![]() 备用,
备用,
综上所述,你认为四个方案中,最好的方案是 。
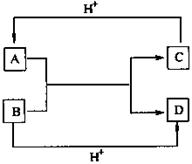
24.(9分)已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下转化关系:
(1)如果A、B、C、D均是10电子的微粒,请写出:
A的结构式 ;
D的电子式 。
(2)如果A和C是18电子的微粒,B和D是10电
子的微粒,请写出:
①A与B在溶液中反应的离子方程式 ;
②根据上述离子方程式,可以判断C与B结合质子的
能力大小是(用化学式或离子符号表示):
> 。
(3)已知肼(![]() )和甲胺(
)和甲胺(![]() )都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。
)都是含18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):
。
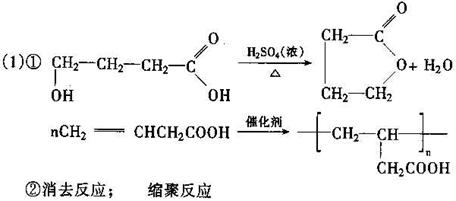
25.(12)以石油产品乙烯为超始原料进行合成高分子化合物F和G,下图所示为合成路线图:
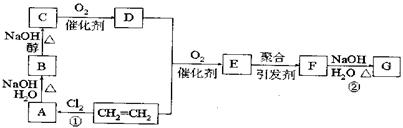
|
![]() CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
CH2=CH2+CH3COOH
C4H6O2(醋酸乙烯酯)
|
|
|
|
又知:与![]() 结构相似的有机物不稳定,发生分子重排生成
结构相似的有机物不稳定,发生分子重排生成![]()
请回答下列问题:
(1)写出结构简式:E: F:
(2)反应①、②反应类型:① ②
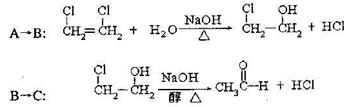
(3)写出A→B、B→C的化学方程式:
A→B: B→C:
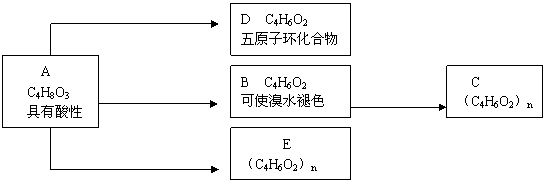
26、(1)A、B、C、D、E之间有如下图所示关系。化合物C和E都是医用功能高分子材料,且有相同的元素质量分数,均可以由化合物A(C4H8O3)制得;而化合物B和D互为同分异构体。
 浓硫酸
浓硫酸
加热
浓硫酸 一定条件下
加热
一定条件下
①写出下列化学方程式(有机物用结构简式):
A→D 。
B→C 。
②写出下列反应类型:A→B , A→E 。
③写出A的同分异构体(同类别且有支链)的结构简式:
。
(2)蛋白质由氨基酸缩聚而成,蛋白质水解得多肽,多肽彻底水解得到氨基酸,科学家研究某多肽的分子式是C55H70N10O19将其彻底水解后只得到4种氨基酸:甘氨酸(C2H5NO2)、丙氨酸(C3H7NO2)、苯丙氨酸(C9H11NO2)、谷氨酸(C5H9NO4)
①这个“多肽”是 肽。
②该多肽水解后,有 个甘氨酸,有 个丙氨酸,有 个苯丙氨酸,有 个谷氨酸。
27、肌安松是常用的肌肉松弛药,其结构简式为:
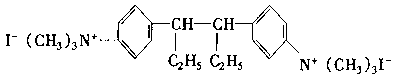
有人设计了用A物质(C13H18O3)合成肌安松和其他有机产品的合成路线,如下图所示:
![]() 已知:2CH3CH2Br+2Na CH3CH2CH2CH3+2NaBr
已知:2CH3CH2Br+2Na CH3CH2CH2CH3+2NaBr
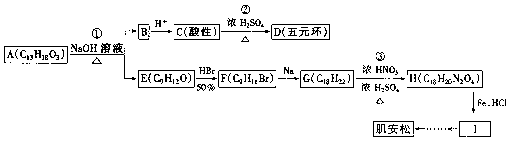
试回答:
(1)写出下列物质的结构简式:
A 、F ;
(2)写出下列有关反应的化学方程式(用结构简式表示)
① ,
② ,
③ 。
三、计算题
30、现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol ,Cu的物质的量分数为x;研成粉末后,全部投入含bmol![]() 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)用微粒符号填写下列空白(列举出全部可能的情况)。
| ① | ② | ③ | ④ | |||
| 残留固体成份 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有![]() 时,则b的取值范围是(用a、x表示)
。
时,则b的取值范围是(用a、x表示)
。
(3)当x=0.5时,溶液中![]() 的物质的量相等时,在标准状况共产生672mL气体。求a、b的值
的物质的量相等时,在标准状况共产生672mL气体。求a、b的值
参考答案:
1、C 2、C 3、B 4、D 5、D 6、AC7、D8、A9、A10、D11、A12AD13、CD14、C15、C
16、B17、A18、D19、D20、C
21(9分)(1)O、H、Cl、N(每空1分)
![]() (2)
(2)![]() 。
。
或![]() 。(2分)
。(2分)
(3)![]() (1分)
(1分) ![]()
![]()
![]() (1分)
(1分)
22、① 89.5 10.5 ② 17FeO·Fe2O3
23、问题a:低 问题b:第一次称量后,再加热;再称量,至两次称量误差不超过0.1g为止。问题c:应在于容器内冷却
问题d:天平(附砝码),碱式滴定管、酚酞,锥形瓶
问题e: B 问题f:![]() 问题g: AB 问题h: C III
问题g: AB 问题h: C III
24、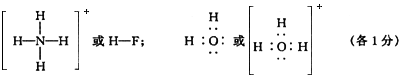
(2)①![]()
②![]() (各2分)(3)
(各2分)(3)![]() 、
、![]() 、
、![]()
25.(12分)
(1)![]()
(2)① 加成反应: ② 水解反应
(3)
(3)(2分)根据电子守恒:![]()
![]() ………………1分
………………1分
又知:3Cu——8![]()
![]() ——
——![]() Fe——4
Fe——4![]() (生成
(生成![]() )
)
0.02mol
![]() 0.01mol
0.01mol ![]() 0.01mol 0.04mol
0.01mol 0.04mol
![]() ……………………………………………1分
……………………………………………1分
又知:3Cu——8![]()
![]() ——
——![]() Fe——4
Fe——4![]() (生成
(生成![]() )
)
0.02mol
![]() 0.01mol
0.01mol ![]() 0.01mol 0.04mol
0.01mol 0.04mol
![]() ……………………………………………1分
……………………………………………1分
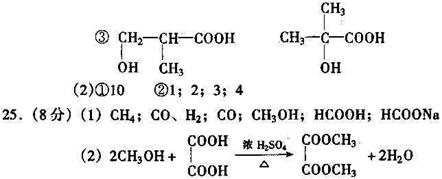
30、
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成份 | Fe、Cu | Cu | Cu | — | — | — |
| 溶液中的金属离子 |
|
|
|
|
|
|
(2)(4分)![]() …………………………1分
…………………………1分
ax
![]()
![]() .………………………1分
.………………………1分
![]()
![]()
总耗用硝酸量:![]() ……………………………………1分
……………………………………1分
∴![]() ……………………………………………………………………1分
……………………………………………………………………1分