高三级测练卷(化学)
可能用到的相对原子质量:H 1 C 12 N 14 0 16 A1 27 S 32 Fe 56 Cu 64
第Ⅰ卷 (选择题:共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意,将答案填在后面的答案栏里。)
1.我国60岁以上的老年人已经超过1.3亿,老年人的长寿和抗衰老问题已受到全社会的关注。已知对人类长寿有益的微量元素有锌、硒、铜、锰、铂、铬等,其中属于主族元素的是:
A.锌 B.硒 C.铜 D.都不是属于主族元素
2.下列实验操作中不能用来提纯物质的是:
A,蒸馏 B,分液 C.滴定 D.重结晶
3.mg氧气中含氧气分子数为a,则ng臭氧中含氧原子数为:
![]()
4. A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法一定正确的是:
A. A和M原子的电子总数之和为11 B. A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为7 D.A和M原子的最外层电子数之差为7
5.把足量的铁粉投人硫酸和硫酸铜的混合溶液中,充分反应后所得金属固体的质量与原来铁粉质量相同,则原溶液H十与SO42-的物质的量之比为:
A .1:2 B .2:7 C .1:4 D .3:8
6.已知在一定温度下可逆反应:A(g)+2B(g)![]() 2C(g)达平衡,A、 B、C正反应速率分别用v(A)、v(B)、V(C)表示,逆反应速率分别用v’(A)、v’(B)、v’(C)表示。则下列关系正确的是:
2C(g)达平衡,A、 B、C正反应速率分别用v(A)、v(B)、V(C)表示,逆反应速率分别用v’(A)、v’(B)、v’(C)表示。则下列关系正确的是:
A.v(A)=V(C) B.2 v(A)=v’(C) C.v’(A)=v(B) D.v(A)=2 v’(C)
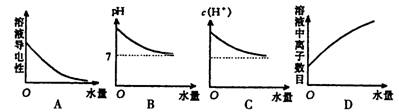
7.常温下,将水滴人一定体积的0.1mol·L-1的氨水中,下列变化的图象不合理的是:
8. 10.8 g氮的氧化物NxOy和50 g灼热的铁在密闭真空容器中反应一段时间后,生成0.1mol
Fe3O4和0.1 mol N2,NxOy是:
A.NO B.N203 C.NO2 D.NZO5
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个
且正确的给2分;选两个且都正确的给4分,但只要选错一个,该小题就为0分,将答案
填在后面的答案栏里。)
9.下列各物质中,所有原子都满足最外层为8电子结构的是:
A.CH4 B.PC13 C.BF3 D.N2
10. 38.4 mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 mL(标准状况),反应消耗的HN03的物质的量可能是:(不考虑由NOz生成凡q的反应)
A.1.0 ×10-3mol
B.1.6×10-3mol C.2.2×10-3mol D.2.4×10-3mol
11.在某无色透明的溶液中,能大量共存的离子组是:
A.K+、NH4+、C1-、OH- B.Na+、K+、MnO4-、I-
C.Ba2+、Na+、HCO3-、OH- D.Al3+、H+、Cl一、SO42-
12.向下列溶液中投人镁粉,镁粉溶解且放出气泡的是:
A.K2SO4 B.NH4Cl C.NaHSO4 D.NaHCO3
13.氯化铯晶胞(晶体中重复的结构单元)如图(1)所示,该晶体中Cs+与 Cl-的个数比为1:1,化学式为CsCl.若某晶体晶胞结构简式如图(2),其中含有A、B、C三种元素的微粒,则该晶体中A、B、C的微粒个数比为:
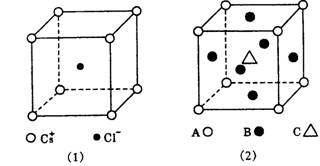
A.8:6:1 B.4:3:1 C.1:6:1 D.1:3:1
14. 0.01 kg氢气完全燃烧生成液态水要放出1429 kJ的热量,则以下热化学方程式的表示正确的是:
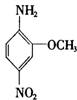
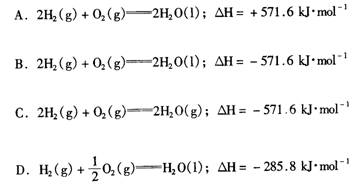
15.2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑色等有机颜料,其结构简式如图所示。若分子式与红色基B相同,且氨基(一NH2)与硝基(一NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为:
A.2种 B.4种 C.6种 D.10种
16.两种有机物以一定比例混合,一定条件下在a L02(足量)中燃烧,充分反应后,再通过足量Na2O2层,恢复到原状态气体体积仍是a L,下列混合有机物中可能符合此条件的是:
A.CH4 C2H4
B.CH3CH2OH CH3COOH C.C2H6 HCHO D,HCOOH CH3COOCH3
17.克隆生命体的关键技术之一是找到一些特殊的酶,它们能激活普通体细胞使之象生殖细胞一样发育成个体,下列有关酶的说法错误的是:
A..酶是具有催化作用的蛋白质 B.酶催化作用的特点是具有专一性和选择性
C.高温或重金属盐能使酶的活性暂时丧失 D.酶只有在强酸或强碱的条件下才能发挥作用
18.标准状况下,向3 mol·L-1的NaOH溶液100ML中缓慢通人4.48 LCO2气体,充分反应后溶液中离子浓度C大小排列顺序正确的是:
A. C(Na+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+)
B.
B.
B.C(Na+)>C(CO32-)=C(HCO3-)>C(OH-)>C(H+)
C.C(Na+)>C(HCO3-)>C(OH-)>C(CO32-)>C(H+)
D.C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
第Ⅱ卷 (非选择题:共78分)
三、(本题包括2小题,共19分)
19.(7分)有一瓶NaNO3溶液,混人少量的Ca(H2PO4)2和NaBr,请设计一个实验方案,除去NaNO3溶液中混人的杂质。供选用的试剂:①稀盐酸②稀硝酸③稀硫酸④NaOH溶液⑤KOH溶液⑥Na2CO3溶液⑦AgNO3溶液⑧K2CO3溶液
要求:选用试剂不超过四种,同种试剂不得重复使用。
(1)请在下列操作顺序的括号内填人所加物质的化学式:
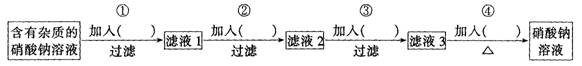
(2)在加人某试剂除去NaN03溶液中的Br-,如何检验Br一已经沉淀完全?
20.(12分)1, 2一二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18·cm-1,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2一二滨乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
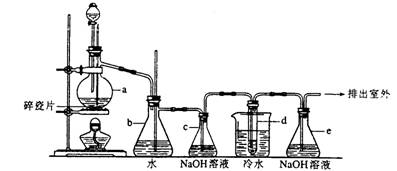
(1)写出本题中制备1, 2一二溴乙烷有关的两个化学反应方程式:
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象_________。
(3)容器c中NaOH溶液的作用是___________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。
_____________________________。
四、(本题包括2小题,共21分)
21.(9分)(1) 0.02 mol/L的HCN溶液与0.02 mol/L NaCN溶液等体积混合,已知该混合溶液中C(Na+)>C(CN-),用(“>、<或=”符号填空):
①溶液中C(OH-)__C(H+) ②C(HCN)__C(CN-)
③C(HCN)+C(CN-)____0.02 mol/L
(2)①向明矾溶液中逐滴滴人氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH __7 (填“<”、“>”或“=”),离子反应总方程式为:
____________________________
②向明矾溶液中逐滴加氢氧化钡溶液至铝离子刚好沉淀完全时,溶液的pH _____7(填 “<”、“>”或“=”),离子反应总方程式为:
_______________
(3)现有一反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)+ 热量,在850℃时,K=
CO2(g)+H2(g)+ 热量,在850℃时,K=![]() ,K为平衡常数,其数值只随温度变化,与其它条件无关。
,K为平衡常数,其数值只随温度变化,与其它条件无关。
①若升温到950℃,达到平衡是,K_______1。(填“<”、“>”或“=”)。
②850℃时,固定容积的密闭容器中,放人混合物,起始浓度:C(CO)=0.01 mol/L, C(H2O)=0.03mol/L,C(CO2)=0.01mol/L,C(H2)=0.05mol/L,则反应开始时,H2O的消耗速率比生成速率______(填“大”、“小”或“不能确定”)。
22.(12分)下图是中学化学中常见的物质间化学反应关系图示,其中未注明用量的物质间的反应均按恰好充分反应处理,其他有关信息已在框图中说明:
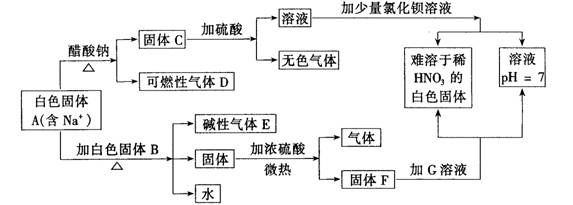
(1)写出下列物质的化学式:
A:_____、C:____、D:____、E:_____、F:______
G:____
(2)写出下列反应的化学方程式:
A→D气体:___________________________。
(3)白色固体B的化学式是否能确定?______。理由是___________________________。
五、(本题包括2小题,共20分)
23.(6分)如果定义有机物的“同系列”是一系列结构式符合![]() (其中n=1、2…)的化合物。其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差。
环氧乙烷
(其中n=1、2…)的化合物。其中A、B为任意的一种基团或原子,W为二价的有机基团,又称同系列的系差。
环氧乙烷![]() 与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚。其反应原理可表示为:
与乙二醇作用,控制一定的反应条件和反应物的用量,可生成一系列的双官能团的化合物,称为多缩乙二醇醚。其反应原理可表示为:
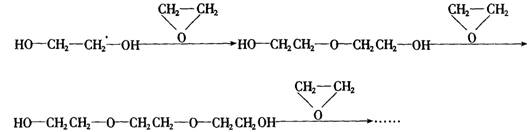
(1)以![]() 的形式表示上述一系列醇醚的结构简式________。
的形式表示上述一系列醇醚的结构简式________。
(2)写出上述同系列的分子式通式____________。
(3)推算出该同系列化合物中碳元素的质量分数最大值为________。
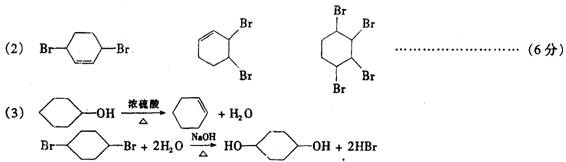
24.(14分)已知:a 1,3一丁二烯(H2C═CH─CH═CH2)与Cl2加成时可发生在1,2位和1,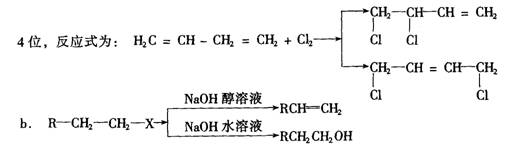
利用上述信息按以下步骤从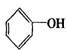 合成
合成![]() (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)
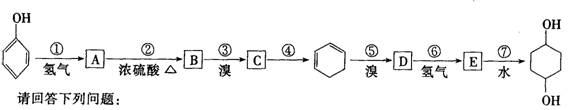
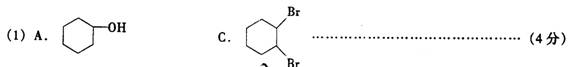
(1)分别写出A、C的结构简式:
A:___C:____。
(2)如果不考虑⑥、⑦反应,对于反应⑤得到的D的可能结构简式为____
(3)写出反应②、⑦的化学方程式:___________________
六、(本题包括2小题,共18分。)
25.(8分)超微小氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:
Al2O3+N2+ 3C![]() 2AlN + 3C0,由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为
测定该产品中有关成份的含量,进行了以下两个实验:
2AlN + 3C0,由于反应不完全,氮化铝产品中往往含有碳和氧化铝杂质。为
测定该产品中有关成份的含量,进行了以下两个实验:
(1) 10.00 g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36 L(标准状况)。
①上述反应的化学方程式为__________________
②该样品中的AlN的质量分数为____________________
(2)另取10.00 g样品置于反应器中,通人2.016 L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AlN不跟O2反应)。该样品中含杂质碳的质量分数为______________________.
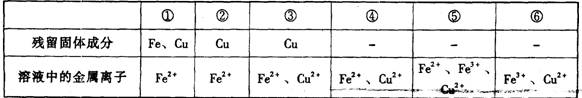
26.(10分)现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数 为x;研成粉末后,全部投人含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1) 用微粒符号填写下列空白。(列举出全部可能的情况)
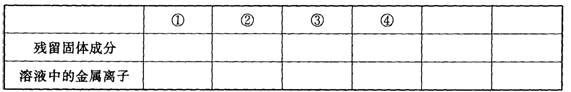
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是:
(用a, x表示)__________________。
(3) x=0.5 时 ,溶液中Fe2+、Fe3+的物质的量相等时,在标准状况下共产生672 mL气体。
求a, b的值。
高三级测练卷
化学科参考答案及评分标准
一、选择题,(本题包括8小题,每小题4分,共32分。)
1.B 2.C 3.A 4.C 5.C 6.B 7.C 8.C
二、选择题(本题包括10小题,每小题4分,共40分。)
9.BD 10.C 11.D 12.BC 13.D 14.BD 15.D 16 .D 17 .CD 18.D
三、(本题包括2小题,共19分。)
19.(7分)
(1)①NaOH ②AgNO3 ③Na2CO3 ④HNO3·····……(4分)
(2)在滤液中加人AgNO3溶液,如果无沉淀生成,说明Br一已沉淀完全。…………(3分)
20.(12分)
![]()
(2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。…………(2分)
(3)除去乙烯中混有的酸性气体(或除去CO2、SO2)………………(2分)
(4)原因:①乙烯产生(或通过液溴)的速率过快。 ②实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃或答温度控制不当,………………(4分)
四、(本题包括2小题,共21分)
21.(9分)
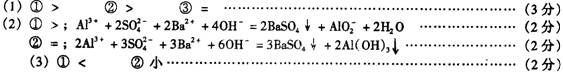
22.(12分)
(l)A.NaOH C.Na2CO3 D.CH4 E.NH3 F.NaHSO4, G.Ba(OH)2……(9分)
![]() (3)不能;只能确定含有NH4+,而阴离子可能是C1- , CO32-等。……(1.5分)
(3)不能;只能确定含有NH4+,而阴离子可能是C1- , CO32-等。……(1.5分)
五、(本题包括2,小题,共20分。)
23.(6分)
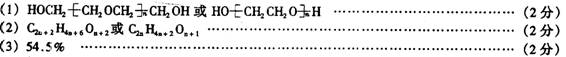
24.(14分)
六、(本题包括2小题,共18分。)
25.(8分)

26.(10分)
(1)………………………………(3分)