高三年级第一次阶段测试化学试卷
第Ⅰ卷(客观题 共45分)
一、选择题(本题包括9小题,每小题2分,共18分。每小题只有一个选项符合题意)
1.设NA代表阿伏加德罗常数的值,下列说法正确的是 ( )
A.1.8g铵离子所含的电子数为1.1NA
B.1mol白磷分子中所含共价键数为4NA
C.标况下22.4L乙醇所含的分子数必定为NA
D.在电解食盐水的实验中,测得电解后溶液的pH为14,又知电解后溶液总体积为1L,则阴极析出的气体的分子数为0.5NA
2.13C—NMR(核磁共振)15N—NMR可用于测定蛋白质核酸等生物大分子的空间结构,Kurt Wuthrich等人为此获得2002年诺贝尔化学奖。下列有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数 B.13C与C60有相同的中子数
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
|
|
|
C. D.
4.已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.![]()
B.![]()
C.![]()
D.![]()
5.已知反应:![]() ,下列有关说法正确的是 ( )
,下列有关说法正确的是 ( )
A.该反应不属于氧化还原反应
B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C
D.氧化剂与还原剂的物质的量之比为1:2
6.下列说法正确的是 ( )
A.离子化合物中一定含有金属元素
B.构成分子晶体的微粒中一定含有共价键
C.原子晶体熔化要破坏共价键
D.只有离子化合物中才存在离子
7.相同温度下等物质的量浓度的下列溶液中,pH最小的是 ( )
A.NH4Cl B.NH4HCO3
C.NH4HSO4 D.(NH4)2SO4
8.下列离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液
HCO3-+OH-====CO32-+H2O
B.氯化铁溶液中通入硫化氢气体
2Fe3++S2-====2Fe2++S↓
C.次氯酸钙溶液中通入过量二氧化碳
Ca2++2ClO-+H2O+CO2====CaCO3↓+2HClO
D.氯化亚铁溶液中加入稀硝酸
3Fe2++4H++NO3-====3Fe3++2H2O+NO↑
9.下列物质加入水,能使水的电离程度增大,溶液的pH减小的是 ( )
A.HCOOH B.Al2(SO4)3
C.NaHS D.NH3·H2O
二、选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意。)
10.有a g质量分数为15%的NaNO3溶液,将其质量分数变为30%,可采用的方法是( )
A.蒸发掉溶剂质量的![]() 的水
的水
B.蒸发掉溶质质量的![]() 的水
的水
C.加入![]() 固体
固体
D.加入15%的NaNO3溶液a g
11.在反应X+2Y R+2M中,已知R和M的摩尔质量之比为22:9,1.6gX与Y恰好反应后,生成4.4gR,则此反应中Y和M的质量之比为 ( )
A.16:9 B.23:9
C.32:9 D.46:9
12.在一定温度下,b g固体A能完全溶解水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯定不可能的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
13.由于水电离产生的![]() 满足此条件的溶液中,一定可以大量共存的离子组是 ( )
满足此条件的溶液中,一定可以大量共存的离子组是 ( )
A.K+、Mg2+、SO42-、MnO4- B.Na+、Cl-、NO3-、SO42-
C.Al3+、NH4+、Cl-、SO42- D.Na+、AlO2-、Br-、Cl-
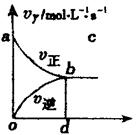
14.在容积固定的2L密闭容器中,充入X、Y气体各2mol发生反应X(g)+2Y(g)
2Z(g),
|
应区域的面积) ( )
A.2-Saob B.1-Saob
C.2-Sabdo D.1-Sbod
15.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应:
![]() 2R(g)+5Q(g)
4X(g)+nY(g)
2R(g)+5Q(g)
4X(g)+nY(g)
反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则它学方程式中的n值是 ( )
A.2 B.3
C.4 D.5
16.将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.6g/cm3),用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是NaOH的质量分数阳极析出物的质量(g)阴极析出粉的质量(g) ( )
A.0.061(6.2%) 19 152
B.0.061(6.2%) 152 19
C.0.042(4.2%) 1.2 9.4
D.0.042(4.2%) 9.4 1.2
17.具有相同电子层结构的三种粒子、An+、Bn-、C,下列分析正确的是 ( )
A.原子序数比较C>B>A
B.粒子半径比较Bn->An+
C.C一定是稀有气体元素的原子
D.原子半径比较A<C<B
18.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的是 ( )
A.c(Na+)+c(H+) c(HCO3-)+c(CO32-)+c(OH-)
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
第Ⅱ卷(主观题 共55分)
三、(本题包括4小题,共22分)
19.(6分)25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知![]() ,请填空白:
,请填空白:
(1)a值可否等于3(填“可”或“否”) ,理由是 。
(2)a值可否等于5(填“可”或“否”) ,理由是 。
(3)a的取值范围是 。
20.(6分)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3,请回答:
(1)Na3N的电子式为 。
(2)Na3N与盐酸反应的化学方程式 。
(3)比较Na3N中两种微粒的半径 。
21.(5分)燃料电池是燃料(如H2、CO、CH4、CH3OH等)跟氧气起反应将化学能转变为电能的装置,电解后溶液是强碱溶液,请写出甲醇燃料电池负极的电极反应式:
。
22.(5分)(1)配平下列离子反应方程式
Fe(OH)3+ ClO-+ OH- ——→FeO4n-+ Cl-+ H2O
(2)已知有3.21gFe(OH)3参加反应,共转移了5.4×1022个电子,则n= ,FeO4n-中铁元素的化合价为 。
(3)根据①、②推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
四、(本题包括3小题,共24分)
23.(7分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它伞兵质量分别为mA、mB、mC,与足量盐酸反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl),已知mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl).请(1)写出短周期IA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为 。
(4)若A和B为ⅡA族元素的的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,nB:nC=1: 。(保留2位小数)
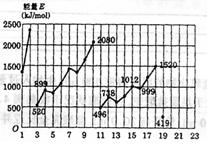
24.(5分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题:
|
(1)同主族内不同元素的E值变化的特点是: ,各主族中E值的这种变化特点体现了元素性质的 变化规律;
(2)同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象。试预测下列关系中正确的是 (填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:
<E<
(4)10号元素E值较大的原因是 。
25.(12分)(Ⅰ)恒温、恒压下,在一个可变容积的容器中发生如下反应:
![]() A(气)+B(气) C(气)
A(气)+B(气) C(气)
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为
mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol.
(3)若开始时入xmolA和2molB,1molC到达平衡后,生成A和C的物质的量分别是ymol和3amol,则x= mol,y= mol,平衡时,B的物质的量 (选填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于,等于或小于2mol
作出判断的理由是
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
。
(Ⅱ)若维持温度不变,在一个与(Ⅰ)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成bmolC.将b与(Ⅰ)小题中的a行比较
(选填一个编号)。
(甲)a<b (乙)a>b
(丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是
五、(9分)
26.(9分)向某二价金属M的氢氧化物的澄清溶液100mL中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标准状况下收集到4.48L气体。将滤液加水稀释至250mL,取出25.0mL恰好与20.0mL盐酸完全反应并收集到1.12L(标准状况下)气体。
(1)若欲计算M的相对原子质量,你认为还必须提供下列哪组数据 。(填代号)
A.M的氢氧化物溶液的浓度(设为2.00mol/L)
B.MCO3沉淀的质量(设为39.4g)
C.与MCO3反应的盐酸的浓度(设为1.00mol/L)
D.题设条件充足,不需补充数据
(2)根据你的选择,计算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量。(要有过程)
高三年级第一次阶段测试
化学试卷答案
一、选择题(每小题2分,共18分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | C | C | B | D | C | C | D | B |
二、选择(每小题3分,共27分)
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | A | C | B | B | A | B | B | B |
三、(22分)
19.(6分)
(1)否 若a=3,则b=6,显酸性(2分)
(2)否 若a=5,则c(H+)a=10-5mol/L b=10
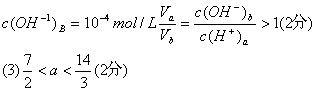
..
20.(6分,每空2分)(1)Na+[:N:]3-Na+ (2) Na3N+4HCl====-3NaCl+NH4Cl
..
Na+
(3)r(Na+)<r(N3-)
21.(5分)CH3OH+8OH-6e-=CO32-+6H2O(5分)
22.(5分)(1)2 5-n 2n 2 5-n n+3(2分) (2)2(1分) +6(1分) (3)B、C(1分)
23.(7分)(1)碳酸钾 碳酸钠 碳酸铵 碳酸镁
(2)![]() M(B)<M(A)<M(C)
M(A)<M(C)<M(B)(1分)
M(B)<M(A)<M(C)
M(A)<M(C)<M(B)(1分)
(3)2种(1分) Li2CO3 MgCO3(1分)
(4)MgCO3 BeCO3 Na2CO3 (1分) 1.46(2分)
24.(5)(1)随原子序数增大,E值变小;周期性;(2分) (2)①③(1分)
(3)419<E<738(1分) (4)氖原子最外层已达8个电子稳定结构(1分)
25.(12分)(1)1-a(1分) (2)3a(1分)
(3)2(1分) 3-3a(1分) 丁(1分)
若3a>1 n(B)<2mol (1分) 若3a=1 n(B)=2mol(1分) 若3a<1 n(B)>2mol(1分)
(4)![]()
(5)乙(1分)(5)中V不变,而(1)中V缩小,所以(5)中的压强小于(1)中的压强,有利于逆反应进行(2分)
26.(9分)(1)B(3分)
(2)137(3分)58.8g(3分) 提示:若要知道M的相对原子质量,需知道MCO3的式量,由收集到4.48L气体求出MCO3的物质的量,故知MCO3的质量即可求出。加入的NaHCO3质量由1.12LCO2和与20mL盐酸反应的量即可求出。