高 三 化 学
(第二学期第3周)
【高三年级化学第二学期第一次综合练习】
第Ⅰ卷(选择题,共83分)
一、选择题(本题包括5小题,每小题3分,共15分,每小题只有1个选项符合题意。)
1、美国科学家发现的C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家确认世界还存在着另一种“分子足球N60”,它与C60的结构相似,并且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来,对于N60,下列说法中正确的是( )
A.N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素 C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来会成为很好的火箭燃料
2、下列说法或做法正确的是( )
A.硫酸钠是制玻璃和造纸的重要原料
B.重晶石用于制媒染剂和制白色颜料
C.98%的硫酸与纤维素混合后用水浴加热制取葡萄糖
D.浓硫酸洒在皮肤上先用水冲洗,然后用稀碳酸氢钠溶液中和
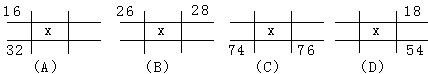 3、下列各图若为元素周期表的一部分(表中数字为原子序数),其中X为35的是( )
3、下列各图若为元素周期表的一部分(表中数字为原子序数),其中X为35的是( )
4、下列各物质气化或熔化时,所克服微粒间的作用力属同种类型的是( )
A.氯化钠和铁的熔化 B.NH4Cl分解和石油分馏
C.碘和干冰的升华 D.SiO2和CaO的熔化
5、等体积的下列溶液,阴离子的总浓度最大的是( )
A.0.2mol/L NaCl B.0.2mol/L (NH4)2SO4
C.0.2mol/L K2S D.0.1mol/L Ba(OH)2
二、选择题(本题包括12小题,每小题3分,共35分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错1个,该小题就为0分)
6、下列微粒对应的电子式正确的是( )
 |
A.氨分子(NH3):H N H B.醛基(—CHO):C H
C.碳负离子(CH3-):[H C ]- D.碘化铵:[H N H]+I-
7、下列离子方程式正确的是( )
A.将金属钠投入水中:Na + 2H2O = Na+ + 2OH- + H2↑
B.碳酸氢钙溶液中加入足量氢氧化钠溶液:
Ca2+ + HCO3- + OH- = CaCO3↓ + H2O
C.酸性硫酸亚铁溶液中加过氧化氢溶液:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
D.明矾溶液中加入足量氢氧化钡溶液Al3+ + SO42-+ Ba2+ + 4OH- =AlO2-+ BaSO4↓
8、设NA为阿伏加德罗常数,下列说法正确的是( )
A.0.1molT218O2所含中子数为2.4NA
B.500ml 0.3mol/L K2SO4溶液含0.15mol K+
C.一个氯原子的质量为ag,则该氯原子的原子量为aNA
D.标况下,11.2L SO3中含有0.5NA个SO3分子
![]() 9、某些金属卤化物可跟其卤素反应,如KI + I2
KI3,下列推断错误的是( )
9、某些金属卤化物可跟其卤素反应,如KI + I2
KI3,下列推断错误的是( )
A.I3-在溶液中存在如下平衡: I3- I2 + I-
B.配制碘水时加入KI可增大I2的溶解度
C.在KI3溶液中加入淀粉可变蓝色
D.将Cl2通入KI溶液中,I3-的浓度不会改变
10、某一元强酸(HR)稀溶液与一元碱(MOH)稀溶液等体积混合后,溶液PH=7,则下列叙述中一定正确的是( )
A.生成的盐不水解 B.混合后溶液中的[M+]=[R-]
C.酸溶液物质的量浓度小于碱溶液物质的量浓度
D.酸溶液中H+的浓度等于碱溶液中OH-的浓度
11、下列说法正确的是( )
A.同温同压下两种气体的体积之比等于摩尔质量之比
B.同温同压下两种气体的摩尔质量之比等于密度之比
C.同温同压下两种气体密度之比等于物质的量之比
D.同温同体积下两种气体的物质的量之比等于压强之比
12、化学反应前后,肯定没有变化的是( )
(1)质子数 (2)原子数 (3)分子数 (4)物质的总类 (5)物质总质量 (6)元素种类
A.(1)(2)(3)(5) B.(1)(2)(5)(6)
C.(2)(3)(4) D.(1)(4)(5)(6)
13、下列各组离子中在碱性溶液中共存,且加入盐酸过程中会产生气体和沉淀的是( )
A.Na+、NO3-、AlO2-、SO42-; B.Na+、NO3-、SiO32-、K+;
C.K+、Cl-、AlO2-、CO32-; D.Na+、Cl-、HCO3-、Ca2+;
14、用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.[H+]和[OH-]的乘积 B.溶液的PH值
C.氨水的电离度 D.[NH3·H2O]/[OH-]
15、对化合物 的下列叙述中正确的是( )
A.其分子式为C12H12 B.该化合物与苯属于同系物
C.分子中至少有8个碳在同一个平面 D.分子中所有碳原子一定在同一平面
16、下列物质的溶液加热蒸发至干,灼烧,所得固体的成分不相同的是( )
A.NaAlO2、AlCl3; B.FeCl3、FeCl2;
C.Na2CO3、NaHCO3; D.Mg(HCO3)2、Mg(NO3)2;
17、四种主族元素的离子:aXm+、bYn+、cZn-、dRm-(a、b、c、d为元素原子序数),它们具有相同的电子层结构,若m>n,下列叙述正确的是( )
A.a-b = n-m B.元素原子序数a>b>c>d
C.元素非金属性:Z>R D.最高价氧化物对应水化物的碱性X>Y
三、选择题(本小题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意。)
18、在装有活塞的闭容器中盛22.4ml NO,若通入11.2ml O2(均为标准状况),保持温度不变,则容器内气体的密度( )
A.等于1.369g/L B.等于2.054g/L
C.在 1.369g/L和2.054g/L之间 D.大于2.054g/L
19、Mg、Al合金共mg和足量的盐酸反应后,在标况下产生的H2的体积为1.12L,则m值可能为( )
A.0.85 B.0.9 C.1.05 D.1.25
20、现有PH=a和PH=b的两种NaOH溶液,已知b-a=2,将这两种溶液等体积混合后,所得溶液的PH值接近于( )
A.a-lg2 B.b-lg2 C.a + lg2 D.b + lg2
![]() 21、反应2A(气) B(气)+ xC(气)在一定温度和一定容积的容器内达到平衡时,容器内的压强增大了a%,又测得A的转化率为a %,则x的值为( )
21、反应2A(气) B(气)+ xC(气)在一定温度和一定容积的容器内达到平衡时,容器内的压强增大了a%,又测得A的转化率为a %,则x的值为( )
A.1 B.2 C.3 D.4
22、室温下,有140g某物质的溶液,第一次蒸发10g水时,溶液中析出2g溶质;第二次蒸发20g水时,溶液中析出5g溶质,则原溶液至少需要蒸发多少g水可变为饱和溶液( )
A.2g B.8g C.10g D.20g
23、已知蓄电池在放电时起原电池作用,充电时起电解池作用。铅蓄电池在放电和充
 |
电时发生的化学反应可用下式表示:Pb + PbO2 + 2H2SO4 2PbSO 4+ 2H2O据此判断下列叙述中错误的是( )
A.放电时铅蓄电池负极的电极反应式:Pb - 2e + SO42- == PbSO4
B.充电时铅蓄电池阴极的电极反应式:PbSO4 + 2e == Pb + SO42-
C.用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.05mol H2SO4
D.铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子
![]() 24、某恒温恒压下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+ 2B(气) xC(气)+ yD(气),达到平衡时,C的体积分数为m%,若维持温度,压强不变,将0.6LA、0.4LB、4LC,0.8LD作为起始物质充入密闭容器中达到平衡时,C的体积百分数仍m%,则x、y的值分别为( )
24、某恒温恒压下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:3A(气)+ 2B(气) xC(气)+ yD(气),达到平衡时,C的体积分数为m%,若维持温度,压强不变,将0.6LA、0.4LB、4LC,0.8LD作为起始物质充入密闭容器中达到平衡时,C的体积百分数仍m%,则x、y的值分别为( )
A.x=3,y=1 B.x=4,y=1 C.x=5,y=1 D.x=3,y=3
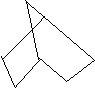 25、降冰片烷立体结构如图所示,按键线式(以线示键,每个折
25、降冰片烷立体结构如图所示,按键线式(以线示键,每个折
点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来)
当它发生二氯取代时,取代位置有几种?
A.8 B.9
C.10 D.11
第Ⅱ卷(选择题,共67分)
四、(本题包括2小题,共13分)
26、(4分)在下列实验操作中:a、加热时试管盛液体不超过![]() ;b、制溴苯的圆底烧瓶上安装一段长玻璃导管;c、酒精灯内酒精不超过
;b、制溴苯的圆底烧瓶上安装一段长玻璃导管;c、酒精灯内酒精不超过![]() 体积;d、制乙烯的烧瓶里放入碎瓷片;e、稀释浓H2SO4时,应慢慢把浓H2SO4倒入水中;f、在蒸发皿里蒸发某溶液时要用玻璃棒不断搅拌;g、制酚醛树脂时要用水浴加热,其中为了保证不使液体喷出或溅出的有_________________________.
体积;d、制乙烯的烧瓶里放入碎瓷片;e、稀释浓H2SO4时,应慢慢把浓H2SO4倒入水中;f、在蒸发皿里蒸发某溶液时要用玻璃棒不断搅拌;g、制酚醛树脂时要用水浴加热,其中为了保证不使液体喷出或溅出的有_________________________.
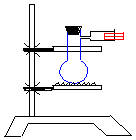 27、(9分)如图(尚有部分仪器未画),有一蒸馏烧瓶
27、(9分)如图(尚有部分仪器未画),有一蒸馏烧瓶
与注射器相连接,向蒸馏烧瓶中先加入0.384 g铜片和 18ml
2.5mol/L的稀HNO3溶液,立即用锡铂包住的橡皮塞封住烧瓶
口,实验装置内的空气在标准状况下为500ml(其中注射器内
不少于其体积的![]() ,见图示)
,见图示)
(1)欲提高Cu和HNO3反应的速率可采用多种不同措施,下列措施合理的是_______________.
A.加蒸馏水 B.加无水醋酸钠 C.加块状石墨 D.加热升温
(2)当烧瓶中的Cu和HNO3反应开始后,可观察到的现象有________________。
(3)待Cu与HNO3反应停止后,通过轻轻推拉注射器活塞,使装置内气体与气体、气体与液体之间充分反应,若忽略液体体积变化,最后溶液中NO3-的物质的量浓度与开始相比是否有变化___________________?(填“有”或“没有”)
(4)在上述反应中,曾经被还原的硝酸为________________mol。
五、(本题包括3小题,共20分)
28、(4分)PtCl2(NO3)2为平面正方形结构,它可以形成两种固体,一种为淡黄色,在水中溶解度小;另一种为黄绿色,在水中溶解度大,请画出这两种固体分子几何图形。
(1)淡黄色固体____________________________
(2)黄绿色固体____________________________
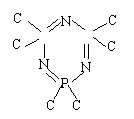
29、(6分)在有机溶剂里若m mol五氯化磷跟m mol氯化铵定量地发生完全反应,生成4m mol氯化氢,同是得到一种白色固体R。R的熔点为113℃,在减压下50℃
即可升华,在1×104Pa下测得R的蒸气密度换算成标准状况下则为15.54g/l,请回答:
(1)通过计算推导R的化学式______________________
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R的分子中化合价相同,试写出R的分子结构式____________________
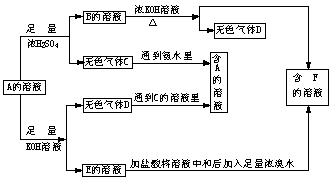 |
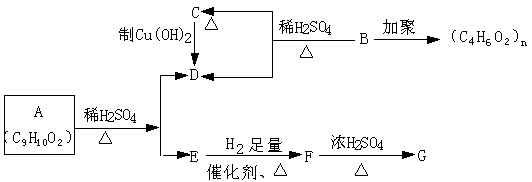
30、(10分)从某物质A的水溶液出发有下列图示的一系变化。
试回答:(1)物质的化学式:A____________B____________C__________
D____________E_____________F__________
(2)写出E→F的离子方程式:_____________________________
(3)鉴定物质F的方法____________________________________
六、(本题包括3小题,共20分)
31、(6分)A、B两种烃的分式均为C6H10,它们的分子中均无支链或侧链,
(1)A为环状结构,能跟溴发生加成反应,A的结构简式为__________,若将A中的一个碳原子换成氮原子,得到另一种稳定的有机化合物,其式量为__________
(2)B分子为链状,分子中不存在 C = C = C 基团,它跟溴的1:1加成产物有两种,
则B的结构简式可能是_____________;___________
32、(7分)已知苯的同系物可被氧气氧化,如:
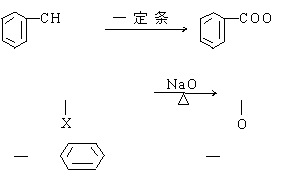 |
2 + 3O2 2 + 2H2O,卤代烃在强碱的水
溶液中可水解,如RCH—CH3 + H2O RCH—CH3 + HX,又知涤纶树脂的
结构简式为:[ OC— —COOCH2CH2O ]n
(1)写出合成涤纶树脂所需的单体的结构简式___________________________
(2)写出以对二甲苯、乙烯、食盐、空气和水等为原料合成涤纶树脂的各步反应化学方程式:(须配平)__________________________________________________
 33、(7分)通常羟基与烯键碳原子相连接时,易发生下列转化:
33、(7分)通常羟基与烯键碳原子相连接时,易发生下列转化:
![]() —C=C—OH —C—C=O ,现有如下图所示的转化关系。已知E与FeCl3溶液能
—C=C—OH —C—C=O ,现有如下图所示的转化关系。已知E与FeCl3溶液能
发生显色反应,F转化为G时,产物只有一种结构且能使溴水褪色。请回答下列问题:
(1)结构简式:A______________________B________________E________________
(2)化学方程式:C→D:_______________________________
F→G:________________________________
七、(本题包括2小题,共14分)
34、(6分)有氢氧化钡和氢氧化钠的固体混合物若干克,溶于水配成200ml溶液,测得溶液的PH值为14。向混合液中加入碳酸氢钠若干克,经充分反应后,将沉淀过滤、洗涤干燥后,称得沉淀质量为15.76克,向滤液中加入稀H2SO4,无沉淀生成,也无气体放出,
求:(1)原混合物中Ba(OH)2及NaOH各多少克?
(2)加入碳酸氢钠多少克?
35、(8分)在已平衡的托盘天平左右托盘上各放一等质量的烧杯,并分别往烧杯中注入5mol/L盐酸60ml,向左盘烧杯中放入a克CaCO3粉末,往右盘烧杯中放入x克A物质粉末,充分反应后天平仍保持平衡。
(1)若A为NaHCO3
①当a≤15时, x的值为__________(用含a的代数式,表示以下同)。
②当18.6≥a>15时,x的值为______________。
③当a>18.6时,x的值为_____________。
(2)若A为KHCO3,且两只烧杯中均没有固态物质存在,则x的取值必须满足的条件是__________________。
【第二学期高三年级第一次综合练习化学答案】
一、二、三题
1、D 2、A 3、D 4、C 5、C 6、C 7、C 8、A C
9、D 10、B 11、B D 12、B 13、C 14、B D 15、C 16、A
17、B C 18、D 19、C 20、B 21、C 22、A 23、D 24、C
25、C 26、a d e f
27、(1) C D (2)溶液变蓝色,有无色气泡产生,且转化为红棕色气体,活塞外移
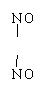 (3)没有 (4)0.004
(3)没有 (4)0.004
28、 (1) ![]() (2)
(2)
Cl—Pt—Cl O3N—Pt—Cl
 |
29、(1)N3P3Cl6 (2) P P
30、(1)NH4HSO3或(NH4)2SO3、 NH4HSO4、SO2
NH3、K2SO3、KSO4
(2)SO32-+ Br2 + H2O = SO42-+ 2Br- + 2H+
(3)①焰色反应 ②加盐酸酸化,再加BaCl2溶液
31、(1) ,83 (2)CH2=CH—CH2—CH=CH—CH3或CH3—CH=CH—CH=CH—CH3
 |
32、(1)HOOC— —COOH和 CH2—OH
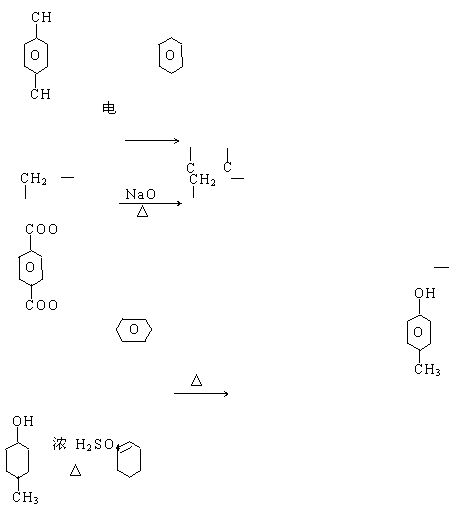
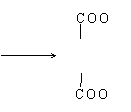
(2) + 3O + 2H2O
2NaCl + 2H2O === 2NaOH +Cl2↑+ H2↑
Cl2 + CH2 == CH2 CH2—CH2
CH2—Cl + 2H2O CH2—OH + 2HCl
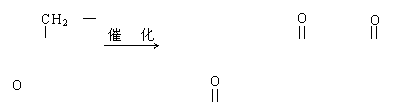 |
![]()
![]() n + nCH2—OH [O—CH2—CH2—O—C— —C ]n +2nH2O
n + nCH2—OH [O—CH2—CH2—O—C— —C ]n +2nH2O
33、(1)CH3—C—O— —CH3、 CH3—C—O—CH=CH2、
(2)CH3CHO + 2Cu(OH)2 CH3COOH +Cu2O↓+ 2H2O
![]() + H2O
+ H2O
34、Ba(OH)2:13.68g NaOH: 1.6g NaHCO3: 6.72g
35、(1)①1.176a ②2.1a-13.86 ③x=a+6.6
(2)x=a≤15