高三上学期化学期中考试
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl 35.5 Ba 137
第I卷(选择题 共40分)
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列物质一定不是天然高分子化合物的是( )
(A)淀粉 (B)纤维素 (C)酚醛树脂 (D)蛋白质
2.为了减少汽车尾气对大气的污染,世界各国都在研究以新燃料作为能源的“绿色汽车”。下列选项中不能作为“绿色汽车”燃料的是( )
(A)氢气 (B)甲醇 (C)含铅汽油 (D)天然气
3.常温常压下,下列各组混合物中,不可以用分液漏斗分离的是( )
(A)乙酸乙酯和饱和碳酸钠溶液 (B)氯仿和水
(C)甘油和水 (D)已烷和水
4.在一定条件下,将一定量氮气和氢气放入5L密闭容器中进行反应,N2+2H2![]() 2NH3;半分钟后,氨气的物质的量增加了0.06mol,则此反应平均速度
2NH3;半分钟后,氨气的物质的量增加了0.06mol,则此反应平均速度![]() (X)表述正确的是( )
(X)表述正确的是( )
(A)v(N2)=0.0002mol·(L·s)-1 (B)v(H2)=0.018mol·(L·s)-1
(C)v(NH3)=0.004mol·(L·s)-1 (D)v(N2)=0.006mol·(L·s)-1
5.下列叙述不属于蛋白质变性的是( )
(A)动物的皮经过药剂鞣制后,变成柔软坚韧的皮革
(B)打针时用医用酒精消毒
(C)蛋白质溶液加入食盐变浑浊
(D)用福尔马林溶液浸泡变浑浊
6.相同温度下,相同物质的量浓度的下列溶液中,pH由小到大顺序排列的是( )
(A)Na2SO4 NaHSO4 Na2CO3 NaHCO3
(B)Na2CO3 NaHCO3 Na2SO4 NaHSO4
(C)NaHSO4 NaHCO3 Na2SO4 Na2CO3
(D)NaHSO4 Na2SO4 NaHCO3 Na2CO3
7.“绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放。下列反应类型一定符合这一要求的是( )
①取代反应 ②加成反应 ③消去反应 ④水解反应 ⑤加聚反应 ⑥缩聚反应 ⑦酯化反应
(A)② (B)② ⑦ (C)① ⑥ (D)② ⑤
8.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池,某种锂电池的总反应为Li+MnO2=LiMnO2,下列说法正确的是( )
(A)Li是正极,电极反应为Li-e=Li+
(B)Li是负极,电极反应为Li-e=Li+
(C)Li是负极,电极反应为MnO2+e=MnO2-
(D)Li是负极,电极反应为Li-2e=Li2+
9.下列实验中能发生银镜反应的是( )
(A)在盛有少量淀粉的试管中加入适量的20%稀硫酸,加热3~4分钟后,再加入1mL新制银氨溶液,然后放在水浴中加热
(B)在盛有少许棉花的试管中加入适量的70%浓硫酸,水浴加热15分钟后,冷却到室温,再加入适量新制银氨溶液,继续放在水浴中加热
(C)向2mL新制银氨溶液中,加入适量葡萄糖溶液,放在水浴中加热
(D)向2mL新制银氨溶液中,加入适量蔗糖溶液,放在水浴中加热
10.一种矿泉水标签上印有主要矿物成分(单位:mg·L-1):Ca:60.00、K:39.00、Mg:3.10、Zn:0.08、F:0.02等,则对此泉水的叙述正确的是( )
①该矿泉水不导电 ②该矿泉水导电 ③该矿泉水电解质 ④该矿泉水是软水 ⑤该矿泉水是硬水
(A)② ③ (B)② ⑤ (C)① ③ ⑤ (D)② ③ ⑤
11.下列各图中的大黑点代表原子序数从1~18元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )

12.下列有关胶体的说法中正确的是( )
(A)胶体都是均匀透明的液体
(B)丁达尔现象可以鉴别胶体和溶液
(C)电泳现象能证明胶体微粒比溶液中溶质微粒直径大
(D)纳米材料的微粒直径一般从几纳米几十纳米(1nm=10-9m),因此纳米材料是胶体
13.下图中表示某反应在一段时间内,当其他条件不变时,改变某一反应条件对反应物转化率的影响。由t1→t2为升高温度,由t2→t3为增加压强,符合此图像的反应是( )
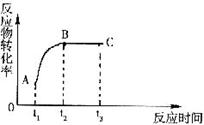 (A)N2(气)+3H2(气)
(A)N2(气)+3H2(气)![]() 2NH3(气)+Q
2NH3(气)+Q
(B)N2O3(气)![]() NO2(气)+NO(气)-Q
NO2(气)+NO(气)-Q
(C)ClF(气)+F2(气)![]() ClF3(气)+Q
ClF3(气)+Q
(D)N2(气)+O2(气)![]() 2NO(气)-Q
2NO(气)-Q
14.一定条件下,由乙炔和乙醛组成的混合气体中,经测定碳元素的质量分数为72%,则混合气体中氧元素的质量分数为( )
(A)32.00% (B)19.56% (C)22.65% (D)2.14%
15.在一定条件下,向密闭容器中按5:4的体积比充入一氧化碳和水蒸气进行反应,当CO(气)+H2O(气)![]() CO2(气)+H2(气)达到平衡时,水蒸气与氢气的体积分数相等,则下列叙述中错误的是( )
CO2(气)+H2(气)达到平衡时,水蒸气与氢气的体积分数相等,则下列叙述中错误的是( )
(A)平衡时一氧化碳的体积分数为33.3%
(B)平衡时水的转化率为50%
(C)平衡时一氧化碳的转化率为45%
(D)平衡时混合气体的平均相对分子质量约为23.6
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题共0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给2分,但只要选错一个,该小题就为0分)
16.下列离子方程式书写正确的是( )
(A)向硫代硫酸钠溶液中加入适量稀硫酸:S2O32-+2H+=SO2+S↓+H2O
(B)碳酸钙与盐酸混合:HCO32-+HCOOH=HCOO-+CO2↑+H2O
(C)小苏打溶液与甲酸混合:HCO3-+HCOOH=HCOO-+CO2↑+H2O
(D)氯气通入氯化亚铁溶液:Fe2++Cl2=Fe3++2Cl-
17.0.1mol·L-1NH4HSO4溶液与0.1mol·L-1NaOH溶液等体积混合,混合后溶液中离子浓度关系表述正确的是( )
(A)c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
(B)c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
(C)c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-)
(D)c(Na+)=c(SO42-)=c(NH4+)>c(H+)>c(OH-)
18.以NA表示阿伏加德罗常数,下列说法中正确的是( )
(A)1.8gNH4+离子中含有的电子数为NA
(B)常温常压下,1mol甲基(-CH3)所含电子数为10NA
(C)28g乙烯含6NA对共用电子对
(D)1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA
19.若常温下某溶液由水电离产生c(H+)=1×10-13mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
(A)K+ NH4+ Cl- NO3- (B) K+ Na+ Cl- SO42-
(C)Na+ Al3+ Cl- NO3- (D) K+ Na+ Cl- CO32-
20.一定条件下,AL密闭容器中放入1molN2和3molH2发生N2+2H2![]() 2NH3的反应,下列选项中能说明反应已达到平衡状态的是( )
2NH3的反应,下列选项中能说明反应已达到平衡状态的是( )
(A)c(N2): c(H2) : c(NH3)=1:3:2
(B)3v(H2)=v(N2)
(C)单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
(D)单位时间消耗0.1molN2的同时,生成0.2mol NH3
第II卷(非选择题 共60分)
三、(本题包括2小题,共14分)
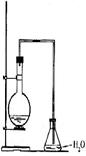 21.(7分)某同学设计如右图装置制取少量溴苯,请回答下列问题:
21.(7分)某同学设计如右图装置制取少量溴苯,请回答下列问题:
(1)写出实验室制取溴苯的化学方程式: 。
(2)上述反应发生后,在锥形瓶中加入硝酸银溶液观察到的现象是 ,这一现象能否说明溴和苯发生了取代反应(填“能”或“不能”) ,理由是
。
(3)反应后得到的溴苯中溶有少量苯、溴、三溴苯、溴化铁和溴化氢等杂质,欲除去上述杂质,得到无水溴苯的合理实验操作步骤可设计为(分液操作已略去):①水洗 ②碱洗 ③水洗 ④ ⑤ 。
(4)上述操作 ②碱洗的主要目的是(填序号) 。
(A)除三溴苯和溴化氢 (B)除溴化铁和三溴苯
(C)除溴和溴化氢 (D)除苯和溴
22.(7分)拟用下图装置和表中所列试剂进行实验并得出实验结论 (图中铁架台、铁夹、加热装置等已略去;必要时可以加热;A、B、C表示相应仪器中加入的试剂)。
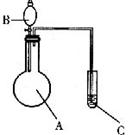
| 序号 | A | B | C | C中现象 | 实验结论 |
| ① | 碳酸钠 | 醋酸溶液 | 苯酚钠溶液 | 溶液变浑浊 | 酸性:醋酸>碳酸>苯酚 |
| ② | 无水乙醇 | 浓硫酸 | 溴水 | 溴水褪色 | 证明乙烯有碳碳不饱和键可与溴发生加成反应 |
请回答下列问题:
(1)上述实验和结论一定正确的是(填序号) 。
(2)如果你为上述实验和结论有不合理的,请写出序号并说明理由:
(3)请你用上述装置设计一个实验,选择试剂、简述C中的现象并根据实验现象得出实验结论:
所选试剂:A: B: C: ;
C中的现象: ;
实验结论: 。
四、(本题包括3小题,共20分)
23.(5分)(1)在25℃条件下将Ph=3的醋酸溶液稀释100倍,稀释后溶液的pH为(填序号) 。
(A)3 (B)5 (C)2~3之间 (D)3~5之间
(2)25℃时,向0.1mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH增大,主要原因是(填序号)
(A)醋酸与醋酸钠发生化学反应
(B)醋酸钠溶液水解显碱性,增加了c(OH-)
(C)醋酸钠溶于水,电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小
(3)室温下,如果将0.1molCH3COONa和0.05 mol HCl全部溶于水,形成1L混合溶液(假设无损失),请写出溶液中存在平衡的电离方程式和离子方程式 。
24.(7分)在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) 浓度(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | C1 | 0.10 | C3 | A | B |
| c(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:
(1)该反应的化学方程式为 ;达到平衡时四氧化二氮的转化率为 %,表中C2 C3 A (填“<”、“>”)
(2)20s时,四氧化二氮的浓度C1= mol·L-1,在s~20s内四氧化二氮的平均反应速率为 。
(3)若在相同情况下是初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
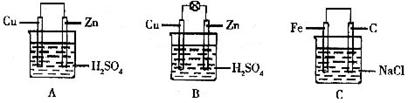
25.(8分)(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见下图A),组成一个原电池,负极为 ,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol·L-1 500mL的稀硫酸溶液,构成铜锌原电池(见下图B,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度应为(溶液体积变化忽略不计)
。
(3)如果电极材料分别是铁片和石黑并进行连接,插入氯化钠溶液中(见下图C),放置数天后,主要发生 电化学腐蚀,写出正极的电极反应式
。
(4)生活中利用原池原理生产了各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是 。
(A)回收利用电池外壳的金属
(B)防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
(C)防止电池中渗泄的电解液腐蚀其他物品
(D)回收其中的石墨电极
五、(本题包括2小题,共17分)
26.(9分)已知卤代烃R-Cl在一定的条件下可以发生如下反应:
|
R-C+H2O——→R-OH+HCl
|
|
|
|
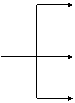 A——→D————→E
A——→D————→E
|
|
CH2=CH2 ——→B————→F
|
(1)若乙为氯化氢,则G的结构简式为 ;
若乙为氯气,则G的结构简式可能为
。
(2)请填写①②③的反应类型(填序号)
① ② ③ ;
(A)取代反应 (B)加成反应 (C)氧化反应 (D)还原反应 (E)加聚反应 (F)缩聚反应 (G)消去反应
D→E: ;
CH2=CH2→C: ;
27.(8分)水杨酸是合成阿斯匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为
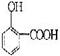 请回答下列问题:
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团 ;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:
![]() ;
;
(3)水杨酸的另一种同分异构体的结构简式为, 1mol该有机物在适宜条件下与
氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号) ;
![]() (A)1mol (B)
2mol
(C) 3mol (D) 4mol
(A)1mol (B)
2mol
(C) 3mol (D) 4mol
(4)已知有机物CH3COOH可以表示,在一定条件下,水杨酸与乙酸酐可合成
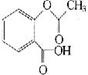
阿斯匹林,阿斯匹林可表示为: 则阿斯匹林的分子式为 ;
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可) 。
六、(本题包括2小题,共9分)
 28.(4分)某a一氨基酸相对分子质量不超过200,已知该氨基酸含C、H、O、N四种元素,其中氮元素的质量分数约为9.27%,氧元素的质量分数约为21.19%,其分子结构中含苯环。该氨基酸的结构简式为
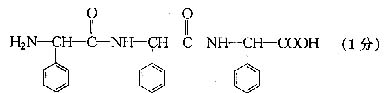
;如果由该氨基酸相互结合形成三肽,其相对分子质量约为
,其结构简式为
。
28.(4分)某a一氨基酸相对分子质量不超过200,已知该氨基酸含C、H、O、N四种元素,其中氮元素的质量分数约为9.27%,氧元素的质量分数约为21.19%,其分子结构中含苯环。该氨基酸的结构简式为
;如果由该氨基酸相互结合形成三肽,其相对分子质量约为
,其结构简式为
。
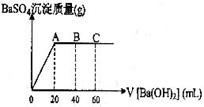
29.(5分)在t℃时,稀硫酸和盐酸混合液中,c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入Ph=11Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
(1)最初混合酸溶液中c(H2SO4)= ,c(HCl)= ;
(2)A点pH= ;
(3)B点比最初混合酸的pH增加多少(写出计算过程)?(lg3=0.48)
上学期高三化学期中考试答案
一、二选择题答案(共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | C | C | A | C | D | D | B | C | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | B | D | B | C | AC | A | AC | B | C |
三、(本题包括2小题,共14分)
21.(每空1分,共14分)
![]()
(1)
(2)浅黄色沉淀 否 有溴进入锥形瓶,溴与硝酸银溶液也可发生反应,生成溴化银沉淀。
(3)④干燥 ⑤蒸馏 (4)(C)
22.(共7分)
(1)①(1分)
(2)②不合理(1分),利用该装置产生的气体,能使溴水褪色不一定是乙烯(1分)。
(3)方案合理均给分(共4分)
例如:A:亚硫酸钠 B:硫酸 C:品红溶液(选错一种试剂扣1分,共2分)
品红溶液褪色(1分);二氧化硫气体具有漂白性(1分)
四、(本题包括3小题,共20分)
23.(共5分)
(1)D(1分) (2)C (1分)
(3)H2O![]() H++OH- CH3COOH
H++OH- CH3COOH![]() H++CH3COO-
H++CH3COO-
CH2COO-+H2O![]() CH3COOH+OH-(3分)
CH3COOH+OH-(3分)
24.(每空1分,共7分)
(1)N2O4![]() 2NO2 55%> =
2NO2 55%> =
(2)0.14 3.00×10-3 mol·(L·s)-1(不写单位不给分)
(3)0.40
25.(共8分)
(1)没有 锌片 2H++2e=H2↑(每空1分)
(2)c(H2SO4)=1 mol·L-1(1分) c(ZnSO4)=1 mol·L-1(1分)
(3)吸氧 2H2O+O2+4e= 4OH-(每空1分)
(4)B (1分)
五、(本题包括2小题,共17分)
26.(共9分)
(1)CH3COOCH2CH3 (1分) CH3COOCH2CH2OH (1分)
CH3COOCH2CH2OOCCH3 (1分)
(2)①(B) ②(E) ③(A)(每空1分)
|
(3)CH3CHO+2Cu(OH)2——→CH3COOH+Cu2O↓+2H2O (每空1分)
|
![]()
![]() nCH2=====CH2——————→[ CH2-CH2 ]n
nCH2=====CH2——————→[ CH2-CH2 ]n
|
CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
(每空1分)
CH3COOCH2CH3+H2O
(每空1分)
27.(共8分)
(1)羟基(酚羟基)、羧基(2分)
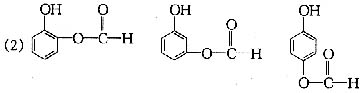
(3)C(1分) (4)C9H8O4 (1分)
(5)三氯化铁溶液或浓溴水(1分)
六、(本题包括2小题,共9分)
28.(4分)
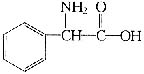
(2分)417(1分)
29.(5分)
(1)c(H2SO4)=0.05mol·L-1,c(HCl)=0.20mol·L-1 (2分)
(2)pH=1 (1分)
(3)最初混合酸c(H+)=0.05mol·L-1×2+0.20mol·L-1=0.30mol·L-1
pH=0.52 (1分)
B点还没有完全中和,酸有剩余
c(H+)=![]()
=![]() mol·L-1 pH=1.48
mol·L-1 pH=1.48
所以B点比最初混合酸的pH增加1.48-0.52=0.96 (1分)