高三化学提高测试4
一、选择题
1.电解1 mol·L-1的硝酸银溶液,设电解时无水分蒸发,工作一段时间,在剩余溶液中加入下列物质使其恢复到原溶液的浓度的是( )
(A)Ag (B) Ag2O (C) Ag2CO3 (D) AgNO3
2.将铂电极插入100 g 20% CuSO4溶液中进行电解,其中一电极增重1.6 g,另一极产生的物质和质量是( )
(A)1.6g Cu (B) 1.6g O2 (C) 0.4g O2 (D) 0.05 g H2
3.右图X、Y分别是直流电源的两极,通电后发现a极
板质量增加,b极板处有无色无嗅气体放出,符合这
一情况的是( )
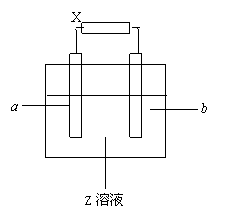 a极 b极 X极 Z溶液
a极 b极 X极 Z溶液
(A) 锌 石墨 负极 CuSO4
(B) 石墨 石墨 负极 NaOH
(C) 银 铁 正极 AgNO3
(D) 铜 石墨 负极 CuCl2
4.下列试验中,会导致液体的pH升高的是( )
(A) 用惰性电极电解CuSO4溶液
(B) 镁片和铜片用导线连接后,插入氯化铵溶液中
(C) 加热硫酸氢钠溶液
(D) 加热液氨
5.某电解质溶液的pH=a,向其中插入两惰性电极,通电一段时间后,测知溶液的pH=b。若b≤a,该电解质可能是( )
(A)Na2S (B)CuSO4 (C)NaCl (D)Na2SO4
6.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
(A)CuCl2 〔CuSO4〕 (B)NaOH 〔NaOH〕
(C)NaCl 〔HCl〕 (D)CuSO4 〔Cu (OH)2〕
7.有X、Y、Z、M四种金属,已知:X可以从Y的盐溶液中置换出Y;X和Z 作原电池电极时,Z为正极;Y和Z的离子共存与电解液中,Y离子先放电;M的离子氧化性强于Y的离子。则这四种金属的活动性由强到弱的顺序是( )
(A)X>Y>Z>M (B)X>Y>M>Y
(C)M>Z>X>Y (D)X>Z>Y>M
8.用石墨电极电解AgNO3溶液,在阳极上收集到0.40 g氧气,中和电解时生成的酸需要250 mL氢氧化钠溶液,则氢氧化钠溶液的物质的量浓度是( )
(A)0.05 mol·L-1 (B)0.10 mol·L-1 (C)0.15 mol·L-1 (D)0.20 mol·L-1
9.烧杯中盛放浓度均为0.10 mol·L-1的氯化钠和硝酸铜的混合液。现将该溶液以惰性电极进行电解,当Cu2+全部在阴极上转变为金属铜时,整个溶液(摇均)的pH为( )
(A)7.00 (B)1.00 (C)0.70 (D)1.30
10.用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的原子量为( )
(A)22.4 ax / b (B)11.2 ax / b (C)5.6 ax / b (D)2.5 ax / b
11.在蒸馏水中,加入等物质的量的Ag+、Pb2+、Na+、NO![]() 、SO
、SO![]() 、Cl-,在用惰性电极电解该溶液,并收集两极电解产物,则所得到的氧化产物与还原产物的质量之比最接近于( )
、Cl-,在用惰性电极电解该溶液,并收集两极电解产物,则所得到的氧化产物与还原产物的质量之比最接近于( )
(A)16∶207 (B)35.5∶108 (C)8∶1 (D)71∶106
12.1 L K2SO4、CuSO4的混合溶液中c(SO![]() )=1 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到标准状况下22.4 L气体,则原溶液中c(K+)为(
)
)=1 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到标准状况下22.4 L气体,则原溶液中c(K+)为(
)
(A)0.5 mol·L-1 (B)1 mol·L-1 (C)1.5 mol·L-1 (D)2 mol·L-1
 13.目前人们正在开发一种高能电池。它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应的化学方程式如下:
13.目前人们正在开发一种高能电池。它是以熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应的化学方程式如下:
,以下说法正确的是( )
(A)放电时钠作为正极,硫作为负极
(B)放电时钠极发生还原反应
(C)充电时,钠与电源的正极相接
(D)充电时,阳极的反应是SO![]() -2xe- = xS
-2xe- = xS
14.用惰性电极电解饱和食盐水,当电源供给0.2 mol电子时,停止通电。若此溶液体积为2L,则所得电解液的pH是( )
(A)1 (B)8 (C)13 (D)14
15.以Pt作电极,用电源串联电解分装在两个烧杯里的200 mL 0.3 mol·L-1 NaCl溶液和300 mL 0.1 mol·L-1的AgNO3溶液,过一段时间去除电极,将两杯溶液混合,则对混合溶液的pH判断正确的是( )
(A)小于7 (B)大于7 (C)等于7 (D)大于或等于7
二、填空题
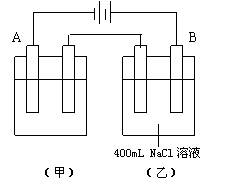 16.如图所示为相互串连的甲、乙两电解池,试回答:
16.如图所示为相互串连的甲、乙两电解池,试回答:
⑴甲池若为用电解原理精炼铜的装置,
A是 极,是 材料,电极反应是 ,
B是 极,是 材料,电极反应是 ,
电解质溶液为 。
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,
Fe极附近呈 色。
⑶若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准
状况下的体积为 。
⑷若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 ,pH为 。
17.工业上为了处理含有Cr2O![]() 的酸性工业废水,采用如下处理方法:往工业废水中加入适量食盐(NaCl),以铁为电极通直流电进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3生成,废水可达排放标准。简要回答下列问题:
的酸性工业废水,采用如下处理方法:往工业废水中加入适量食盐(NaCl),以铁为电极通直流电进行电解,经过一段时间后,有Cr(OH)3和Fe(OH)3生成,废水可达排放标准。简要回答下列问题:
⑴阳极和阴极发生的电极反应。
阳极: 。
阴极: 。
⑵把Cr2O![]() 变成为Cr3+的离子方程式,以及生成Cr(OH)3、Fe(OH)3等难溶化合物的原因是
。
变成为Cr3+的离子方程式,以及生成Cr(OH)3、Fe(OH)3等难溶化合物的原因是
。
⑶为什么不能用石墨电极代替铁电极达到电解除铬的目的是 。
18.采用惰性电极从NO![]() 、SO
、SO![]() 、H+、Cu2+、Ba2+、Ag+、Cl-中选出适当离子组成易溶于水的电解质,对其溶液进行电解。⑴两极分别放出H2和O2,电解质化学式是 ;
、H+、Cu2+、Ba2+、Ag+、Cl-中选出适当离子组成易溶于水的电解质,对其溶液进行电解。⑴两极分别放出H2和O2,电解质化学式是 ;
⑵阴极析出金属,阳极放出O2,电解质化学式是 ;⑶两极分别放出气体,且体积比为1∶1,电解质化学式是 。
19.在20 ℃时食盐的溶解度为36 g,取一定量该温度下的饱和溶液用惰性电极进行电解,当阳极析出11.2 L气体(标准状况)时,食盐完全电解,所得溶液密度为1.20 g·mL-1;试计算:
⑴电解时,所取饱和食盐水的质量是 g;
⑵电解后溶液中NaOH的物质的量浓度为 mol·L-1;
⑶要使溶液恢复原状态,需加入 g 物质。
20.用电极电解500 mL含KNO3和Cu(NO3)2的混合液一段时间后,在两极均生成
11.2 L(标准状况)气体,则原混合液中Cu2+的物质的量浓度为 。
21.用A、B两根石墨棒为电极电解AgNO3溶液,通电t分钟后,在B极收集到气体
11.2 mL(标准状况),然后,反接电源以相同的电流强度通电![]() 分钟,两极的质量变化情况是:A极: ,B极: ,若溶液的体积为200 mL(设电解前后溶液体积不变),则溶液的pH变为 。
分钟,两极的质量变化情况是:A极: ,B极: ,若溶液的体积为200 mL(设电解前后溶液体积不变),则溶液的pH变为 。
22.电解工业废水中的CN-(氰根)离子毒性极大,CN-对应的酸是HCN,它属于挥发性极弱酸,剧毒。处理含氰废水可用NaClO将CN-氧化成CNO-,若再度氧化可使CNO-氧化成无毒的CO2和N2。用电解法处理这种废水时,用石墨为阳极,铁为阴极,废水中加入一些食盐为电解液。
⑴电解时,在 极(阴或阳)将CN-氧化。
⑵废水必须调成碱性,如果废水为酸性,将产生的严重后果是 。
⑶设废水中有NaCN,电解时产生的物质有NaOH、Cl2、H2,试从这些物质中选出必要的物质,写出生成NaCNO的离子方程式 。
23.铁作阳极,石墨作阴极,电解氢氧化钠溶液,电极反应式分别为:阳极: 。
阴极: 。溶液的变化是 。若电解质溶液与空气接触,则观察到的现象是 。当放出2.24 L气体(标况)时,欲使溶液恢复到原有组成应加入 ,其质量为 g。
24.已知NaCl在60 ℃时的溶解度37.1 g。现电解1 371 g 60 ℃的经净化的饱和食盐水,电解后溶液的密度是1.37 g/cm3,经分析,溶液中还含有NaCl 20 g。则:
⑴ 电解后,NaOH在溶液中的物质的量浓度 。
⑵ 电解过程中,得到标准状况H2的体积 。
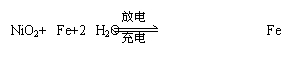 25.蓄电池是一种可以反复充电、放电的装置,有一种.蓄电池在充电和放电时发生的反应是
25.蓄电池是一种可以反复充电、放电的装置,有一种.蓄电池在充电和放电时发生的反应是
用该蓄电池进行电解M(NO3)x溶液时:
⑴电解池的阳极(惰性)应连接 。(填序号)
(A)NiO2 (B)Fe (C)Fe (OH)2 (D)Ni (OH)2
若此蓄电池工作一段时间后消耗0.36克水,
⑵电解M(NO3)x溶液时某一极增重m g,金属M的相对原子质量的计算式为:
。(用m、x表示)
⑶ 此蓄电池电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,阳极产生的气体
L(标准状况),电解后溶液加水稀释至1 L,则溶液的pH为: 。
参考答案
一、选择题
1.B.C 2.C 3.A 4.B 5.B.D 6.C 7.D 8.D
9.B 10.C 11. C 12.D 13.D 14.C 15.D
二、填空题
16.⑴A为阴极,精铜,Cu2+ + 2e- = Cu,B为阳极,粗铜,Cu - 2e- = Cu2+,电解液为CuSO4或CuCl2 ⑵红 ⑶4.48 L ⑷1 mol·L-1
17.⑴Fe-2e= Fe2+;2H++2e=H2⑵Cr2O![]() 在H+存在的条件下,Fe2+氧化成Fe3+ ,Cr2O
在H+存在的条件下,Fe2+氧化成Fe3+ ,Cr2O![]() 自身还原成为Cr3+;Cr2O
自身还原成为Cr3+;Cr2O![]() +6 Fe2++14 H+=2 Cr3++6 Fe3++7
H2O;当废水通电后有酸性逐渐变为碱性,与产生的Fe3+、Cr3+生成Fe (OH)3、Cr (OH)3难溶物,Fe3++3OH-= Fe (OH)3↓, Cr3++3OH -= Cr(OH)3↓。⑶用石墨电极代替铁电极,不会产生还原性的Fe2+,无法将Cr2O
+6 Fe2++14 H+=2 Cr3++6 Fe3++7
H2O;当废水通电后有酸性逐渐变为碱性,与产生的Fe3+、Cr3+生成Fe (OH)3、Cr (OH)3难溶物,Fe3++3OH-= Fe (OH)3↓, Cr3++3OH -= Cr(OH)3↓。⑶用石墨电极代替铁电极,不会产生还原性的Fe2+,无法将Cr2O![]() 还原成为Cr3+,从而使Cr3+以Cr (OH)3沉淀的形式除去
还原成为Cr3+,从而使Cr3+以Cr (OH)3沉淀的形式除去
18.⑴HNO3、H2SO4、Ba(NO3)2⑵Cu(NO3)2、Ag NO3、Cu SO4⑶HCl、BaCl2
19.⑴221 ⑵6.5 ⑶36.5;HCl气体
20.1 mol·L-1
21.减少0.108 g,增加0.108 g,2
22.⑴阳 ⑵将逸出剧毒的HCN ⑶2OH- + Cl2 + CN- = CNO- + 2Cl- + H2O
23.Fe-2e-=Fe2+;2H++2e-=H2;增大;白色沉淀迅速变为灰绿色最终变为红褐色;H2O;4.5 g。
24.⑴7.14 mol/L ⑵ 67.2 L
25.⑴A ⑵ 50 mx ⑶0.168;2