高三化学提高测试5
一、 选择题
1.现有1 L含SO3为30%的发烟硫酸(密度为1.95 g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约为 ( )
A.120 mL B.180 mL C.240 mL D.300 mL
2.将溶质质量分数分别为5x%的H2SO4溶液与x%的H2SO4溶液等体积混合,其溶质质量分数与3x%相比 ( )
A.小于 B.大于 C.等于 D.无法确定
3.下列物质跟浓H2SO4反应时,浓H2SO4不表现氧化性的是 ( )
A.食盐 B.氟化钙 C.硫化氢 D.铜片
4.工业上常用铁屑跟H2SO4反应并经除杂、浓缩、结晶、干燥等过程,来制取绿矾晶体。为制得较纯净的绿矾晶体,合理的方法是 ( )
A.使硫酸过量 B.使铁屑过量 C.使用稀硫酸 D.使用浓硫酸
5.用稀硫酸溶解FeS和Fe(OH)3的混合物56.6 g,可得到3.2 g硫。则原混合物中FeS的质量可能是 ( )
A.8.8 g B.21.4 g C.35.2 g D.47.8 g
6.在一定条件下能与某些酸、碱、金属和非金属反应的物质是 ( )
A.Al2O3 B.H2SO3 C.H2S D.NaHCO3
7.接触法制硫酸中,进入接触室的气体的体积分数为SO27%、O211%、N282%。将100体积混合气体通入接触室反应后,导出的气体恢复到原状况时变为97.2体积。则SO2的转化率为 ( )
A.40% B.60% C.80% D.90%
二、 填空题
8.某亚硫酸钠因长期存放已部分变质,某同学设计如下实验来确定其纯度:第一步,称取样品A g,需要的仪器和用品主要有 ;第二步,将样品溶解,用到的仪器主要有 ;第三步,在溶液中加入过量的用盐酸酸化的BaCl2溶液,①BaCl2溶液要用盐酸酸化的原因是 ;②BaCl2溶液要加过量的原因是 ;③检验BaCl2是否过量的方法是 ;第四步,过滤和洗涤沉淀。①过滤用的主要仪器有 ;②洗涤沉淀的原因是 ;③洗涤沉淀的方法是 ;④判断沉淀是否洗净的方法是 。第五步,烘干沉淀并计算。称量烘干后的沉淀为B g,则亚硫酸钠的纯度计算式为 。
9.据报道,1952年2月,某城市雾大无风,家庭和工厂排出的烟雾经久不散,每立方米大气中SO2的含量高达3.8 mg,烟尘达4.5 mg,居民健康普遍受到危害,4天之内死亡人数约 4 000多人。请回答下列问题:
⑴流经该城市的主要河道也因此受到污染,引起鱼类死亡,这与此种类型大气污染形成
有关;
⑵这种大气污染对人体 系统的危害最大,将会造成 等病症;
⑶大气中SO2将直接危害陆生高等植物的 组织;
⑷为了防止这种污染,硫酸厂可用氨水来吸收SO2,再用H2SO4处理,反应的离子方程式为 、 ;
⑸目前有一种比较有效的方法是:用直升飞机喷撒白垩粉以降解酸雨污染,其反应的离子方程式是 ;
⑹上述烟雾中含有另一种有害物质是NOx(NO2和NO),硝酸厂常用烧碱溶液来吸收氮的氧化物,其反应的离子方程式为 ;
⑺要防止类似悲剧出现,应采取的根本措施是 ;
⑻据调查,绿色区空气里细菌比闹市区的少7倍以上,其原因之一是有些植物能 而具有较强的杀菌能力。
10.在10.0 ℃和2×105 Pa的条件下,反应aA(g)dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变)。下表列出不同压强下反应建立平衡时物质D的浓度。
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/(mol·L-1) | 0.085 | 0.2 | 0.44 |
根据表中数据,回答下列问题:
⑴压强从2×105 Pa增加到5×105 Pa时,平衡向 (填“正”、“逆”)反应方向移动,理由是 。
⑵压强从5×105 Pa增加到1×106 Pa时,平衡向 (填“正”、“逆”) 反应方向移动,理由是 ,平衡之所以向该方向移动,这是由于 。
11.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
⑴写出 CO与NO反应的化学方程式 。
⑵“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是 。
⑶控制城市空气污染源的方法可以有( )
A.开发氢能源 B.使用电动车 C.植树造林 D.戴上呼吸面具
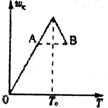
12.对于反应2A(g)+B(g) 2C(g)在反应过程中C的质量分数随温度变化如图,则:⑴T0对应的v正与v逆的关系是 ;
⑵正反应为 热反应;
⑶A、B两点正反应速率的大小关系是 ;
⑷温度T<T0时,C逐渐增大的原因是 。
【图-1】
13.⑴CuCl2有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++ 4Cl- =[CuCl4]2- + 4H2O
蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法。
⑵在2SO2+O2 2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量 (填“增加”、“减少”或“不变” ),其原因是 。
三、 问答题
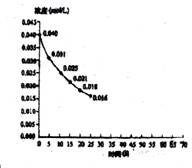
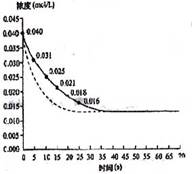
14.二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时达到平衡(NO2浓度约为0.0125 mol/L)。图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
【图-2】
⑴请计算前20 s内O2的平均生成速率。
⑵若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线。
⑶若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加入催化剂后的反应进程曲线。
⑷写出该反应的化学平衡常数表达式。
15.甘蔗厂在生产过程中需要使用SO2气体。为此需要在燃烧炉中燃烧硫磺。在生产中发现如下情况:当液态硫表面上空3 mm左右空间的温度为360~380 ℃时,燃烧硫磺的火焰为蓝色;温度超过450 ℃,火焰呈白色,此时硫磺消耗的速率加快,但SO2产率明显降低,在输送SO2的管道中随之出现严重堵塞现象。
⑴造成这种现象的原因是什么?⑵该步生产的关键是什么?
16.1982年,我国南方某城市郊区降了一场特大的酸雨,导致生态平衡受到严重破坏,郊农种植的西瓜全部死亡。我国政府于当年颁布了《关于开展全国酸雨普查的通知》,普查结果反映出我国酸雨降落的范围和酸度都较严重,酸雨已遍及我国西南、中南和华东地区。
酸雨是指pH小于5.6的各种大气降水,酸雨的形成是一种复杂的大气化学和大气物理现象,它是大气受污染的产物和表现。酸雨中含有多种无机酸和有机酸,多数情况下以硫酸为主。燃料燃烧、火山喷发、枯死植物腐烂、从含硫的金属矿石中提炼金属过程中都会产生二氧化硫,二氧化硫在空气和云中发生反应形成硫酸。
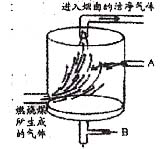
我国有许多燃煤电站,电站燃烧煤时产生了二氧化硫,为了减少二氧化硫的刺激,可在电站边建一座燃气脱硫工厂,工厂燃气脱硫工艺简图如下。请根据以上材料,结合所学知识回答:
【图-3】
⑴以上材料中,哪些是属于引起酸雨的人为因素?
⑵用化学方程式表示SO2形成酸雨的过程。
⑶酸雨不仅使土壤酸化,而且使土壤贫瘠,请说明酸雨使土壤贫瘠的原因。
⑷为减少电站的电能输送给远方时的能量损耗,采用何种输电方式比较合理?
⑸脱硫工艺简图中的A和B分别是什麽物质?
⑹你认为应该如何控制酸雨污染物,防止酸雨危害?
参考答案
一、 选择题
⒈C ⒉B ⒊A、B ⒋B、C ⒌A、C ⒍B、C ⒎C
二、填空题
⒏第一步:天平、质量相同的两片纸、药匙;第二步:烧杯、玻璃棒;
第三步:①排除CO32-、SO32-对BaSO4沉淀的干扰;②使SO42-充分沉淀;
③取滤液少许,滴入稀硫酸,若生成白色沉淀,证明加的BaCl2已经过量;
第四步:①漏斗、滤纸、漏斗架、玻璃棒、烧杯;②除去附在沉淀上的Na+、Ba2+、Cl-、H+;③用少量蒸馏水冲洗沉淀2~3次;④取洗液少量,加入AgNO3溶液,不生成沉淀,说明已洗干净;
第五步:ω(Na2SO3)%=[(A-142B/233)÷A]×100%。
⒐⑴酸雨 ⑵呼吸;呼吸困难、咳嗽、喉痛、支气管哮喘、肺气肿等
⑶叶 ⑷2NH3·H2O + SO2 = 2NH4++ SO32-+ H2O
⑸CaCO3 CaO + CO2↑ CaO +SO2 CaSO3 2CaSO3+ O2 2CaSO4
⑹NO + NO2 +2OH- = 2NO2-+ H2O;⑺严格控制污染源 ⑻分泌抗生素
⒑⑴逆 压强增大的倍数(5×105Pa /2×105Pa=2.5)大于D的浓度增大的倍数
(0.2mol·L-1/ 0.085 mol·L-1= 2.35)
⑵正 压强增大的倍数(1×106Pa / 5×105Pa=2)小于D的浓度增大的倍数
(0.44 mol·L-1/0.2mol·L-1=2.2)在该温度下,压强大于1×106Pa时,
A物质仍为气态,而D、E物质中至少有一种变成液态了。
⒒⑴2CO + 2NO→2CO2 + N2 ⑵SO2转化为SO3,产生硫酸酸雾。⑶a,b
⒓⑴V正=V逆 ⑵放 ⑶VA<VB ⑷反应未达到平衡V正>V逆
⒔⑴①加水稀释;②加AgNO3溶液;
⑵增加;因2SO2+O2=2SO3是可逆的,加入18O2后,S18O3将增加,其分解后,S18O2也将增加。
三、问答题
⒕⑴5.5×10-4mol·L-1·s-1; ⑵下图实线部分;⑶下图虚线部分;
⑷ K=[NO]2·[O2]/[NO2]2
【图-4】
⒖⑴温度过高,导致硫大量蒸发,来不及燃烧,硫蒸汽随部分产生的SO2一起输送出去,故硫消耗多,产率反而降低。在输送过程中,硫蒸汽冷凝成固体,导致管道堵塞。
⑵控制好温度,不能超过硫的沸点;又不能太低,影响反应的速率。
⒘⑴燃料燃烧,从含硫矿石中提炼金属
⑵SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4
或2SO2+O2=2SO3 SO3+H2O=H2SO4
⑶土壤pH下降,抑制了土壤中微生物的生长繁殖,从而影响有机物的分解和生物的固氮能力。
⑷高压输电 ⑸A:石灰石 B:空气
⑹控制二氧化硫的人为排放量,积极推广含硫燃料的脱硫技术,改革燃料燃烧的设备和装置,开发新型燃料。