高三化学提高测试6
一、选择题
1.为检验某未知溶液中是否有SO42-的下列操作最合理的是( )
(A) 加入硝酸酸化了的硝酸钡溶液
(B) 加入盐酸酸化了的氯化钡溶液
(C)先加硝酸酸化,再加入氯化钡
(D)先加盐酸酸化,再加氯化钡
2.鉴别纯碱、石灰石、芒硝、石膏四种固体物质,下列试剂中应选用( )
(A) NaOH溶液 (B) 水、盐酸 (C) 硝酸 (D) BaCl2和硝酸混合液
3.用盐酸、氨水、苛性钠溶液中的任何一种作试剂,均可鉴别的一组物质是( )
(A)氯化钠和碳酸钠
(B)氯化镁和硝酸铵
(C)氯化亚铁和硫酸亚铁
(D)硝酸银和氯化铁
4.下列各组溶液、不用试剂无法鉴别的是( )
(A)氢氧化钠和明矾 (B)氨水和硝酸银
(C)硫酸钠和氯化钡 (D)磷酸和氢氧化钡
5.向某溶液中通入过量的Cl2,滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀生成,则原溶液可能是( )
(A) AgNO3溶液 (B) Na2CO3溶液 (C) Na2SO3溶液 (D) CaCl2溶液
6.能将NaCl、NH4Cl、Al2(SO4)3、FeCl2、Fe(NO3)3、AgNO3六种溶液鉴别开来的一种试剂是( )
(A) HCl (B) NaOH (C) KSCN (D) BaCl2
7.以下根据实验现象的推断,正确的是( )
(A)能使湿润的碘化钾淀粉试纸变蓝的气体一定是氯气
(B)能使石蕊试液呈紫色的溶液一定呈中性
(C)在潮湿空气中能形成白雾的气态氢化物一定是氯化氢
(D)溶于水能形成无色溶液的棕色气体一定是二氧化氮
8.下列各组溶液,不用其他试剂就可以将它们区别开的是( )
(A)盐酸、氢氧化钠、碳酸钠、硫酸钠
(B)盐酸、硝酸银、氢氧化钠、硝酸钠
(C)氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠
(D)氯化钡、硫酸钠、氯化钙、硝酸钙
9.下列各组物质,只用水不能将其鉴别开的是( )
(A) 硫酸铜、碳酸钠、硫化铝三种粉末
(B)甲醇、乙醛、溴苯三种液体
(C) 苯、乙醛、四氯化碳三种液体
(D) 氢氧化钠、硝酸铵、氯化钠三种晶体
10.为了检验溶液中是否含有某种离子,下列叙述中正确的是( )
(A)加入硝酸银溶液即有白色沉淀生成,证明溶液中一定有Cl—离子
(B)加入浓NaOH加热,产生使湿润的红色试蕊试纸变蓝的气体,证明溶液中一定含有![]() 离子
离子
(C)加入NaOH溶液,析出白色沉淀,继续加入过量的NaOH溶液,沉淀又消失,证明溶液中一定含有Al3+离子。
(D)加入盐酸,放出能够使澄清石灰水变混浊的气体,证明溶液中一定含有CO![]() 离子。
离子。
11.下列各组溶液,不用其它试剂,也不用加热和进行焰色反应而能鉴别的是( )
①苯酚、乙醇、氢氧化钠、硝酸银、氯化铁,②氯化钡、碳酸钠、偏铝酸钠、硫代硫酸钠、盐酸,③氢氧化钠、硫酸铝、硫酸氢钠、碳酸钠、硫酸镁,④氯化钡、硫酸钠、氯化钙、硝酸钙、碳酸钠,⑤氯化钠、氢氧化钠、硫酸铜、氯化钡、氯化铝,⑥硫酸铝、碳酸氢钠、盐酸、偏铝酸钠、氯化钠。
(A)②④⑤ (B)②③④⑤
(C)①②③⑤⑥ (D)①②③④⑥
12.现有①NaOH②Al2(SO4)3③Ba(NO3)2④FeCl3⑤ KCl等五种溶液,不用其他试剂就可以把它们鉴别出来。被鉴别出来的物质顺序是( )
(A) ①②④③⑤ (B) ④①②③⑤ (C) ④②①③⑤ (D) ①②③④⑤
13.检验Cl2、H2S、NH3、HBr四种气体,可选用的湿润试纸有:
①醋酸铅试纸 ②碘化钾淀粉试纸 ③酚酞试纸 ④蓝色石蕊试纸 ⑤红色石蕊试纸,假定每种试纸限用一次。以下选项对应试纸的顺序正确的是( )
(A)②①⑤④ (B)⑤④②③
(C)⑤③①② (D)②①③④
14.下列各组物质,不用任何化学试剂,只需用互相作用的方法就可以鉴别的是( )
(A)氯气、氯化氢气体、溴化氢气体
(B)BaCl2溶液、NaOH溶液、AgNO3溶液、NaCl溶液
(C)NaCl溶液、NaBr溶液、NaI溶液
(D)盐酸、Na2CO3溶液、AgNO3溶液、NaCl溶液
15.两种物质混合而成白色粉末,进行如下实验,此混合物是( )
①加入大量的水未全溶解;②加入盐酸产生气泡③在试管内加入少量粉末,缓缓加热试管口有液滴凝结④加入稀硫酸产生气泡,且有沉淀生成
(A)NaHCO3和Al(OH)3
(B)KAl(SO4)2·l2H2O和ZnSO4
(C)Na2CO3·l0H2O和BaCO3
(D)PbCO3和KAl(SO4)2·l2H2O
二、填空题
16.有A、B、C、D、E、F六瓶未知溶液,它们分别是硫酸镁、氯化钡、碳酸铵、硝酸银、氢溴酸、氢氧化钠。为了鉴别,各取少许溶液两两混合,结果如下图表:表中“↓”表示有沉淀或微溶物质生成,“↑”表示有气体生成,“-”表示观察不到明显现象。由此可判断:A是 ,B是 ,C是 ,D是 ,E是 ,F是 。
| A |
| ||||
| ↑ | B |
| |||
| ↓ | ↓ | C |
| ||
| ↓ | - | ↓ | D |
| |
| ↑ | - | - | - | E |
|
| ↓ | ↓ | ↓ | ↓ | ↓ | F |
17.现有A、B两种气体,可能是H2、CO、NH3、HCl、SO2中的两种。若将A、B混合通入水中,A过量时生成物为C,B过量时则生成物为D。C和D的晶体加热都有A和B产生,加热D晶体时还有无色无味的液体E生成。
试推断A、B、C、D、E为何物质。A B C D
E 。
18.有1、2、3、4号4瓶未知溶液,它们是NaCl(0.1 mol·L-1)、HCl(0.1 mol·L-1)、NaOH(0.1 mol·L-1)和酚酞(0.1%)。有人不用其他试剂,就把它们一一鉴别开来了,其试验步骤如下:
⑴各取溶液少许两两混合,据此分成两组;
⑵取一组混合液,不断滴入另一组的一种未知溶液,据此可鉴别出1号和2号;
⑶在取已鉴别出的1号2 mL,滴入3滴3号未知液,在加入4号未知溶液4 mL,在这个过程中无明显试验现象。
综合以上试验,可以确认1号是 ,2号是 ,3号是 ,4号是 。
19.四种未知稀溶液A、B、C、D,它们分别是HCl、BaCl2、Na3PO4、Na2SO4中的某一种。唯一可选用的试剂是AgNO3溶液。某学生用它们作了三次试验,每次试验中都无明显现象。这三次实验是:
⑴将A加入C中,⑵将B加入A中,在向混合液中加C,⑶将AgNO3溶液加入D中。
根据上述试验结果,对于A、B、C、D四种物质能确证的是 、 、 、 。(填写分子式及对应的A、B、C、D,例:A为××。四空格可填满,也可不填满)
20.有两瓶失去标签的物质的量的浓度相同的碳酸钠溶液和碳酸氢钠溶液,请你加以鉴别:
①应选择的一种试剂是:
(A)氢氧化钠溶液 (B)甲基橙试液
(C)稀盐酸 (D)澄清石灰水
②简述上述试剂鉴别的试验操作、现象、结论 。
③除上述方法外,你认为是否还有更简便的方法? 。
21.欲鉴别氢氧化钡、氯化钡、氢氧化钠、硫酸、碳酸氢钠五种溶液:
①甲同学不用任何试剂,两两混合后即可鉴别,则确定碳酸氢钠的依据是 。
②乙同学只选用了一种试剂进行鉴别,该试剂是 ,有关的离子方程式是 。
22.某白色粉末,可能有(A)硫酸铝,(B)氯化铵,(C)碳酸钠,(D)硝酸银(E)氯化钡,(F)氢氧化钾中的两种或数种组合,取白色粉末适量,加蒸馏水溶解,得无色透明溶液。向该溶液中滴入稀硝酸,有白色沉淀生成。此白色粉末中至少含有哪几种物质?请写出全部可能的情况(填写相应的字母)。
第一种情况是 ;第二种情况是 ;第三种情况是 ;第四种情况是 (可不填满,也可补充)。
23.有一包固体混合物,可能是由氯化镁、氢氧化钠、氯化铜、氯化铵、明矾、硝酸钡这六种化合物中的几种混合而成。用它进行实验,记录如下:(l)混合物放在水中搅拌,得到无色无任何气味的透明溶液。向此溶液中滴入石蕊试液后呈蓝色。(2)向第一步实验所得的溶液中滴加稀硝酸,待溶液呈紫色时,有白色沉淀物出现;继续滴加稀硝酸,待溶液变红时,沉淀消失了,从以上实验可推断,此混合物由 组成。
24.鉴别可溶性硫酸盐、碳酸盐、亚硫酸盐、磷酸盐,可以采取以下从左到右的检验步骤:
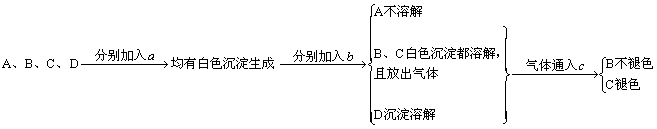
试推断A、B、C、D及试剂a、b、c的名称。
A B C D
a b c
25.有一包白色粉末可能含有下列阳离子和阴离子中的若干种。阳离子:K+、Na+、Fe2+、Fe3+、Cu2+、NH![]() 、Mg2+;阴离子:Cl-、SO
、Mg2+;阴离子:Cl-、SO![]() 、SO
、SO![]() 、CO
、CO![]() 、HCO
、HCO![]() 、S2-、MnO
、S2-、MnO![]() 。
。
进行如下实验,并将观察到的现象如下:
| 实 验 方 法 | 现 象 |
| ①取少量试样加水则全溶 | 溶液呈无色透明 |
| ②将所得溶液加NaOH并加热 | 无可见现象 |
| ③取少量原粉末加入盐酸 | 无可见现象 |
⑴从实验①可推断粉末中无 离子;
⑵从实验②可推断粉末中不可能有 离子;
⑶根据实验③可推断粉末中无 离子。
综上所述,如果要进一步断定有无哪种离子,则还需进行怎样的操作,请简要说明。
参考答案
一、选择题
1.C 2.B 3.D 4.C 5.A.C 6.B 7.D 8.B.C 9.B 10.B 11.C 12.B 13.A.D 14.A.D 15.C.D
二、填空题
16. A是(NH4)2CO3;B是NaOH;C是MgSO4;D是BaCl2;E是HBr;F是AgNO3。
17. 由于A、B混合通入水中产物有两种,故原气体为NH3和SO2。①若A为NH3,则B、C、D、E依次为SO2、(NH4)2SO4、NH4HSO3、H2O。②若A为SO2,则B、C、D、E依次为NH3、NH4HSO3、(NH4)2SO3、H2O
18. 1号是HCl,2号是NaCl,3号是NaOH,4号是酚酞。
19. D为Na2SO4
20. ①稀盐酸 ②将稀盐酸分别逐滴加入Na2CO3、NaHCO3溶液中,产生气泡剧烈者是NaHCO3溶液 ③pH试纸
21. ①在上述操作中,只有NaHCO3参与的反应出现一种气体和一种沉淀;只有BaCl2参与的反应只生成一种沉淀而无其他现象。②NH4HSO4,有关离子方程式为:
Ba2+ +2OH- + NH![]() + H+ + SO
+ H+ + SO![]() = BaSO4↓ + NH3↑ + 2H2O,
= BaSO4↓ + NH3↑ + 2H2O,
Ba2+ + SO![]() = BaSO4↓,HCO
= BaSO4↓,HCO![]() + H+
= H2O + CO2↑
+ H+
= H2O + CO2↑
22. 第一种情况:A、F,第二种情况:B、D、F。
23. NaOH, KAl (SO4)2·12H2O
24. A为硫酸盐 B为碳酸盐 C为亚硫酸盐 D为磷酸盐a为可溶性钡盐 b为盐酸 c为品红溶液
25.⑴Fe2+、Fe3+、Cu2+、MnO![]() ;(2)Mg2+、NH
;(2)Mg2+、NH![]() ⑶SO
⑶SO![]() 、CO
、CO![]() 、HCO
、HCO![]() 、S2-。可能含有的离子有K+、Na+、Cl-、SO
、S2-。可能含有的离子有K+、Na+、Cl-、SO![]() ;如要进一步断定有无哪种离子,首先通过焰色反应来检验有无K+和Na+。然后在一支试管内取少量试样溶于水配成溶液,向溶液中加入Ba(NO3)2溶液,如无沉淀产生说明没有SO
;如要进一步断定有无哪种离子,首先通过焰色反应来检验有无K+和Na+。然后在一支试管内取少量试样溶于水配成溶液,向溶液中加入Ba(NO3)2溶液,如无沉淀产生说明没有SO![]() ,必有Cl-,如有白色沉淀产生可加过量Ba(NO3)2使SO
,必有Cl-,如有白色沉淀产生可加过量Ba(NO3)2使SO![]() 沉淀完全并静置混合物直至分层,用滴管取得少量上层清液,加入盛有少量AgNO3溶液的另一试管中,如无沉淀说明不含Cl-,如有沉淀说明还含Cl-。
沉淀完全并静置混合物直至分层,用滴管取得少量上层清液,加入盛有少量AgNO3溶液的另一试管中,如无沉淀说明不含Cl-,如有沉淀说明还含Cl-。