高三化学提高测试
一、选择题(共15小题,每小题4分,共60分)
1.下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是
(A)碘和干冰的升华 (B)二氧化硅和生石灰的熔化
(C)氯化钠和铁的熔化 (D)苯和已烷的蒸发
2.分子晶体具有的本质特征是
(A)组成晶体的微粒是分子 (B)熔点一般比原子晶体低
(C)熔融时不导电 (D)晶体内微粒间以范德华力相结合
3.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是
(A)①③② (B)②③① (C)③①② (D)②①③
4.下列分子中,属于含有极性键的非极性分子的是
(A)H2O (B)Cl2 (C)NH3 (D)CCl4
5.下列晶体中,不属于原子晶体的是
(A)干冰 (B)水晶 (C)晶体硅 (D)金刚石
6.最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60.下列说法正确的是
(A)C60是一种新型的化合物
(B)C60和石墨都是碳的同素异形体
(C)C60中含离子键
(D)C60的分子量是720
7.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
(A)SO2和SiO2 (B)CO2和H2O
(C)NaCl和HCl (D)CCl4和KCl
8.下列过程中,共价键被破坏的是
(A)碘升华 (B)溴蒸气被木炭吸附
(C)酒精溶于水 (D)HCl气体溶于水
9. 下列含有极性键的离子晶体是
(A) CH3COOH (B) NaOH (C) Na2O2 (D) MgCl2
10.关于晶体的下列说法正确的是
(A)在晶体中只要有阴离子就一定有阳离子
(B)在晶体中只要有阳离子就一定有阴离子
(C)原子晶体的熔点一定比金属晶体的高
(D)分子晶体的熔点一定比金属晶体的低
11.下列化学式既能表示物质的组成,又能表示物质分子式的是
(A) NH4NO3 (B) SiO2 (C) C6H5NO2 (D) Cu
12.下列说法中正确的是
(A) 分子中键能越大,键越长,则分子越稳定
(B) 非极性分子内必存在非极性键
(C) 晶体熔化时,克服了微粒间的相互作用——化学键
(D) 电子层结构相同的不同离子,其半径随核电荷数增大而减小
13.下列各组物质,前者的沸点高于后者的是
(A)干冰与固态二硫化碳 (B)NaCl晶体与KCl晶体
(C)金刚石与晶体硅 (D)干冰、氧化钠、二氧化硅
14.金属的下列性质不属于物理性质的是
(A)反应中易失去电子 (B)良好的延展性
(C)良好的导电传热性 (D)良好的可塑性
15.下表中给出几种氯化物的熔点和沸点
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点℃ | 801 | 714 | 190 | -70 |
| 沸点℃ | 1413 | 1412 | 180 | 57.57 |
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体,其中与表中数据一致的是
A.只有①② B ② C 只有①②③ D 只有②④
二、填空题
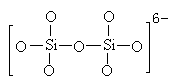
1.(2分)下图是石英晶体平面示意图,它实际上是立体的网状结构,其中硅、氧原子数之比为 .原硅酸根离子SiO44-的结构可表示为二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为 。
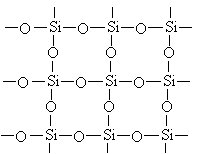 |
2.(8分)a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成共价型g分子。
试写出:(1)a微粒的原子结构示意图
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 >_____ (用化学式表示)
(3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属
(5)c微粒是 ,f微粒是 (用化学式表示)
3.(18分)下列八种晶体:A.水晶、B.冰醋酸、C.氧化镁、D.白磷、E.晶体氩、F.氯化铵、G.铝、H.金刚石。
(1)属于原子晶体的化合物是 ,直接由原子构成的晶体是 ,直接由原子构成的分子晶体是 。
(2)由极性分子构成的晶体是 ,含有共价键的离子晶体是 ,属于分子晶体的单质是 。
(3)在一定条件下能导电而不发生化学变化的是 ,受热熔化后化学键不发生变化的是 ,受热熔化需克服共价键的是 。
4.(2分)(1)下图为CO2分子晶体结构的一部分。观察图形,试说明每个CO2分子周围有____个与之紧邻等距的CO2分子。
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由高到低排列的顺序是____________(填写相应物质的编号)。
 |
![]() 表示一个CO2分子
表示一个CO2分子
CO2分子晶体
三、综合题
1.(10分)1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下的考虑:
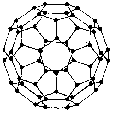
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键
②C60分子只含有五边形和六边形
③多面体的顶点数、面数和棱这数的关系,遵循欧拉定理:
顶点数 + 面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形, C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_____,理由是_______________ (2)试估计C60跟F2在一定条件下能否发生反应生成C60F 60(填“可能”或“不可能”)____________,并简述其理由______________________________________ (3)通过计算,确定C60分子所含单键数。
(4) C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
参考答案
一、选择题
1.AD 2.A 3.A 4.D 5.A 6.BD 7.B 8.D 9.B 10.A
11.C 12.D 13.BC 14.A 15.A
 二、填空题
二、填空题
1.1:2(1分) (1分)
1. (1)Ne(图略)(1分)
(2)NaOH>Mg(OH)2(2分)
(3)NH3+H2ONH3·H2ONH![]() +OH-(2分)
+OH-(2分)
(4)分子晶体(1分)(5)OH-、H3O+(2分)
3.(l)A,A、E、H,E;(2)B,F,D、E;(3)G,B、D、E,A、H(每空2分共18分)
4.(1)12(1分) (2)③②①(1分)
三.综合题
1.(1)金刚石、金刚石的晶体类型是原子晶体,而固体C60不属于原子晶体(实际上可以认为是分子晶体)(2分)
(2)可能、因C60分子中含有30个双键,与极活泼的F2发生加成反应可能生成C60F60(2分)
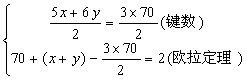 (3)由欧拉定理计算键数为60+(12+20)-2=90,则分子中的单键数=90-30=60(2分)
(3)由欧拉定理计算键数为60+(12+20)-2=90,则分子中的单键数=90-30=60(2分)
(4)设C70分子中的五边形的数目为x个,六边形的数目为y个,由题意可得方程组:
解得五边形的数目x=12,六边形的数目y=25(4分)