新课程高三化学综合测试题(4)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
相关相对原子质量:H 1 C 12 N 14 O 16 Mg 24 Si 28 Fe 56
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.近年来部分公交车使用天燃气作为动力燃料,这样做的主要目的是 ( )
A.加大发动机的动力 B.降低成本
C.减少对空气的污染 D.减少CO2排放量
2.氨水的碱性弱是因为 ( )
A.氨易从水中逸出
B.NH3易与H+结合
C.溶于水的氨大部分以氨分子形式存在
D.溶于水的氨大部分以一水合氨形式存在
3.关于氮化硅陶瓷的性能,下列说法不正确的是 ( )
A.是一种超硬物质,本身具有润滑性,并且耐磨损
B.抗腐蚀能力强,不与任何酸反应
C.耐高温而且不易传热
D.高温时也能抗氧化,且能抵抗冷热冲击
4.下列颜色变化过程中无化学反应发生的是 ( )
A.蛋白质遇浓硝酸变黄
B.含钠元素的物质在火焰上灼烧产生黄色火焰
C.pH试纸与某溶液接触变为红色
D.无色浓硝酸久置后变黄
5.在实验过程中,为防止下列情况发生,采取的措施错误的是 ( )
A.制取蒸馏水时,为防止烧瓶内产生暴沸,应事先向烧瓶中加入几片碎瓷片
B.在用系列实验装置制取和检验Cl2的实验时,尾气会污染空气,应用水吸收尾气
C.用加热KMnO4法所制得的氧气会略带紫色,应在靠近试管口的地方放一团棉花
D.用电石制乙炔,产生气体的速率过快,应逐滴滴入饱和食盐水
6.将pH=5的硫酸溶液稀释500倍,稀释后溶液中c(H+)与c(SO![]() )的比值为 ( )
)的比值为 ( )
A.10∶1 B.2∶1 C.1∶1 D.1∶10
7.最近科学家冶炼出了纯度高达99.9999%的铁,据你推测,下列性质它不可能具有的是
( )
A.硬度比生铁低 B.在潮湿空气中放置不易生锈
C.在冷的浓硫酸中可钝化 D.与4 mol·L-1盐酸反应的速率比生铁快
8.反应热是 ( )
A.燃烧热的集中表现 B.中和热的集中表现
C.溶解热的集中表现 D.键能变化的集中表现
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.向某盐溶液中通入过量Cl2后,滴加Ba(NO3)2溶液和稀HNO3溶液,有白色沉淀生成,则原
溶液可能是 ( )
A.AgNO3溶液 B.CaCl2溶液 C.Na2SO3溶液 D.Na2CO3溶液
10.有关高分子化合物的性质的描述不正确的是 ( )
A.一般具有良好的绝缘性
B.均不耐热,受热后会熔化改变原有形状
C.大多数合成高分子化合物不溶于水,抗酸碱性能较强
D.一般比同质量金属强度大
11.从下列现象可以判断某酸是强酸的是 ( )
A.加热该酸至沸腾也不分解 B.该酸可以与石灰石反应放出![]()
C.该酸可以把![]() 沉淀溶解 D.该酸浓度为0.1mol·L-1时的
沉淀溶解 D.该酸浓度为0.1mol·L-1时的![]() 为1
为1
12.氯的原子序数为17,![]() 是氯的一种同位素,下列说法正确的是 ( )
是氯的一种同位素,下列说法正确的是 ( )
A.![]() 原子所含质子数为18
原子所含质子数为18
B.![]() 的
的![]() 分子所含中子数约为
分子所含中子数约为![]()
C.![]() 的
的![]() 气体的体积为2.24L
气体的体积为2.24L
D.![]() 气体的摩尔质量为
气体的摩尔质量为![]()
13.已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性.ICl跟Zn、H2O分别发生如下反应:
2ICl+2Zn=ZnCl2+ZnI2 ; ICl+H2O=HCl+HIO,下列叙述正确的是 ( )
A.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物
B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物
C.在H2O跟ICl的反应中,ICl既是氧化剂又是还原剂
D.在H2O跟ICl的反应中,ICl既不是氧化剂又不是还原剂
14.某同学在实验报告中记录下列数据,其中正确的是 ( )
A.用25mL量筒量取12.36mL盐酸
B.用托盘天平称取8.75g食盐
C.用标准的NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mL
D.用广泛pH试纸测得某溶液的pH为3.5
15.下列离子方程式中, 正确的是 ( )
A.在氯化铝溶液中加入过量氨水 ![]()
B.在硫酸铜溶液中加入过量氢氧化钡溶液 ![]()
C.在澄清石灰水中通入过量二氧化碳 ![]()
D.在碳酸氢钙溶液中加入过量氢氧化钠溶液![]()
16.在pH = 1的含有Mg2+、Fe2+、Al3+三种阳离子的溶液中, 可能存在的阴离子是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
17.含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46KJ的热量,该反
应的热化学方程式正确的是 ( )
A.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=
-11.46 KJ/mo1
K2SO4(aq)+H2O(l) ΔH=
-11.46 KJ/mo1
B.2KOH(aq) +H2SO4(aq)= K2SO4(aq)+2H2O(aq) ΔH= -114.6 KJ/mo1
C.2KOH(aq)+ H2SO4(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 KJ/mo1
D.KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+ H2O(1) ΔH=-57.3 KJ/mo1
K2SO4(aq)+ H2O(1) ΔH=-57.3 KJ/mo1
18.在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:
Cu2++SO42-+xH2O![]() CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法
CuSO4·xH2O,当向溶液中加少量无水硫酸铜粉末后,下列说法
中,正确的是 ( )
A.溶液中Cu2+浓度增大 B.溶液中Cu2+数目减少
C.该硫酸铜晶体体积增大 D.溶液的蓝色变浅
第Ⅱ卷(非选择题 共78分)
三.(本题包括2小题,共19分)
19.(8分)下列操作或发生事故时的处理方法正确的是___ _(填字母)
(每选对1个给1分,全选对者加1分,多选不限,但每选错一个倒扣1分)
A.将pH试纸用蒸馏水湿润后,测定稀盐酸的pH值
B.称量一定质量NaOH固体时,应将NaOH放在小烧杯中称量
C.配制一定浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水
到刻度线。
D.浓H2SO4不慎沾在皮肤上,应立即用干布擦掉,然后用水冲洗,最后再涂抹小苏打溶液
E.使用酒精灯时不慎倾倒在桌面上而失火,应立即用湿抹布盖灭
20.(11分)为验证SO2既有还原性又有氧化性,请用下面的仪器和试剂回答问题。
供选用的仪器装置下图所示A、B、C、D。
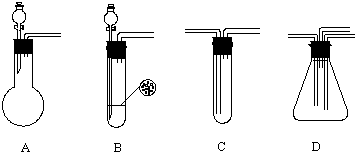
供选用的试剂:①盐酸 ②溴水 ③Na2SO3固体 ④FeS固体 ⑤NaOH溶液
(1)按SO2气流从左到右的方向,上图仪器装置,正确的连接顺序是________________。
(2)在装置A、B、C中应加入的试剂是(用试剂序号填写)A_______、B_____、C_____。
(3)表明SO2氧化性的实验在上图的______装置中进行,其中的化学反应方程式是:
______________________________________________________________________
表明SO2还原性的实验现象是___________________________________________。
(4)整套装置最后的气体出口导管应设计连接___________________装置,这样处理的
理由是______________________________________________________________。
四.(本题包括2小题,共20分)
21.(10分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸
及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3
首先制得BrO4-,不久得到纯净KBrO4晶体。
(1)已知XeF2与水反应生成O2和氙气,氟则以化合态留在水溶液中,其化学方程式为
___________________________________________,该反应的氧化剂是__________。
(2)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式
________________________________________ _________________________。
(3)根据上面的信息,指出BrO4-稳定性与pH的关系_____________________________。
22.(10分) A、B为两种单质,常温下均为固体。在元素周期表中A、B两种元素同周期
且原子半径A>B。分别取三份完全相同的质量均为1.520g的A、B混合物粉末进行如下
实验。
(a)向第一份试样中加入过量的盐酸,充分反应后放出0.896L气体(标准状况,下同),
还余下0.560 g残渣;
(b)向第二份试样中加入过量的10%的NaOH溶液,充分反应后放出0.896 L气体,还
余下0.960g残渣;
(c)将第三份试样隔绝空气加强热后,生成一种固体。冷却后,在隔绝空气的条件下加
入足量稀盐酸,该固体全部溶解,产生x L气体。
(1)单质A是____________________________________________________________。
(2)混合物中B的质量分数________________________________________________。
(3)写出实验(c)中有关反应的化学方程式,并计算x的值
五.(本题包括2小题,共20分)
![]() 23.(9分)乳酸是人体生理活动的一种代谢产物,其结构简式可表示为CH3—CH—COOH,
23.(9分)乳酸是人体生理活动的一种代谢产物,其结构简式可表示为CH3—CH—COOH,
|
以下是采用化学方法对乳酸进行加工处理的过程:
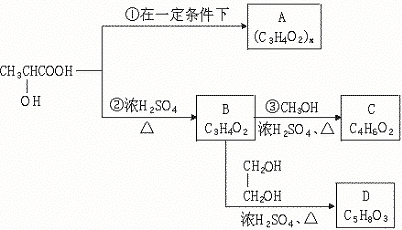
请填写下列空白:
(1)反应②的类型是 ,化合物A的结构简式是 。
(2)作为制作隐形眼镜的材料,对其性能要求应有良好的光学性能,还应具有良好的透
气性和亲水性,采用化合物D的聚合物而不是化合物C的聚合物作为隐形眼镜的材
料的主要原因是
。
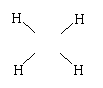
24.(11分)(1)液氨是一种溶剂,纯液氨电离有如水的电离,写出液氨的电离方程式
。
(2)金属钠能在液氨中慢慢溶解,钠与液氨的反应有如钠与水的反应,写出钠与液氨反
应的化学方程式
(3)N2H4称为肼或联氨,N2H4与NH3关系有如H2O2与H2O的关系,写出联氨结构式
为:
(4)N2H4在H2SO4存在时能使KMnO4溶液褪色且生成H2O、K2SO4、N2和MnSO4,写
出该反应的化学方程式:
六.(本题包括2小题,共19分)
25.(9分)CH4在一定条件下经催化氧化可以生成C2H2 和C2H4,现取一定量的CH4,经上
述催化氧化后得到混和气体,它在标准状况下的密度为0.7698克/升。已知反应中CH4
消耗了20%,计算混和气体中C2H2的体积百分含量(保留三位有效数字)。
26.(10分)下面进行单质铁溶于稀HNO3反应的分析及讨论,若Fe和HNO3的物质的量
分别用n(Fe)和n(HNO3)表示,试按下列要求,回答:
(1)当n(HNO3)≥4n(Fe)时,发生反应的化学方程式为:
______________________________________________________________________
(2)当n(HNO3)≤![]() n(Fe)时,发生反应的离子方程式为:
n(Fe)时,发生反应的离子方程式为:
______________________________________________________________________
(3)![]() n(Fe)<n(HNO3)<4n(Fe)时,反应情况可用下列通式表示(令a、b、c、d、
n(Fe)<n(HNO3)<4n(Fe)时,反应情况可用下列通式表示(令a、b、c、d、
e、f均取正整数)aFe+bHNO3(稀)—cNO↑+dFe(NO3)2+eFe(NO3)3+fH2O
①当a=16时反应中电子转移的数目(用n(e)表示)取值范围为__________________,
c的取值范围是__ ________________________。
②请参照上一问[(3)①]完成下表(可不填满,也可以补充)
| 组别 | a | b | c | d |
| 一 | 16 | |||
| 二 | 16 | |||
| 三 | 16 | |||
| 四 | 16 | |||
| 五 | 16 | |||
| 六 | 16 | |||
|
|
|
|
|
|
新课程高三化学综合测试
参考答案(综合四)
1.C 2.D 3.B 4.B 5.B 6.B 7.D 8.D 9.AC 10.B 11.D 12.BD 13.AD 14.C
15.C 16.AC 17.CD 18.BC
19.(8分)B、D、E (每选对1个给2分,全选对加2分,多选不能加分,且每多选1个倒扣2分)
20.(11分)(1)A、C、D、B (2分) (2)①③(1分) ①④(1分) ②(1分)
(3)D(1分) 2H2S+SO2=3S+2H2O(2分) 溴水褪色(1分)
(4)尾气吸收(1分) 保护环境,防止污染(1分)
21.(10分)(1)2 XeF2+2H2O=4HF+2Xe↑+O2↑ (3分) XeF2(2分)
(2)XeF2+BrO3-+2OH-=BrO4-+2F-+Xe↑+H2O(3分) (3)pH越大、BrO4-越稳定(2分)
22.(10分)⑴Mg(2分) ⑵36.8%(2分) ⑶2Mg+Si![]() Mg2Si;(2分)
Mg2Si;(2分)
Mg2Si+4HCl==2MgCl2+SiH4↑;(2分) x=0.020mol×22.4L/mol=0.448L(2分)
23.(9分)
![]()
![]()
![]() (1)消去 (3分) [ O—CH—C ]n (3分) (2)D中含有亲水的极性基团(3分)
(1)消去 (3分) [ O—CH—C ]n (3分) (2)D中含有亲水的极性基团(3分)
24.(11分)
![]() (1)NH3+NH3 NH
(1)NH3+NH3 NH![]() +NH
+NH![]() (2分)
(2分)
 (2)2Na+2NH3====2NaNH2+H2↑ (3分)
(2)2Na+2NH3====2NaNH2+H2↑ (3分)
(3) N—N
(3分)
(4)4KMnO4+5N2H4+6H2SO4====5N2+4MnSO4+2K2SO4+16H2O (3分)
25. (9分) 设反应前CH4为1摩尔,其中有X 摩尔转化为C2H2,即生成![]() 摩尔的C2H2 和
摩尔的C2H2 和![]() 摩的
摩的
C2H4。反应后混合气体总摩尔数为 = 0.8 + 0.1 = 0.9 (摩)
![]() (克/升)
解得X = 0.081
C2H2 的百分含量为 4.5%.
(克/升)
解得X = 0.081
C2H2 的百分含量为 4.5%.
26.(10分)(1)Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O (1分) (2)3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O(2分)
(3)①32<n(e)<48,(1分)从11到15的所有正整数或大于![]() 小于16的正整数(1分) ②(5分)
小于16的正整数(1分) ②(5分)
|
| b | c | d | e |
| 一 | 44 | 11 | 15 | 1 |
| 二 | 48 | 12 | 12 | 4 |
| 三 | 52 | 13 | 9 | 7 |
| 四 | 56 | 14 | 6 | 10 |
| 五 | 60 | 15 | 3 | 13 |