高三化学计算综合练习(四)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80 Mn:55
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.以NA表示阿佛加德罗常数,下列说法中正确的是
A.53g碳酸钠中含NA个CO32-
B.0.1molOH-含NA个电子
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L臭氧中含NA个氧原子
2.工业制硫酸时,进入接触室的气体组成为:SO2占7%,O2占11%,N2占82%。据测定,一定体积的混和气体进入接触室后,体积变化为原来的97.2%,则SO2转化率是
A.50% B.60% C.75.3% D.80%
3.已知乙醛、乙酸、甲酸甲酯和2—甲基—1—戊烯组成的混合物中,氧元素的质量分数为a%,则该混合物中碳元素的质量分数为
A.3a/4% B.3a/2% C.6(100—a)/7% D.a/4%
4.据报道,1995年化学家合成了一种分子式为C200H200的含有多个碳碳叁键的链状烃,其分子含有碳碳叁键最多有可以是
A.49个 B.50个 C.51个 D.100个
5.把6mol气体A和5mol气体B混合充入4L容器中,在一定条件下发生下列反应。3A(g)+B(g)![]() xC(g)+2D(g),达到平衡,需5min,此时生成的D为2mol,测得C的平均反应速率为0.1mol/(L·
min),下列说法中不正确的是
xC(g)+2D(g),达到平衡,需5min,此时生成的D为2mol,测得C的平均反应速率为0.1mol/(L·
min),下列说法中不正确的是
A.A的平均反应速率为0.15mol/(L· min) B.B的转化率为20%
C.平衡时B的浓度为1mol/L D.x的值为1
6.把80mL NaOH溶液加入到120mL盐酸中,所得溶液的pH为2。如果混和前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是
A.0.5mol/L B.0.10mol/L C.0.05mol/L D.0.2mol/L
7.由10g含有杂质的CaCO3和足量的盐酸反应,产生CO20.1mol,则此样品中可能含有的杂质是
| X | Y | |
| C1 | 75% | 25% |
| C2 | 80% | 20% |
A.KHCO3和MgCO3 B.MgCO3和SiO2
C.K2CO3和SiO2 D.无法计算
8.有两种元素X与Y,能生成两种化合物C1和C2,每种化合物的质量分数组成如下表:如果已知Cl的最简式为XY4则C2的最简式是
A.XY2 B.X2Y3 C.X3Y2 D.XY3
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的相对分子质量为
A.
![]() B.
B. ![]() C.
C.![]() D.
D.![]()
10.KHCO3和CaCO3的混合物同与之等质量的NaHCO3,二者分别与酸完全反应时,所消耗酸的量相等,则KHCO3和CaCO3的质量比为
A.17:8 B.1:1 C.17:4 D.任意比
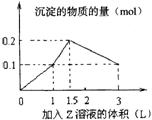 11.1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
11.1L某混合溶液中,溶质X、Y浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L氢氧化钠或硫酸溶液),所得沉淀的物质的量如图所示,则X、Y、Z分别是
A.氯化铝、氯化铁、氢氧化钠
B.氯化铝、氯化镁、氢氧化钠
C.偏铝酸钠、氢氧化钡、硫酸
D.偏铝酸钠、氯化钡、硫酸
12.有一氧化铁样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标准状况下0.56L氯气,亚铁离子全部转变为铁离子,则该氧化物可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
13.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL。燃烧等质量的上述混合物,得到氧化铜的质量是
A.35g B.30 g C.20 g D.15 g
14.取100mL18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体在标况下占有的体积为22.4L。将所得的溶液稀释成1L,测得溶液的H+浓度为1mol/L,则所生成的气体中SO2与H2的体积比约为
A.1:2 B.2:1 C.1:4 D.1:4
15.已知元素M的气态氢化物中含氢量为5.88%,M在最高氧化物中含M的质量为40%,又元素G的原子核外的电子层数与最外层电子数相等。G单质与M单质化合后的生成物化学式可能是
A.G2M B.M2G3 C.G2M3 D.G3M2
16.toC时,在VL密度为dg/cm3的FeCl3(式量为M)饱和溶液中,加入足量铁粉,充分搅拌后,测得溶液中有2molFeCl2,则toC时FeCl3的溶解度为
A.200M/(3Vd—2M)g B.400M/(3000Vd-4M)g
C.100M/(1000Vd-M)g D.M/15Vd g
17.甲、乙、丙三种不同浓度的稀H2SO4,分别跟等物质的量的Al、KHCO3和K2CO3刚好反应完全,所耗去甲、乙、丙三种酸的体积比为1:2:3,则甲、乙、丙三种酸物质的量之比应是
A.1:1:1 B.3:1:2 C.6:3:2 D.18:3:4
18.将固体MnC2O4·2H2O放在坩锅里加热,固体质量随温度变化的数据如下表:
| 温度/℃ | 25 | 50 | 75 | 100 | 214 | 280 |
| 固体质量/g | 17.9 | 17.9 | 16.0 | 14.3 | 14.3 | 7.15 |
下列说法不正确的是
A.25℃—50℃,MnC2O4·2H2O未发生变化
B.75℃时,MnCO4·2H2O部分失去结晶水
C.100℃时,坩锅内固体均为MnC2O4
D.200℃时,坩锅内固体为混合物
三、简答填空(26分)
19.(6分)在25℃、101kPa条件下,将15LO2通入10L CO 和H2 的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气中:
V(CO) = ________L,V(H2) = ________L
(2)若剩余气体的体积是a L,则原CO和H2的混合气中:V(CO):V(H2) = ________。
20.(10分)现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应。题中涉及的气体体积以标准状况计,填空时可以用带字母的分式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为 mol·L-1。
(3)如盐酸过量,生成CO2体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需知道
。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成CO2的体积(V)范围是 。
21.(10分)将nmol木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热。
⑴可能发生的化学反应有
①Fe+C=Fe+CO↑ ② 2FeO+C=2Fe+CO2↑ ③FeO+CO=Fe+CO2↑
和 ④ 。
⑵若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
⑶若n<4,充分批应后,反应器中的固体物质是 ,气体产物是 。
⑷若反应的气体产物是混合物,n的取值范围是 。
⑸若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为 。
四、分析推理(10分)
22.(10分)有许多现象,你去留心观察,分析思考,会发现一些有趣问题,从中发现规律。如下系列芳香族有机物,各项排列构成一个等差数列。请回答有关问题:
![]()
A1 A2 A3 A4 A5
(1)写出上面等差数列的第n项芳烃分子式 。
(2)某课外兴趣小组,做了系列实验。他们将该数列的前五项芳烃逐一加到浓的酸性高锰酸钾溶液中加热。结果发现,只有A1无明显变化,其余四种物质都能使酸性高锰酸钾溶液褪色。经分析知,后四种的氧化产物是![]() 、
、![]() 或者两者都有。由此你能得出什么结论
。
或者两者都有。由此你能得出什么结论
。
(3)甲、乙、丙三同学同做酸性高锰酸钾溶液氧化A5的实验。甲将氧化后的混合液酸化分离得到一种无色晶体X,称取0.254g X,用热水配成100mL溶液,取出25mL用0.1mol/L NaOH溶液中和滴定,滴到10mL时达到终点;丙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体Y,中和测定知Y的中和能力比X的中和能力弱得多;乙用酸性高锰酸钾溶液氧化A5,将氧化后的混合液酸化分离得到无色晶体,经分析其中包含了甲与丙获得的两种成份。通过计算确定X的结构简式。
(4)仔细分析该系列芳烃的二氯取代物异构体的数目,很有规律性。请你分析推出An的二氧取代物种数的代数表达式。
五、数形结合问题(17分)
23.(10分)已知Cl2和NO2在一定条件下可以化合成一种气态化合物A。为了测定A的组成进行如下实验:
(1)当Cl2与NO2混合气体以不同比例混合时,测得其平均相对分子质量分别为51和61,分别求出Cl2在上述混合气体中的体积分数 、 。
(2)取上述不同比例的混合气体各5L,在一定条件下充分反应后,气体体积均为4L,由此写出Cl2和NO2反应的化学方程式 。
 (3)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表
(3)设Cl2的体积分数为x(0<x<1),试讨论当x的取值不同时(Cl2与NO2的总体积为5L),反应后的总体积V随x变化的函数关系,将结果填入下表
| X值 | V(反应后混合气体体积) |
(4)请在右图中画出反应后的总体积V随x变化的函数图象。
24.(7分)有50mlNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
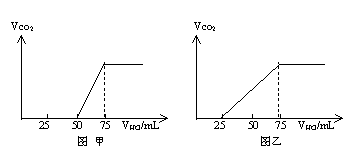
试分析NaOH在吸收CO2气体后,在甲乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标况)是多少?
化学计算综合练习(四)参考答案
| 1 | B | 2 | D | 3 | C | 4 | B | 5 | D |
| 6 | C | 7 | B | 8 | D | 9 | C | 10 | C |
| 11 | C | 12 | D | 13 | C | 14 | A | 15 | C |
| 16 | B | 17 | D | 18 | D |
| |||
19.(1)5 5
(2)(a-10)︰(20-a)
(3)10<a<20
20.(1)84∶100
(2)![]()
(3)![]() 或
或![]()
(4)盐酸的物质的量浓度
(5)![]()
|
⑴C+CO2 = 2CO
⑵FeO 和Fe,CO
⑶ C和Fe,CO
⑷ 1/2<n<1
⑸ 2/3
22.(1)C4n+2H2n+4[由C6H6、C10H8、C14H10……找出等差数列的系差为C4H2解题]。
(2)苯环特别稳定。
(3)①设X的式量为Mr,酸的元数为n,Mr=63.5n,晶体为有机酸,只含C、H、O三种元素式量只能是偶数,由此可以确定为Mr=254。X的结构简式为![]()
(4)第n项为![]() 。写出若干项的二氯取代物的异构体,列表如下:
。写出若干项的二氯取代物的异构体,列表如下:
| 苯环数 |
|
|
|
|
| …… |
| 二氯代物 | 7+3 | 9+5+1 | 11+7+3 | 13+9+5+1 | 15+11+7+3 | …… |
| 总数目 | 10 | 15 | 21 | 28 | 36 | …… |
可以初步定为每项二氯代物的种数为两个自然数的乘积:n×m![]() (m+2)(m+3)/2。
(m+2)(m+3)/2。
(若从奇偶数角度讨论再得出结论也可以,其它合理思路,只要结果正确也给满分。)
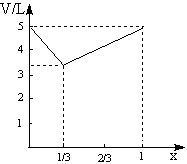
23.提示:当C12占体积分数0.2时,即C12为1L时,反应后气体体积减少1L;当NO2占体积分数0.4时,即2L时,反应后气体体积也减少1L。根据阿伏加德罗定律可知,C12+2NO2=2NClO2,即A的化学式为NClO2,至此,不难求出当C12不足或NO2不足时,反应后总体积随C12所占体积分数变化的函数关系。
(1)20%;60%。
(2)发生反应的化学方程为 C12+2NO2=2NClO2
(3)
| X值 | V(反应后混合气体体积) |
| x≤ | V=(5-5x)L |
| x> | V=2.5(x+1)L |
(4) 
24.NaOH溶液中通入一定量的CO2,有几种情况:一种是CO2不足,反应后的混合物为NaOH、Na2CO3;另一种情况是恰好反应生成Na2CO3;第三种是CO2过量,全部将NaOH转化为NaHCO3;第四种为Na2CO3、NaHCO3的混合物。
分析图象甲:加入盐酸50mL时开始产生CO2,至反应完毕消耗25mL盐酸,根据反应:
Na2CO3+HCl= NaHCO3+NaCl ①
NaHCO3+ HCl = NaCl +H2O+CO2↑ ②
可知滴加到50mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入盐酸50mL以前,无气体放出,Na2CO3与盐酸反应转化为NaHCO3应消耗25mL盐酸,则与NaOH反应的盐酸也是25mL,由此得出甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0.056L。
分析图象乙:滴加盐酸25mL时,开始有气体放出,消耗50mL盐酸反应完全,耗酸为未产生气体时的2倍,说明原物质是Na2CO3和NaHCO3的混合物,由耗酸量可判断出物质的量之比为1:1,产生气体亦可由产生气体耗酸量求得为0.112L。