高三化学计算综合练习(一)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.NA代表阿伏加德罗常数,以下说法正确的是
A.氯化氢气体的摩尔质量等于NA氯气分子和NA个氢分子的质量之和
B.常温常压下1mol NO2气体与水反应生成NA个NO3—离子
C.121g CCl2F2所含的氯原子数为2NA
D.62g Na2O溶于水后所得溶液中含有O2—离子数为NA
2.将H2、N2、O2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p)大小的关系,符合
A.p(H2)>p(O2)>P(N2) B.p(O2)>P(N2)>p(H2)
C.p(H2)>P(N2)>p(O2) D.P(N2)>p(O2)>p(H2)
3.某硅酸盐的组成可表示为:K2Al6Si6H4Ox,则x的值为
A.2 B.12 C.24 D.无法判断
4.将等物质的量的下列有机物分别在足量氧气中完全燃烧,立即使生成的产物全部通入足量Na2O2固体中,充分反应后,固体质量增重不相等的是
A.C2H6 C2H5OH B.CH2=CH-COOCH3 CH2=CH-CH=CH2
C.C3H8 C3H8O3 D.HCHO CH3COOH
5.某固体仅由一种元素组成,其密度为5.0g/cm3。用X射线研究该固体的结构时得知:在边长为10-7cm的正方体中含有20个原子,则此元素的相对原子质量最接近下列数据中的
A.32 B.120 C.150 D.180
6. R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
A. 1 B. 2 C. 3 D. 4
7.将胆矾与生石灰、水按质量比为1∶0.56∶100混合配成无机铜杀菌剂波尔多液,其成分的化学式可表示为CuSO4·xCaSO4·xCu(OH)2·yCa(OH)2 ,此种配比当x=3时,则y为
A.1 B.3 C.5 D.7
8.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
10.锌粉、铝粉、镁粉的混合物ag,与质量分数为25%的稀硫酸恰好反应完全,小心蒸发水分至干可得固体X(不含结晶水)bg,则反应生成的氢气质量为
A.![]() B.
B.![]() C.
C.![]() D.无法计算
D.无法计算
11.有m1 g KCl饱和溶液,其溶质的质量分数为c1%。改变温度或蒸发水后析出m3g KCl晶体,母液质量为m2g,其溶质的质量分为c2%。则下列关系一定正确的是
A.c1一定大于c2 B.m1-m3=m2
C.m1c1-m2c2=100m3 D.原条件下KCl的溶解度小于c1g
12.将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
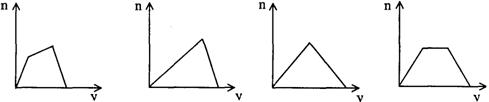
A B C D
13.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
14.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
15.某温度下,在100g水中加入mgCuSO4或加入ngCuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合9 B
A.m=![]() n B.m=
n B.m=![]() C.m=
C.m=![]() D.m=
D.m=![]()
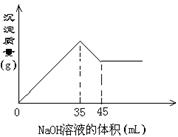 16.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
16.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则所用硫酸溶液的物质的量浓度为
A.3.50mol/L B.1.75mol/L
C.0.85mol/L D.无法计算
17.实验室将Na2SO3和NaClO3按分子个数1:2倒入烧杯中,同时加入适量硫酸,并用水浴加热,产生棕黄色气体X,反应后测得Na2SO3和NaClO3恰好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O2
18.把铝粉和Fe3O4配成铝热剂,并分成两等份,前一份在高温下恰好反应,并将生成物和足量的盐酸充分反应。后一份直接加入足量NaOH溶液使之充分反应,前后两种情况下生成的气体在同温同压下的体积比是
A.1∶1 B.9∶8 C.3∶4 D.4∶3
三、简答填空(25分)
19.(7分)在100℃时,将0.100mol的四氧化二氮气体充入1 L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下表格:
| 浓度 | 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c (N2O4)moL·L-1 | 0.100 | c 1 | 0.0005 | c 3 | a | b | |
| c (NO2)moL·L-1 | 0.000 | 0.060 | c 2 | 0.120 | 0.120 | 0.120 | |
试填空:
(1)该反应的化学方程式为 。达到平衡时四氧化二氮的转化率为 %。表中c 2 c 3、a b(填 > < =)。
(2)20s时四氧化二氮浓度C1= moL·L-1。
0s~20s四氧化二氮的平均反应速率为 moL·L-1·s-1。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,
二氧化氮的起始浓度是 moL·L-1。
20.(10分)(1)使平均式量为14的CO的H2的混合气体12g完全燃烧后的产物通过足量的Na2O2,固体增重 g。
(2)使16g甲醛完全燃烧后的产物通过足量的Na2O2,固体增重 g。
(3)使18g甲醇完全燃烧后的产物通过足量的Na2O2,固体增重 g。
(4)若使mg某有机物完全燃烧后的产物通过足量的Na2O2,固体可增重mg,则该有机物的通式是 。
(5)使mg丙三醇、葡萄糖、甲酸甲酯的混合物完全燃烧后的产物通过足量的Na2O2,固体可增重 g。
21.(8分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们有质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。已知mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称: 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB:mC= 。(保留2位小数)
四、分析推理(10分)
22.(10分)使含有a molAl3+的A溶液中的铝元素和含有b molAlO2-的B溶液中的铝元素全部转化为Al(OH)3沉淀,通过计算讨论有几种途径。写出相应的离子方程式。
要求: (1)不准另加固体和液体试剂;
(2)应答出每种途径所需试剂和所需试剂的物质的量。
若使C mol单质Al全部转化为Al(OH)3沉淀且使用原料最少,应该如何进行操作?写出相应的离子方程式。
 五、数形结合问题(19分)
五、数形结合问题(19分)
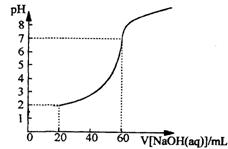
23.(8分)20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,如图所示。
(1)试求X、Y的物质的量浓度之比。
(2)求盐酸的物质的量浓度。
24.(11分)硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
 设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L。
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
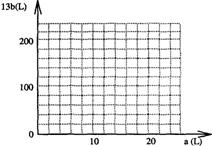
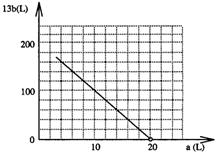
(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。
① 写出a和b的关系式:
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。
说明:为方便作图,纵坐标用13b表示。
化学计算综合练习(一)
参考答案
| 1 | C | 2 | C | 3 | C | 4 | D | 5 | C |
| 6 | B | 7 | D | 8 | B | 9 | B | 10 | C |
| 11 | C | 12 | D | 13 | B | 14 | B | 15 | B |
| 16 | B | 17 | C | 18 | C |
| |||
![]() 19.①N2O4
2NO2 (不写可逆号、不配平均不得分);60% ;> = =
19.①N2O4
2NO2 (不写可逆号、不配平均不得分);60% ;> = =
② 0.030 0.0015
③0.200
20.(1)12 (2)16 (3)18 (4)CxHyOx(5)m
21.(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)![]() 以及其他合理答案)
以及其他合理答案)
(3)①2种 ② Li2CO3 MgCO3 (4)①MgCO3,BeCO3,Na2CO3 ②1.05
22.(1)、应向A溶液中通入3a molNH3,离子方程式为Al3+ +3NH3·3H2O= Al(OH)3↓+3NH4+。 应向B溶液中通入b/2 molCO2或b/2 molSO2或bmolHCl、HBr 、HI等,(写出其中一个即可)离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-或2AlO2-+SO2+3H2O=2Al(OH)3↓+SO32-或2AlO2-+H++H2O= Al(OH)3↓(写出其中一个即可)。
(2)、将两种溶液混合,①、若b=3a,则全部生成Al(OH)3沉淀,离子方程式为:Al3+ + 3AlO2- +6 H2O=4 Al(OH)3↓②、若b >3a,则再向混合后的溶液中通入(b-3a)/2molCO2或(b-3a)/2mol SO2或(b-3a)molHCl、HBr 、HI等,离子方程式同上面。③、若b<3a,则再向混合后的溶液中通入3(a-b/3 )mol NH3即(3a-b)mol NH3,离子方程式同上面。
若使C mol单质Al全部转化为Al(OH)3沉淀且使用原料最少,应将1/4C mol Al与强酸反应转化为Al3+,另外3/4C mol Al与强碱反应转化为AlO2-,此时所用原料最少, C mol单质A l才能全部转化为Al(OH)3沉淀。离子方程式为:2Al+6H+=2Al3++3H2↑; 2Al+2OH-+2H2O=2AlO2-+3H2↑; Al3+ + 3AlO2- +6 H2O=4 Al(OH)3↓。
23. (1)0.200L×c[HCl(aq)]=0.600L×c[NaOH(aq)]
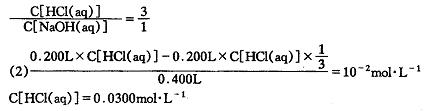
 24.(1)308
24.(1)308
(2)52
(3)设SO2为X(体积分数),则有
4×(11×X/8+0.0800)=1-0.0800-X
X=0.0923
(4)①13b=200-10a
②如右图所示。