高三化学科第三次调研考试
第Ⅰ卷 (选择题部分,共72分)
一、选择题(本题包括8小题,共32分。每小题只有一个选项符合题意。)
1.2003年2月1日美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨:
A.具有导电性、防辐射 B.密度小,减轻机身重量
C.熔点高、化学性质稳定 D.硬度小,有润滑作用
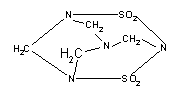 2.2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂——毒鼠强,导致200多人中毒,42人抢救无效死亡;已知毒鼠强的结构简式如右图:
2.2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂——毒鼠强,导致200多人中毒,42人抢救无效死亡;已知毒鼠强的结构简式如右图:
有关毒鼠强(化学名:四亚甲基二砜四氨)的下列说法正确的是:
A.毒鼠强属于无机物 B.毒鼠强属于烃
C.四个氮原子构成正四面体 D.毒鼠强的分子式为C4H8N4S204
3.随着人们生活节奏的加快,方便的小包装食品已经被广泛接受,为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是:
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁 C.白磷、碱石灰 D.生石灰、食盐
4.下列离子方程式正确的是:
A.氨气溶于醋酸:NH3+H+ ==== NH4+
B.镁溶于氯化铵溶液:Mg +2NH4+ =2NH3 + H2↑+ Mg2+
|
D.碳酸氢钡溶液中加入过量的氨水:Ba2+ + HCO3– + NH3·H2O === BaC03↓+ NH4+ + H2O
5.某白色固体可能是由①NH4Cl 、②AlCl3、③NaCl、④AgN03、⑤KOH中的一种或几种
组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加稀硝酸
至过量,有白色沉淀产生。以下对原固体的判断中不正确的是:
A.肯定存在① B.至少存在①④⑤
C.无法确定是否有③ D.至少存在②和⑤
![]() 6.对于平衡体系:mA(g) +
nB(g) pC(g) + qD(g),下列判断正确的是:
6.对于平衡体系:mA(g) +
nB(g) pC(g) + qD(g),下列判断正确的是:
A.若温度不变,将容器的容积增大1倍,达到新平衡时,A的浓度变为原来的0.45倍,
则![]()
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度平衡常数增大,说明该反应△H<0
D.若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原体积要小
7.下列除去杂质的方法中正确的是:
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C.除去FeCl2中的少量FeCl3:加入足量铁屑,充分反应后过滤
D.除去KCl中的少量MgCl2:加入适量NaOH溶液,过滤
8.元素X和Y元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原
子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是:
A.X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
B.Y元素的单质不能和金属氧化物反应
C.X和Y能构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素的阳离子
D.X元素的一种单质能效地吸收太阳光线中的紫外线
二、选择题(本题包括10小题,每小题4分,共40分。)
9.硫代硫酸钠是分析化学中常用试剂,已知硫代硫酸钠有下列性质:
Na2S2O3 + CO2 + H2O=== NaHCO3 + NaHSO3 + S↓;
2Na2S2O3
+ O2 ==== 2Na2SO4 + 2S↓;Na2S2O3![]() Na2SO3+S↓。
Na2SO3+S↓。
通常配制标准硫代硫酸钠溶液时,为防止变质,需用煮沸后经冷却的蒸馏水,还需加入少量的碳酸钠和少量的另一种试剂,这种试剂是:
A.硫酸 B.亚硫酸钠 C.硫 D.碘化汞(HgI2)
10.下列有关反应正确的是:
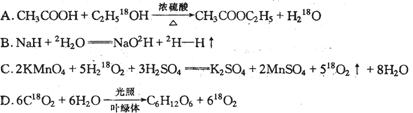
11.下列有关化工生产的叙述正确的是:
A.氯碱工业中,阳极发生的反应是:2H++2e→H2↑
B.粗铜精炼电解池中,粗铜作阳极
C.硫酸工业上,二氧化硫经接触氧化生成三氧化硫后,在吸收塔中用水吸收
D.硅酸盐工厂中,玻璃、水泥及陶瓷的主要原料都是石灰石和粘土
12.生活中的一些问题经常涉及到化学知识,下列叙述正确的是:
A.用加酶洗衣粉洗涤衣服时,温水比热水好 B.废旧电池灼烧后可作为化学肥料
C.铁制品在干燥的空气中比潮湿空气中更易生锈
D.酸性土壤施肥时,消石灰与碳酸氢铵可混合起来施用
13.在理论上可用于设计原电池的化学反应是:
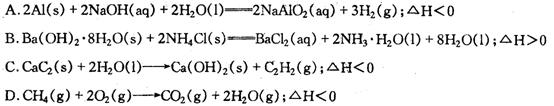
14.据报道,某地一辆装载有砒霜的货车因故滑下河道,部分砒霜散落到河中。砒霜的主要成分是As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水生成H3AsO3;其对应的盐也有毒性,其中碱金属对应的盐易溶于水,其它金属对应的盐几乎不溶于水。根据以上信息,下列说法正确的是:
A.As2O3是砷的最高价含氧酸的酸酐 B.As2O3的晶体为分子晶体
C.可向河水中投入纯碱,以消除对河水的污染
D.可向河水中撒入生石灰,以消除对河水的污染
15.某学生的实验报告中有下列数据:① 用托盘天平称取11.7 g氯化钠;② 用100 mL的量筒量取21.48 mL盐酸;③ 用容量瓶配制216 mL 1 mol/L的氯化钠溶液;④ 用酸式滴定管量取25.00 mL硫酸溶液;⑤ 用pH试纸测定H2SO4溶液的pH为3.2。其中合理的是:
A.只有①④ B.只有②④ C.只有①③ D.只有②⑤
16.在25℃时,向10 mL pH=10的NaOH溶液中加入pH=4的某一元酸HA的溶液,至pH恰好等于7(假设反应前后溶液密度不变),则对于反应后的溶液,下列关系一定正确的是:
A.![]() B.
B.![]()
C.溶液体积![]() D.溶液体积
D.溶液体积![]()
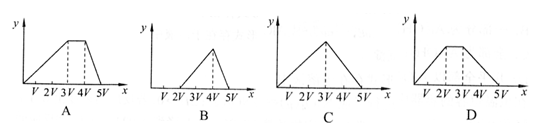 17.将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成V L混合溶液,向其中中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(Y)的关系的是:
17.将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成V L混合溶液,向其中中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(Y)的关系的是:
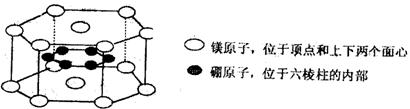
18.纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某
二硼化镁纳米颗粒的大小和形状恰好与二硼化镁晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数占总微粒数的百分数为:
A.22% B.33.3% C.66.7% D.70%
高三化学科 第三次调研考试
第Ⅱ卷(非选择题 共78分)
19.(8分)在某化学实验中,有如下循环过程,试回答下列问题:
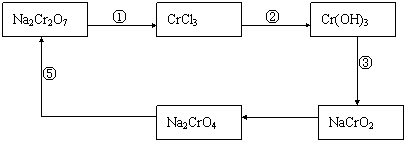 |
(1)在上述有编号的步骤中,需要还原剂的是 ,需要氧化剂的是 (填编号);
(2)在上述循环中,既能与强酸反应又能与强碱反应的物质是 (填化学式);
(3)请配平下列反应的化学方程式:
Na2CrO7 + KI + HCl → CrCl3 + NaCl + KCl + I2 + H2O
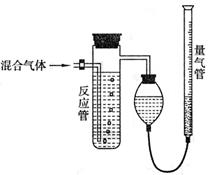
20.(9分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的
淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
|
(1) 混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式);
(2) 反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (偏高,偏低,无影响)。(3) 反应管内碘的淀粉溶液也可以用 代替(填写物质名称)。
(4) 若碘溶液体积为V1mL,浓度为c mol·L-1,N2与O2的体积为V2mL(已折算为标准状况下的体积)。用含c、V1、V2的代数式表示SO2的体积百分含量为 。
(5) 若将上述装置改为用下列仪器组装的简易实验装置,除导管外,还需选用的仪器为
(选下列仪器名称的编号)。
a.量筒 b.试管 c.容量瓶 d.广口瓶 e.烧杯 f.双孔塞 g.单孔塞
21.(10分)已知X、Y、Z、W是短周期中四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)写出元素符号:X ;Y ;Z ;W ;
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(注明反应条件) ;E分子的空间构成型为 ,电子式为 ;
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥,但长期施用会使土壤酸化,有关的离子方程式为 ;
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),
该化合物的水溶液与足量浓NaOH溶液反应的离子方程式为 。
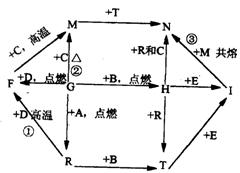 22.(10分):如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体。化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去。试回答下列问题:
22.(10分):如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体。化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去。试回答下列问题:
(1)H的电子式:___________________;
(2)写出化学反应方程式:
反应①______________________________
反应③______________________________
(3)C与T溶液反应的离子方程式:____________________________________
(4)5.4gC在G中燃烧放出166.9kJ热量,反应②的热化学方程式为:_____________________
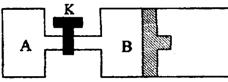 23.(6分)如图示,当关闭K时,向A中充入1
molX、1 molY,向B中充入2
molX、2 mol Y,起始时,V(A)
= V(B) = a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
23.(6分)如图示,当关闭K时,向A中充入1
molX、1 molY,向B中充入2
molX、2 mol Y,起始时,V(A)
= V(B) = a L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
![]() 2X(g)
+ 2Y(g)
Z(g) + 2W(g);△H<0,
2X(g)
+ 2Y(g)
Z(g) + 2W(g);△H<0,
达到平衡(I)时,V(B) = 0.8a L。请回答;
(1)B中X的转化率α(X)B为_______________;
(2)A中W和B中Z的物质的量比较:n(W)A ________ n(W)B(填大于、小于、等于);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为______________ (用a的代数式表示,连通管中气体体积不计。)
24.(10分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,其结构简式为:
![]()
试回答下列问题:
(1)苯氯乙酮分子中,在同一平面上的碳原子最多有 个。
(2)苯氯乙酮不可能具有的化学性质是:_____________(填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(3)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含—CH3,的化合物有多种,它们的结构简式是: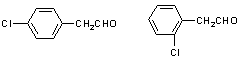
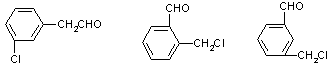
还有______________;_____________;_____________(根据本题意要求,必须写全同
分异构体,但不一定填满)。
25.(10分)今有X、Y两种有机物能发生如下转变,其关系如下图:
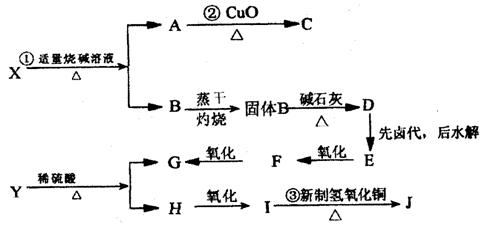
X的分子式为C5H10O2,J和X是同分异构体。只有Y、G、F、I能被新制Cu(OH)2氧化,H不能发生消去反应。已知:RCH2COONa→RCH3
(1)写出X、Y的结构简式 X:_____________;Y:_____________ 。
(2)写出图中反应方程式:
①_________________________________________________________
②_________________________________________________________
③_________________________________________________________
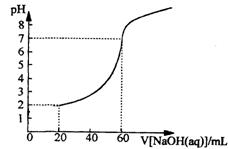
26.(6分)20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,如图所示:
(1)试求X、Y的物质的量浓度之比。 (2)求盐酸的物质的量浓度。
27.(9分)今有某一碱金属的两种碳酸盐和一种难溶于水的二价金属碳酸盐组成的混合物,取其4.18g与过量盐酸完全反应,在标准状况下放出二氧化碳体积为672.0mL,另取等质量的混合物加水搅拌可滤出难溶性盐1.11g。
(1)取过滤后滤液的十分之一体积向其中缓缓滴加浓度为0.250mol/L的盐酸,当滴加到6.00mL时开始产生二氧化碳气体,滴加到16.00mL时恰好完全反应,共产生标准状况下的二氧化碳56.0mL,试通过计算确定这两种碱金属碳酸盐的化学式。
(2)将滤出的1.11 g不溶性碳酸盐置于浓度为2.500 mol/L的盐酸中,当完全反应时耗去8.00mL,试通过计算确定不溶性盐的化学式。
附加题:
28.(10分)某研究性学习小组设计了测定镁原子的摩尔质量的实验(简易装置见下图)。该实验主要操作步骤为:①用砂纸擦去镁条表面的氧化膜,称得质量为Ag,系于铜丝末端;②锥形瓶中加有适量的稀硫酸、广口瓶中装有足量的水,连接好装置;③检查装置气密性;④把铜丝向下插入,使镁条完全浸入稀硫酸中:至镁条完全溶解;⑤恢复到实验室温度,正确操作读出量筒中水的体积为BmL。
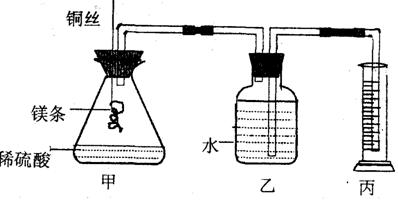
请回答下列问题:
(1) 用文字表述步骤③检查该装置气密性的操作与观察方法: ;
(2) 本实验除了数据A,B外,其他还需要测定的数据有 ;
(3) 如果镁条表面的氧化膜未除去,会导致实验结果______ ___(填:偏大、偏小、不变);
(4) 若实验是在101 kPa,25℃下进行的,水蒸气的影响忽略不计,此时气体摩尔体积约
为24.0 L/mol,镁原子的摩尔质量的计算式为(可不必化简):M(Mg)=__ ______ 。
高三化学科 第三次调研考试 答题卷
班级 姓名 学号 成绩
一、单项选择题(共4´8=32分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、1-2项选择题(共4´10=40分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(非选择题部分,共78分)
19、(1)需要还原剂的是 ,需要氧化剂的是 (填编号);
(2) 既能与强酸反应又能与强碱反应的物质是 (填化学式);
(3) , , ==== , , , , 。 (2x4=8分)
20、(1) ;(2) ;(3) ;
(4) ;(5) 。(2+1+2+2+2=9分)
21、(1) X ;Y ;Z ;W ;(2) 、
、 ;(3) ;
(4) 。(1x8+2=10分)
22、(1) ;(2) 、
;(3) ;
(4) 。(2x5=10分)
23、(1) ;(2) ;(3) 。(2x3=6分)
24、(1) 个;(2) ;(3) 、 、 。(2+4+4=10分)
25、(1)结构简式 X:__________ ___;Y: ;
(2)写出图中反应方程式:
① ;
② ;
③ 。(2x5=10分)
26、(6分)解:
27、(9分)解:
附加题:28、(1)
;(2) ;(3) ;
(4) 。(2x3+4=10分)