高三化学理论部分综合练习(二)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.下列关于能量转换的认识中不正确的是
A.电解水生成氢气和氧气时,电能转变成化学能
B.煤燃烧时化学能主要转变成热能
C.绿色植物光合作用过程中太阳能转变成化学能
D.白炽灯工作时电能全部转成光能
2.实现下列变化时需克服相同类型作用力的是
A.石墨和干冰的熔化 B.食盐和冰醋酸的熔化
C.液溴和水的汽化 D.碘和萘的升华
3.下列晶体中含有非极性共价键的离子晶体是
①硅晶体 ②H2O2 ③CaC2 ④NH4Cl ⑤Na2O2 ⑥苯酚
A.①②④⑥ B.①③ C.②④⑤⑥ D.③⑤
4.在25℃时,向体积为V、pH=a的盐酸中滴加体积为10V、pH=b的NaOH溶液,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)为
A.15 B.14 C.13 D.不能确定
5.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起白色泡沫
B.实验室常用排饱和食盐水的方法收集氯气
C.工业上生产硫酸的过程中使用过量的空气以提高SO2的利用率
D.合成氨工业使用500℃的高温以提高单位时间的产量
|
|
|
A.NaCl Na+ :Cl: B.HClO H :Cl:O:
|
|
|
|
C.-CH3 H:C : D.NH4I [H : N :H]+I-
7.几种酸碱指示剂变色的pH值范围如下:①甲基橙3.1~4.4②甲基红4.4~6.2③酚酞8.2~10。现用0.10mol/LNaOH溶液滴定浓度相近的HCOOH,则上述指示剂
A.都可以用 B.只能用③ C.可以用①或② D.可以用②或③
8.恒温下的下列实验过程中,有关溶液的浓度和质量始终不变的是
A.向浓氨水中持续通入干燥洁净的空气(不含CO2)
B.向KNO3饱和溶液中加入ngKNO3晶体
C.向98.3%浓H2SO4中加入ngSO3
D.向CuSO4饱和溶液中加入ng无水CuSO4
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.下列离子方程式中正确的是
A.氨水中加入明矾溶液:3OH-+Al3+===Al(OH)3↓
B.硫酸铜溶液中加入氢氧化钡溶液:SO42-+Ba2+===BaSO4↓
C.碳酸氢铵溶液中加入足量的氢氧化钠溶液:
NH4++HCO3-+2OH-===NH3·H2O+CO32-+H2O
D.向漂白粉溶液中通入SO2气体:
 Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
10.某物质的晶体中含有A、B、C三种元素,其排列方式如图所示(其中前后两面面心中的B元素的原子未能画出)。晶体中A、B、C的原子个数比为
A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3
11.X、Y为短周期元素,X原子各电子层的电子数之比为1 :4 :1,它比Y原子多3个电子,下列叙述正确的是
A.X离子半径大于Y离子半径 B.X、Y两元素位于同一周期
C.X单质在空气中燃烧可生成两种化合物 D.X、Y形成的化合物是共价化合物
12.恒温下,将两个铂电极插入一定量的Na2SO4饱和溶液里进行电解,经过一段时间后,在两极共产生![]() 气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4
气体,同时从溶液中析出m g Na2SO4·10H2O晶体,则原Na2SO4
饱和溶液的质量分数为
 A.71m/161(m+18n) B.71m/161(m+12n)
A.71m/161(m+18n) B.71m/161(m+12n)
C.71/161(m+36n) D.m/161(m+12n)
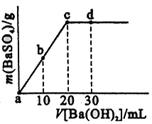
13.常温下,向0.1mol·L-1的硫酸溶液中逐滴加入物
质的量浓度相同的氢氧化钡溶液,生成沉淀的量与
加入氢氧化钡溶液的体积关系如图所示。a、b、c、
d分别表示实验时不同阶段的溶液,下列有关说法中
不正确的是
A.c、d溶液呈碱性 B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.溶液的pH:a<b<c<d
14.把6 mol气体A和5 mol气体B混合后充入4 L密闭容器中在一定条件下反应:3A (g) + B (g) ![]() x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速率为0.1 mol /(L•min),则下列结论错误的是
A.x的值为1 B.B的平衡浓度为1.0 mol /L
C.B的转化率为20% D.A的平均速度为0.15 mol / (L•min)
15.R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2。它可能形成的含氧酸根离子有:①R2O42-、②RO42-、③R2O32-、④RO32-。则下列判断正确的是
A.当它形成①时,不可能形成④ B.当它形成②时,不可能形成③、④
C.当它形成①时,不可能形成②、③ D.当它形成②时,可以形成①
16.等体积等物质的量浓度的强碱MOH溶液和弱酸H2A溶液混合后,混合液中有关离子的浓度关系不正确的是
A.c(M+) +c(H+) = c(HA—)+2c(A2—)+c(OH—) B.c(M+) =c(HA—) + c(A2—) + c(H2A)
C.c(H2A) + c(H+) =c(A2—) +c(OH—) D.c(M+) >c(A2—) >c(HA—) >c(H+) >c(OH—)
17.某温度下,反应N2O4(g)![]() 2NO2(g)-Q在密闭容器达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变的条件可能是
2NO2(g)-Q在密闭容器达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(NO2)/c(N2O4)与原平衡相比变小了,则改变的条件可能是
①保持容器容积和温度不变,向容器内补充了NO2 ②保持容器容积和温度不变,向容器内补充了N2O4 ③保持温度压强不变,向容器内补充了N2 ④保持容器的容积不变,升高了温度
A.只有② B.只有③ C.①② D.①②③
18.在容积相同的甲、乙两个密闭容器中均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
A.反应过程中的某时刻,甲容器中的反应速率比乙中的大
B.达到平衡时,甲容器反应所需时间比乙容器少
C.乙容器中SO2的转化率大于25%
D.平衡时,乙容器中SO2,O2,SO3的浓度之比一定为2:1:2
三、简答填空(28分)
19.(13分)水是一种宝贵的自然资源,是人类生活、动植物生长和工农业生产不可缺少的物质.
(1)水分子可以发生电离生成两种含有相同电子数的微粒,其电离方程式为 。
(2)固态水(冰)属于 晶体,它能浮在水面上,其原因是 。固态水(冰)中每个水分子被四个水分子包围形成变形的正四面体,这些正四面体通过氢键相互连接形成晶体.则1mol冰中含有 mol氢键。
(3)水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态 D.玻璃态水是分子晶体
(4) 1997年,国外某大学做了一个实验:有一个圆筒形的超导磁体,其中心部位有一个直径为5cm的空洞,把水放入空洞中,然后让磁体产生21特斯拉的磁场,结果发现水在空气中浮了起来.试对产生该现象的原因进行解释 。
(5) 用铂电极电解含有一定量重水(D2O)的水,在阴极收集到的气体中将含有H2、HD和D2.电解1 L含重水0.017%(质量分数)的水(设其密度为 1g/cm3),将阴极所得气体分离得到HD和D2,已知分离后所得气体的平均相对分子质量为3.5,则这种气体在标准状况下的体积为 L。
(6)面对水资源短缺, 我们既要节约用水,又要对污水进行必要的净化处理,以防污染环境。
①若实行海水淡化供应饮用水,下列方法从原理上分析完全不可行的是( )
A.加明矾使海水的盐分沉淀而淡化 B.利用太阳能将海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮水
D.将海水通过离子交换树脂,以除去所含离子
②近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:![]() NH3+HClO H2O+NH2Cl(一氯氨) .NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因
。
NH3+HClO H2O+NH2Cl(一氯氨) .NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因
。
③铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,已知它的氧化性强于KMnO4,在反应中本身被还原为Fe3+,将它溶入浑浊的泥水中,既能起杀菌消毒作用,又能使泥浊沉降,试配平制取铁酸钠的反应方程式:
□Fe(NO3)3+□NaOH+□Cl2—□Na2FeO4+□NaNO3+□NaCl+□H2O.
该反应中的还原产物是 。铁酸钠能沉降泥浊的原因是 。
20.(9分)不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
 (2)推测x值与原子半径的关系是
。据据短周期元素的x值变化特点,体现了元素性质的
变化规律。
(2)推测x值与原子半径的关系是
。据据短周期元素的x值变化特点,体现了元素性质的
变化规律。
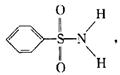
(3)某有机化合物结构式如右图所示,其中S—N键中你认为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
21.(6分)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
□Na2SO3+□KIO3+□H2SO4─□ Na2SO4+ □K2SO4+□I2+□H2O
(1)配平上面的氧化还原反应方程式,将系数填入方框中。
(2)其中氧化剂是 ,若反应中有5 mol电子转移,则生成的碘是 mol。
(3)该反应的过程和机理较复杂,一般认为发生以下①—④反应:
①IO3-+SO32-= IO2-+SO42- (反应速率慢)
②IO2-+2SO32-= I-+2SO42- (反应速率快)
③5I-+6H++ IO3-=3I2+3H2O(反应速率快)
④I2+SO32-+H2O= 2I-+SO42-+2H+(反应速率快)
根据上述步骤推测该反应总的反应速率由 应应决定(填写上述四步反应的序号)。
(4)若预先加入淀粉溶液,由上述四步反应可以看出必须在 离子消耗完
全时,才会有使淀粉变蓝的现象产生。
四、实验设计(13分)
22.(6分)请自己设计实验证明0.1mol/L氨水是弱碱溶液(试剂、方法自选),简述实验操作过程、实验现象和结论。(三种方法以上)
 23.(7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
23.(7分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
(2)用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积Vcm3。
请回答下列问题:
①步骤(1)中A仪器最好使用____________(填序号)。
A.量简 B.烧杯 C.容量瓶 D.试管
②步骤(2)中用酸式滴定管还是用碱式滴定管____________,理由是______________
_____________________________________________________________。
③能否用水代替苯____________,理由是________________________________。
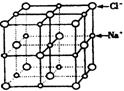
④已知NaCl晶体中,靠得最近的![]() 与
与![]() 间的平均距离为a cm(如上图),用上述测定方法测得的阿伏加德罗常数
间的平均距离为a cm(如上图),用上述测定方法测得的阿伏加德罗常数![]() 的表达式为______________________________。
的表达式为______________________________。
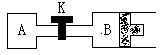 五、计算推理(13分)
五、计算推理(13分)
24.(6分)如图所示,当关闭K时,向A中充入1molX、1molY,向B中充入2molX,2molY,起始时,V(A) = V(B) = aL。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:2X(g)
+ 2Y(g) ![]() Z(g)
+ 2W(g); △H<0,达到平衡(Ⅰ)时,V(B) = 0.8aL。请回答:
Z(g)
+ 2W(g); △H<0,达到平衡(Ⅰ)时,V(B) = 0.8aL。请回答:
⑴B中X的转化率α(Y)B为___________________。
⑵A中W和B中Z的物质的量比较:n(Z)B __________ n(W)A (填大于、小于、等于)。
⑶打开K,过一段时间重新达平衡(Ⅱ)时,A和B的总体积为_______________(用a的代数式表示,连通管中气体体积不计) 。
 25.(7分)FexO晶体中最小重复单元(晶胞)的结构为NaCl型(如右图所示),由于晶体缺陷,X值小于1.测知FexO晶体密度ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
25.(7分)FexO晶体中最小重复单元(晶胞)的结构为NaCl型(如右图所示),由于晶体缺陷,X值小于1.测知FexO晶体密度ρ=5.71g/cm3,晶胞边长为4.28×10-10m。
求:(1)FexO中x值(精确至0.01)为 。
(2)晶体中的Fe分别为Fe2+、Fe3+,其中Fe2+所占分数(用小数表示,精确至0.01)为 。
(3)此晶体的化学式为 。
(4)Fe在此晶体中占据空隙的几何形状是 (即与O2-距离最近且等距离的铁原子围成的空间形状) 。
(5)在晶体中,铁元素的离子间最短距离为 m。
理论部分综合练习(二)
参考答案
| 1 | D | 2 | D | 3 | D | 4 | C | 5 | D |
| 6 | B | 7 | B | 8 | B | 9 | C | 10 | A |
| 11 | C | 12 | B | 13 | A | 14 | A | 15 | C |
| 16 | D | 17 | C | 18 | C |
| |||
19.(1)2H2O![]() H3O++OH-.(2)分子晶体,由于氢键的形成,使冰的密度变小;2. (3)C (4)水分子具有极性.(5)0.254L.(6)①BD.②生成了稳定的NH2Cl,通过平衡移动,延长了反应时间.③2,16,3-2,6,6,8;NaCl; 铁酸钠被还原为Fe3+,Fe3+水解生成的Fe(OH)3胶体聚沉泥浊.
H3O++OH-.(2)分子晶体,由于氢键的形成,使冰的密度变小;2. (3)C (4)水分子具有极性.(5)0.254L.(6)①BD.②生成了稳定的NH2Cl,通过平衡移动,延长了反应时间.③2,16,3-2,6,6,8;NaCl; 铁酸钠被还原为Fe3+,Fe3+水解生成的Fe(OH)3胶体聚沉泥浊.
20.(1)0.93-1.57 (2)2.25-3.44
(2)X越大,原子半径越小,
周期性
(3)氮
(4)共价键
(5)六-IA
21.(1)5、2、1、5、1、1、1 (2)KIO3 0.5
(3)① (4)SO32-
22.(1)直接测定溶液的pH值,若pH<11即为弱碱
(2)取一定体积0.1mol/L氨水与相同体积相同浓度的盐酸反应,测定反应后溶液酸碱性,若为酸性,即为弱碱
(3)在少量AlCl3溶液中滴加0.1mol/L氨水出现沉淀,继续滴加若沉淀不溶解即为弱碱
(4)在氨水溶液中滴入酚酞溶液变红,再加入醋酸铵固体,振荡,若溶液颜色变浅即这弱碱(利用了弱碱存在电离平衡)
23.①C
②酸式滴定管,碱式滴定管的橡胶因溶于苯而变形。
③不能,NaCl溶于水,不能测出NaCl固体的体积。
④![]() =
=![]()
24.⑴80% ⑵大于 ⑶ 1.2a L
25.(1)0.92
(2)0.826
(3) Fe(Ⅱ)0.76Fe(Ⅲ)0.16O
(4) 正八面体.(5)3.03×10-10