高三化学理论部分综合练习(三)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.下列变化过程中,无化学键断裂或生成的是
A.石墨转化为金刚石 B.NaCl晶体溶于水
C.干冰升华 D.HCl溶于水
2.常温下,在10mL、0.2mol/L氨水中,滴入0.2mol/L的稀盐酸,使溶液pH=7。则下列说法正确的是
A.加入盐酸的体积大于10mL B.c(NH4+)=c(Cl-)
C.加入盐酸的体积等于10mL D.c(NH4+)<c(Cl-)
3.HNO2的下列性质中,可以证明它是弱电解质的是
A.0.1mol·L-1HNO2溶液pH值约为2
B.用HNO2溶液作导电性实验,灯泡很暗
C.HNO2与NaCI溶液不反应
D.含0.1molHNO2和0.1molNaOH的两溶液恰好反应
4.1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是
A.原子中原子核的内部结构 B.化学反应中原子的运动
C.化学反应中生成物分子的形成 D.化学反应中反应物分子的分解
5.已知同周期的X. Y. Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是:
HZO4>H2YO4>H3XO4,下列判断正确的是
A.单质的氧化性按X、Y、Z的顺序减弱
B.原子半径按X、Y、Z的顺序增大
C.水溶液的PH值Na3XO4>Na2YO4>NaXO4
D.阴离子的还原性按X3-、Y2-、Z-顺序减弱
6.A、B为短周期元素,A原子所具有的电子层数是最外层电子数的1/2,B原子次外层电子数是最外层电子数的1/3,A与B能形成多种原子团,其中一定不存在的是
 A.AB32— B.A2B32— C.AB42— D.AB4—
A.AB32— B.A2B32— C.AB42— D.AB4—
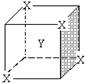
7.某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为
A.90° B.60° C.120° D.109°28′
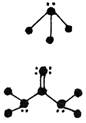
8.下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。其中分子结构图与对应化学式关系错误的是
|
|
C. (C3H4O) D. (BF3)
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3
B.用沸点数据推测将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率的快慢
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
10.下列各组离子能在指定溶液中,大量共存的是
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度c(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A.①②⑤ B.①③⑥ C.②④⑤ D.①②④
11.酸溶液甲和碱溶液乙等体积混合后,溶液pH<7。以下叙述一定不符合这一情况的是
A.甲是弱酸,乙是强碱,混合后原酸碱完全中和
B.甲是强酸,乙是弱碱,混合前甲中c(H+)和乙中c(OH-)相等
C.甲是强酸,乙是强碱,混合前甲、乙的物质的量浓度相等
D.甲是弱酸,乙是强碱,混合前甲中c(H+)和乙中c(OH-)相等
12.将1×10—3 mol•L—1的盐酸a L跟下列3种溶液混合后,溶液均成中性。
①1×10—3mol•L—1的氨水b L;②c(OH—)=1×10—3 mol•L—1的氨水c L;③c(OH—)=1×10—3 mol•L—1的Ba(OH)2 d L。其中a、b、c、d的关系正确的是
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
13.在一密闭容器中。反应mA(g)+nB(g)![]() pC(g)达平衡时,测得c(A)为0.5 mol•L—1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L—1,则下列判断正确的是
pC(g)达平衡时,测得c(A)为0.5 mol•L—1 ;在温度不变的情况下,将容器体积增大一倍,当达到新的平衡时,测得c(A)=0.3
mol•L—1,则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
14.近年来用红外激光技术研究液氢时,发现分子间作用力也可引起粒子间的反应。在液氢中有氢分子和质子形成的H3+离子,其构型是等边三角形;H3+还可进一步形成Hn+。下列判断正确的是
A.H3+可在液氢中开成H5+、H7+、H9+
B.每个H3+粒子中含有2个质子
C.H3+可在液氢中形成H4+、H5+、H6+
D.H3+可广泛存在于固态、液态和气态氢中
15.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)![]() 2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
2C(g),反应达到平衡时,A的转化率为0.4。则平衡混合物中物质的量n(A)、n(B)和n(C)应满足的关系是
A.n(A)=n(C) B.n(B)=n(C)
C.n(A)+n(B)=n(C) D.n(B)+n(C)=n(A)
16.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A.c(Na+)+ c(H+)= c(X—)+ c(OH—)
B.c(HX )+ c(X—)= c(Na+)
C.若溶液呈酸性,则c(X—)>c(Na+)>c(HX)>c(H+)>c(OH—)
D.若溶液呈碱性,则c(Na+)>c(HX)> c(X—)>c(OH—)>c(H+)
17.今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量的NaHSO3晶体(mmol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
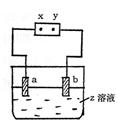 18.如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
18.如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,下列组合符合这一情况的是
|
三、简答填空(26分)
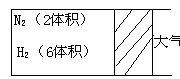 19.(6分)在一定温度下,把2体积
19.(6分)在一定温度下,把2体积
N2和6体积H2通入一个带有活塞的容积
可变的容器中,活塞的一端与大气相通,
发生反应N2(g)+3H2(g) ![]() 2NH3 (g) ;
2NH3 (g) ;
ΔH<0达到平衡,测得混合气体为7体积。
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2、NH3体积,若反应达到平衡后,混合气体中各物质的百分含量仍与上述平衡完全相同,那么:
若a=1, c=2则b=_____,在此情况下,反应起始时将向_____方向进行。
若规定起始时反应向逆方向进行,则C的取值范围是______________。
(2)在上述装置中,若起始时的a、b、c值均与(1)相同,但需控制平衡后混合气体为6.5体积,则可采取措施是______,其原因是__ ____。
20.(10分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期,C是F不同周期的邻族元素。B原子最外层电子数比其次外层电子数多2;A、B两种元素的核电核数之差等于它们的原子最外层电子数之和;E和F 的原子序数之和为30。现有由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物,这些化合物中的原子个数比如下表:
| 化合物 | 各元素原子个数比 |
| 甲 | N(A)︰N (C)=2︰1 |
| 乙 | N(A)︰N (C)=1︰1 |
| 丙 | N(B)︰N (A)=1︰1 |
| 丁 | N(D)︰N (C)=1︰1 |
| 戊 | N(E)︰N (F)=1︰3 |
| 己 | N(B)︰N (F)=1︰4 |
请回答下列问题:
(1)化合物己的电子式为_________________。
(2)向乙的水溶液中加入MnO2,其氧化产物是________________。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_________________________________________。
(4)F的单质与甲反应的离子方程式为____________________________。
(5)戊与足量丁投入甲中发生反应的总化学方程式为:
____________________________________________________________。
21.(10分)已知某溶液中只存在OH—、H+、Na+、CH3COO—四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
② c(CH3COO—)>c(Na+)>c(OH—)>c(H+)
③ c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
④ c(Na+)>c(OH—)>c(CH3COO—)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是____________,上述四种离子浓度的大小顺序为_______(填序号)。
(2)若上述关系中①是正确的,则溶液中的溶质为____________;若上述关系中④是正确的,则溶液中的溶质为____________。
(3)若该溶液是由体积相等的稀醋酸和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)______c (NaOH)(填“大于”、“小于”或“等于”,下同),混合前酸溶液中c(H+)和碱溶液中c(OH—)的关系c(H+)______c(OH—)。
四、实验设计(13分)
22.(4分)试利用你家里的一些物品,设计一原电池,画出其原理图,并说明检测电流的方法.
23.(9分)为测定冰醋酸在加水稀释的过程中溶液导电能力的变化,某学生用下图所示仪器设计了一个实验。
(1)请将下图所示仪器间没有连接的部分用导线连接起来完成本实验。
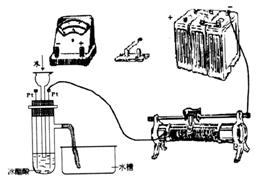
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1< t2< t3,且在实验全过程上t2时刻电流计指针偏转为最大):
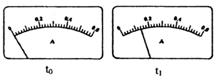
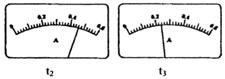
请据此信息分析,在t1到t2的过程中,溶液中c (H+)(填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程上,溶液中c (H+)(填“增大”“减小”或“不变”)_________;请用简要文字解释冰醋酸在稀释过程中c (H+)变化的原因_____________。
(3)下图中横坐标均表示向一定量冰醋酸中加入水的体积,请判断图中纵坐标的意义并填空:纵坐标表示(请填选项字母):醋酸的电离度________;醋酸的浓度________;溶液的导电能力________。
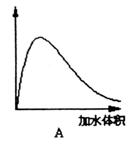
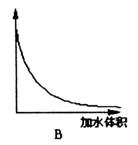
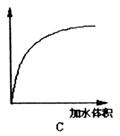
五、计算与推理(15分)
24.(6分)某温度下,将一定量的密度为1.15g/L的NaCl溶液电解(惰性电极),设NaCl
恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量分数为80%。
求:(1)电解后溶液中溶济和溶质的物质的量之比。
(2)原溶液的物质的量浓度。
25.(9分)YBa2Cu3Ox是近年来科学家发现的一种高温超导材料。YBa2Cu3Ox中,Y、Ba、O三种元素都有固定的化合价,分别为+3、+2、-2,而Cu是+2和+3的混合价态,化学式中x为未知数。现用碘量法测Cu,进而求得x值。
取4.00×10-2g YBa2Cu3Ox样品,用稀盐酸溶解,在氩气保护下加1gKI固体。样品中的Cu3+和Cu2+分别氧化KI,再用0.0100mol/LNa2S2O3溶液滴定得到I2(Cu3++3I-=CuI+I2,2Cu2++4I-=2CuI+I2),终点时消耗Na2S2O3溶液23.45mL。另取一份质量相等的YBa2Cu3Ox样品,用稀盐酸溶解,煮沸,使其中的Cu3+全部转化为Cu2+,冷却后用碘量法滴定,终点时消耗18.13mL 0.0100 mol/L Na2S2O3(在滴定时S2O32-转变为S4O62-)。请回答下列问题:
(1)写出在滴定过程中S2O32转变为S4O62-离子方程式。
(2)求出Cu3+和Cu2+物质的量之比。
(3)求出x值。
理论部分综合练习(三)
参考答案
| 1 | C | 2 | B | 3 | A | 4 | A | 5 | D |
| 6 | D | 7 | D | 8 | C | 9 | C | 10 | C |
| 11 | D | 12 | B | 13 | C | 14 | A | 15 | C |
| 16 | A | 17 | B | 18 | A |
| |||
19.⑴① 3 ,逆反应方向
② 1 < C ≤4
⑵ 加压等; 可用勒夏特列原理解释。
20. (1)略 (2)O2
(3)CaC2+2H2O = Ca(OH)2+C2H2↑
(4)Cl2+H2O = HClO+H++Cl-
(5)AlCl3+2Na2O2 = NaAlO2+3NaCl+O2↑
21.(1)CH3COONa 、③
(2)CH3COONa+CH3COOH、CH3COONa+NaOH
(3)大于、小于
22.可用废旧电池的碳棒、锌皮、铁丝等做电极,用食醋、食盐的水溶液或水果等做电解质溶液,用用废旧电线做导线;用“随身听”等的耳机、音乐贺年卡的小扬声器做电流的检测装置。装置图略。
23.(1)如图所示
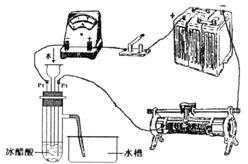
(2)增大;减小; 由于冰醋酸中没有水,醋酸分子无法发生电离,则t0时刻c (H+)约为零;当加入一定量的水时,醋酸溶液浓度有所减小,但醋酸的电离度增大,导致溶液中c (H+)增大;当加入大量水后,尽管电离度继续增大,但醋酸浓度的减小成为影响c (H+)的主要因素,所以溶液中c (H+)反而减小。
(3)C;B;A;
24.(1)10:1 (2)4.8 mol/L
25.(1)[2分]2S2O32-=+I2=2S4O62-;(2)[3分]532/1281;(3)[3分]6.94