高三化学理论部分综合练习(四)A
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.下列事实不能用电化学理论解释的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不用特殊方法保存
D.锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快
2.在由水提供的c(H+)=1×10-14mol/L的水溶液中一定能大量共存的离子组是
A.Fe2+、Fe3+、SO42-、Cl-、NO3- B.Na+、Br-、SO32-、S2O32-、ClO- 2 D
C.Al3+、K+、Cl-、NO3-、Br- D.Cs+、I-、SO42-、Li+、Cl-
3.下列说法正确的是(NA表示阿佛加德罗常数的值)
A.SiO2晶体中, 有NA个Si就有2NA个Si—O键
B.P4分子中P和P—P键的比为2∶3
C.常温常压下,1mol碳烯(∶CH2) 所含电子数为6NA
D.在10.6gNa2CO3晶体中CO32-数目不到0.1 NA
4.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,B2-具有与Ar相同的核外电子层结构,则下列说法正确的是
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数不相等
C.A是第2周期第Ⅲ族的元素 D.B是第3周期ⅥA族的元素
5.最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,但反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是
A.Zn+2HCl=ZnCl2+H2↑ B.NH3+HCl
|
C.NaOH+ HCl=NaCl+H2O D.H2O+CH3COOH![]() H3O++CH3COO-
H3O++CH3COO-
6.已知钍原子(23290Th)可发生放射性变化:23290Th![]() 22888X+42He,其中X是生成的一种新元素,对X的判断正确的是
22888X+42He,其中X是生成的一种新元素,对X的判断正确的是
A.X位于第六周期;
B.X的单质能与冷水剧烈反应;
C.X的最高正价为+3价;
D.X的氢氧化物具有两性.
7.电解KOH溶液时,若阴、阳两极分别为碳和铁,当生成0.1mol Fe(OH)3沉淀时,共消耗amol H2O,产生bLH2(标准状况).则a和b分别为
A.a=0.25,b=2.24; B.a=0.05,b=2.24;
C.a=0.25,b=4.48; D.a=0.3,b=3.36.
8.有主族元素形成的三种离子:Xn+、Ym-、Zm+,已知m>n,Xn+ 与Zm+多1个电子层,Z与Y同周期,三种原子的M层电子数均为偶数,则Y元素为
A.硅 B.氧 C.硫 D.碳
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,分析下列说法中正确的是
A.反应S(g)+O2(g)=SO2(l)为吸热反应
B.S(g)+O2(g)=SO2(l); △H<297. 3kJ/mol
C.1mol SO2的键能总和大于1mol S和1mol O2键能之和
D.1mol SO2的键能总和小于1mol S和1mol O2键能之和
10.在反应X+2Y
R+2M中,已知R和M的摩尔质量之比为22:9,1.6gX与Y恰好反应后,生成4.4gR,则此反应中Y和M的质量之比为
 A.16:9 B.23:9 C.32:9 D.46:9
A.16:9 B.23:9 C.32:9 D.46:9
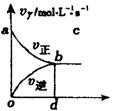
11.在容积固定的2L密闭容器中,充入X、Y气体各2mol发生反应X(g)+2Y(g)=2Z(g),并达平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间的关系如图所示,则Y平衡浓度表达式正确的是(式中S指对应区域的面积)
A.2-Saob B.1-Saob
C.2-Sabdo D.1-Sbod
12.在恒温恒压下,向容积可变的密闭容器中充入3LA和2LB发生如下反应:3A(g)+2B(g)
![]() xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA, 0.8LB,3LC, 0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x, y的值分别为
xC(g)+yD(g)达到平衡时,混合气体中D的体积分数为W%,若维持温度、压强不变,将1.2LA, 0.8LB,3LC, 0.6LD作为起始物质充入密闭容器中,达到平衡时混合气体中D的体积分数仍为W%,则x, y的值分别为
A.x=3, y=1 B.x=2, y=3 C.x=4, y=1 D.x=5, y=1
13.表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的是
A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
14.在-50℃时液氨中存在着下列平衡:2NH3(l)![]() NH+4+NH-2,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时液氨的叙述中正确的是
NH+4+NH-2,两种离子的平衡浓度均为1.0×10-15mol·L-1。以下有关-50℃时液氨的叙述中正确的是
A.离子积为1.0×10-15
B.向液氨中加入金属钠,平衡不移动
C.向液氨中加入氨基钠(NaNH2),液氨的离子积不变
D.向液氨中加入NH4Cl,c(NH+4)增大,离子积的数值也随之增大
15.石墨晶体为层状结构,层内每个碳原子以三个共价单链与其它碳原子连结合组成正六边形平面网状结构,则每层碳原子个数与碳碳单链数之比为
A.1:1 B.1:3 C.2:3 D.3:2
16.在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol
及bmol碘化氢(a>b),待反应 2HI(g) ![]() I2(g)+H2(g) 达到平衡后,下列说法肯定正确的是
I2(g)+H2(g) 达到平衡后,下列说法肯定正确的是
A.从反应开始到建立平衡A容器中所需的时间短
B.平衡时A、B两容器中I2蒸气的浓度相同
C.平衡时I2蒸气在混合气体中的百分含量,A容器大于B容器
D.平衡时HI的分解率aΑ小于aB
17.羟磷灰石[Ca3(PO4)2·Ca(OH)2]是牙齿表面的一层坚硬物质,它可保护牙齿,它在唾液存在如下平衡:Ca3(PO4)2·Ca(OH)2 ![]() 4Ca2++2PO43-+2OH-进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀。当使用含氟牙膏刷牙时形成氟磷石灰石
4Ca2++2PO43-+2OH-进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀。当使用含氟牙膏刷牙时形成氟磷石灰石
[Ca3(PO4)2·CaF2],能防止龋齿。下列说法正确的是
A.牙齿受到腐蚀的原因是有机酸可以溶解羟磷灰石,使之矿化
B.说明氟磷石灰石比羟磷灰石溶解度大
C.多食用碱性食物可以防止龋齿,有利于人体健康
D.使用含氟牙膏时,能发生如下反应:4Ca2++2PO43-+2F- Ca3(PO4)2·CaF2
18.目前人们正在研究开发一种高能电池—钠硫电池。它是以熔融的钠硫为两 极,以Na+导电,以β—Al2O3陶瓷作固体电解质,反应如下:2Na+xS![]() Na2Sx,以下说法正确的是
Na2Sx,以下说法正确的是
A.放电时,钠作正极,硫作负极 B.放电时,硫发生氧化反应
C.充电时,钠极与外电源的正极相连D.充电时,阳极发生反应:Sx2―-2e-=xS
 三、简答填空(27分)
三、简答填空(27分)
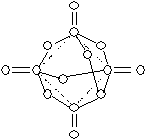
19.(12分)磷在空气中充分燃烧后生成X的分子结构如图所示。图中的圆圈表示原子,实线表示化学键。
(1)图中共有 个磷原子,请将其涂黑。写出该化合物的化学式 。
(2)X分子内磷原子排成 形,每个磷原子处于 的中心。
(3)X分子中共含P-O-P键 个。X极易与水作用,其作用过程是P-O-P键断裂过程,每断裂一个P-O-P键就可以结合 个H2O分子。
(4)1molX与4molH2O作用的化学方程式为 ;若每个X与6个H2O作用,则生成物的分子式为 。
(5)磷在不充足的氯气中燃烧的化学方程式 ,用磷酸钙制取磷酸的化学方程式 。
(6)磷在空气中燃烧生成的氧化物通常可用作强干燥剂。制备100 g这种干燥剂所消耗的空气的体积约为 L(在标准状况下)。
|
有 个。
20. (4分)将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)![]() 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:
2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示:
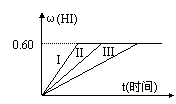 ⑴达平衡时,I2(g)的物质的量浓度为 。
⑴达平衡时,I2(g)的物质的量浓度为 。
⑵若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 ____________。
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
⑶若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。
21.(11分)已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出元素符号:X________;Y________;Z________;W________。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件)________;E分子的空间构型为________,电子式为________;E在催化剂存在的条件下,可用于还原汽车尾气中的________,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速交肥料,但长期施用会使土壤酸化,有关的离子方程式为 。
(4)这四种元素可组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量NaOH溶液反应的离子方程式为________。
(5)将9gY单质在足量W单质中燃烧,所得气体通入1L1mol/L的NaOH溶液中,完全吸收后,溶液中的离子浓度由大到小的顺序是 。
四、实验设计(12分)
22.(6分)用滴管将新制的饱和氯水慢慢滴入含酚酞的氢氧化钠稀溶液(样品 )中,当滴到最后一滴时红色突然褪去,产生该现象的原因可能有两个:
(1)是由于
(简要文字说明)
(2)是由于
(简要文字说明)
(3)简述怎样用实验证明红色褪去的原因是(1)或者是(2)。
。
23.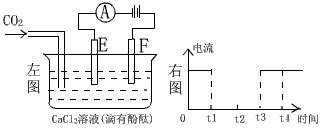 (6分)如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入到电解液中。
(6分)如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入到电解液中。
(1)请在右图中完成左图实验中电流对时间的变化关系图。
(2)电解时,F极的电极反应式为_____________________,
电解总反应式为______________________。
(3)电解池中产生的现象:
①________________________________ ②___________________________________________________
③____________________________________________________
五、计算推理(15分)
24.(6分)在390℃、3×106Pa下,以CO和H2为原料合成甲醇,其反应式为:CO+2H2
![]() CH3OH(g),当原料气中H2和CO比例不同时,对CO的转化率及平衡混合物中甲醇的质量分数都有影响。
CH3OH(g),当原料气中H2和CO比例不同时,对CO的转化率及平衡混合物中甲醇的质量分数都有影响。
(1)以m表示H2和CO的物质的量之比(即![]() ),a 为CO的转化率,Y为平衡混合物中CH3OH的体积百分含量,试导出与m,a的关系式:
;
),a 为CO的转化率,Y为平衡混合物中CH3OH的体积百分含量,试导出与m,a的关系式:
;
(2)下表列出m=1,2,3,4时的一部分实验数据,试计算出空格中转化率a和平衡时CH3OH的含量Y?
| m | 1 | 2 | 3 | 4 |
| a | 25% | 45% | ③ | ④ |
| x | ① | ② | 19.35% | 16.35% |
① ② ③ ④
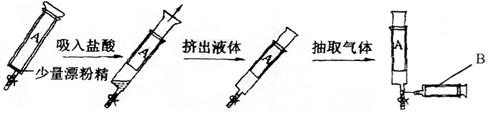
25.(9分)现取用一个容量为200mL的大注射器(A),在注射器的套筒内预先盛放0.2414g漂粉精,然后吸入足量的盐酸,反应充分后,将注射器内的液体小心地推出,这时注射器内的黄绿色的气体折合为标准状况下的体积是40.32mL。
(1)然后用B注射器在A注射器的橡皮管上抽取折合为标准状况下的黄绿色气体
5.00mL,再吸入水若干,当B注射器内气体恰好全部溶入水中时,形成的氯水约为
多少体积(20℃时,氯气的溶解度0.7293g/100g水,假设该氯水的密度为1g/cm3)?
(2)漂粉精是NaClO和NaCl的混合物,其物质的量之比为1∶1,在制漂粉精时,难免有极少量的烧碱多余,你能否计算出这种漂粉精中除NaClO和NaCl之外的杂质含
量
|
(3)将二滴氯水蓝色石蕊试纸上,试纸的颜色有什么变化?反映了氯水具有什么性质?
(4)将该氯水放置一段时间,B注射器内会出现气体,且将注射器剧烈振荡也不能使气体消失,相反地,气体数量还略有增加,这是为什么?
(5)若将该氯水长时期放置你估计B注射器内出现气体的体积约是多少?你可用怎样的化学方法确定这种气体是什么?具体的操作步骤怎样?
(6)你还可以利用A注射器内的氯气做哪些氯气性质的试验?当实验结束时,A注射器内多余的氯气应如何处理?
理论部分综合练习(四)
参考答案
| 1 | C | 2 | D | 3 | B | 4 | D | 5 | B |
| 6 | B | 7 | A | 8 | C | 9 | C | 10 | A |
| 11 | B | 12 | D | 13 | B | 14 | C | 15 | C |
| 16 | A | 17 | D | 18 | D |
| |||
 19.(1)4;如图所示; P4O10。
19.(1)4;如图所示; P4O10。
(2)正四面体,P、O四面体。
(3)6,1
(4)P4O10+4H2O=2H3PO4+2HPO3, H3PO4.
|
|
(5)2P+3Cl2======2PCl3;Ca(PO4)2+3H2SO4====3CaSO4+2H3PO4
(6)188(空气中氧气含量按21%计算)或者197(空气中氧气含量按![]() 计算)
计算)
(7)2
20.(1)0.05mol·L-1 (2) ③⑤;④ (3)4a + c = 2b
21.

|
(2)N2+H2 2NH3;三角锥形;
![]() (3)NH4++H2O NH3·H2O+H+
(3)NH4++H2O NH3·H2O+H+
(4)NH4++HCO3-+2OH- NH3↑+2H2O+CO32-
22.(1)氯水中H+与碱中OH-中和。
(2)氯水中HClO的氧化性所致。
(3)向褪色溶液中再滴加一滴NaOH溶液,若红色再现,则是①,若红色不再现则说明是②。
23.(1)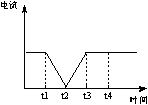
(2)2Cl――2e-=Cl2↑。 2Cl―+2H2O![]() Cl2↑+ H2↑+2 OH―。
Cl2↑+ H2↑+2 OH―。
(3)①E电极附近呈现红色②E、F极上均有气泡逸出,且速率基本相同。③连续通入CO2气体时,先有白色沉淀生成,后又逐渐消失。
24.(1)![]() ; (2)①16.67%;②21.43%;③56%;④62%。
; (2)①16.67%;②21.43%;③56%;④62%。
25.(1)5.00 mL氯气的质量71g/ mol ×5.00 mL/ 22400 mL = 0.01585 g 。
z克水能吸收0.1585 g氯气。0.01585 g/ 0.7293 g = z g/ 100g 约形成2.173 mL 氯水。
 |
(2)NaClO Cl2 向左的反应是吸收氯气。根据化学方程式计算
NaClO + 2HCl = NaCl + H2O + Cl2↑
74.5 g 22400 mL
x g 40.32 mL
NaClO理论质量x = 0.1341 g 0.2414 g × y%×74.5 g/ mol/133 g/ mol = 0.1341 g y%= 0.9917
![]() 杂质含量1-99.17% = 0.83%
杂质含量1-99.17% = 0.83%
|
(4)2HClO → 2HCl + O2↑,剧烈振荡增加分子间碰撞的机会,促进HClO的分解。
(5)由于2Cl2 → 2HClO→O2;2Cl2 →O2;若HClO全部分解可产生O2约2.5 mL。 2.5 mL的氧气,要能检验出来,最好能找1个略大于2.5 mL的小试管粗细的容器,用注射器将氧气推入小容器中,立即将带余烬的卫生香插入,用这种方法检验氧气的存在成功率比较高。 (6)可利用注射器内的Cl2试验卤素的活动性,写出适当的步骤、现象和结论。如果是用来做氢爆鸣、氯气跟金属的反应,请注意反应具体步骤的可行性,并防止氯气的逸出。实验结束,将多余的氯气通入Ca(OH)2溶液(或NaOH溶液)中。