第十二章 化学反应速率 化学平衡
一、考纲要求
1.了解化学反应速率的概念,反应速率的表示方法,外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
2.了解化学反应的可逆性,理解化学平衡的含义,掌握化学平衡与反应速率之间的内在联系。
3.理解勒沙特列原理的涵义,掌握浓度、温度、压强等条件对化学平衡移动的影响。
二、知识结构
1.化学反应速率的表示方法及特点。
(1)表示方法:
用单位时间内反应物浓度的减少或者生成物浓度的增加来表示。
表达式:![]() =
=![]()
单位:由浓度的单位和时间的单位决定。mol/L·h、mol/L、min、mol/L·S等。
(2)特点:
①化学反应速率是平均速率,且均取正值。
②同一反应选用不同物质浓度的改变量表示速率,数值可能不同,但表示的意义相同。
③各物质表示的速率比等于该反应方程式的系数比。
例:对于反应:mA+nB![]() pC+qD
pC+qD
VA∶VB∶VC∶VD=m∶n∶p∶q
2.影响化学反应速率的因素。
决定化学反应速率的主要因素是反应物的结构,性质,反应历程。除此之外,外部条件,为反应物的浓度、压强、温度、催化剂以及固体反应物表面积的大小、溶剂、光、电磁波、激光、超声波等都会影响化学反应的速率。
(1)浓度:在其它条件不变时,增大反应物浓度,化学反应速率加快;反之则反。
注意:固体,纯液体的浓度均可视作常数。因固体物质间的反应只与接触面积有关,故固体物质的量的改变对反应速率无影响。
(2)压强:在其它条件不变时,增大气体反应体系压强,化学反应速率加快;反之则反。
注意:改变压强,对化学反应速率产生影响的根本原因是引起浓度改变。所以,在讨论压强对反应速率的影响时,应区分引起压强改变的原因。
对于气体反应体系,有以下几种情况:
①恒温时:增加压强![]() 体积缩小
体积缩小![]() 浓度增大
浓度增大![]() 应速率加快。
应速率加快。
②恒容时:
a.充入气体反应物![]() 浓度增大
浓度增大![]() 总压增大
总压增大![]() 反应速率加快。
反应速率加快。
b.充入“惰气” ![]() 总压增大,但各物质浓度不变,反应速率不变。
总压增大,但各物质浓度不变,反应速率不变。
③恒压时:充入“惰气” ![]() 体积增大
体积增大![]() 各反应物浓度减少
各反应物浓度减少![]() 反应速率减慢。
反应速率减慢。
(3)温度:其它条件不变时,升高温度,反应速率加快。
温度每升高10℃,化学反应速率增大到原来的2—4倍。升高反应体系的温度,是提高反应速率的有效途径。
(4)催化剂:使用正催化剂,能加快化学反应速率。反之则反,未特殊指明时,均指正催化剂。3.化学平衡状态
(1)概念:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的质量分数保持不变的状态。
(1) 特征
①逆:研究对象可逆反应。
②等:V(正)=V(逆)≠O
③动:化学平衡是动态平衡。虽然V(正)=V(逆),但正、逆反应仍在进行,其反应速率不等于零。
④定:各组分的质量分数一定。
⑤变:外界条件改变,平衡也随之改变。
⑥无:化学平衡的建立与反应从哪个方向(正向、逆向、双向)开始无关。
4.化学平衡移动
(1)当外界条件改变时,可逆反应从一种平衡状态向另一种平衡状态转化的过程。
(2)平衡发生移动的根本原因:V正、V逆发生改变,导致V正≠V逆。
(3)平衡发生移动的标志:新平衡与原平衡各物质的百分含量发生了变化。
注意:
①新平衡时:V′正≠V′逆,但与原平衡速率不等。
②新平衡时:各成分的百分含量不变,但与原平衡不同
③通过比较速率,可判断平衡移动方向
当V正>V逆时,平衡向正反应方向移动
当V正<V逆时,平衡向逆反应方向移动
当V正=V逆时,平衡不发生移动
5.可逆反应进行程度的描述方法——转化率、产率。
(1)反应物的转化率=反应物的转化量/该反应物起始量×100%
(2)产物的产率=产物的实际量/该产物的理论量×100%
6.外界条件对化学平衡的影响。
(1)浓度:其它条件不变时,增大反应物浓度或减小生成物浓度都会使平衡向正反应方向移 动。
改变物质浓度不包括固体和纯液体,即固体或纯液体物质的量的增加和减少,不影响浓度, 从而不影响化学反应速率,也不影响化学平衡。
(2)压强:其它条件不变时,增大压强,会使平衡向气体体积缩小的方向移动。
注意:
①若反应前后气体体积无变化,改变压强,能同时改变正、逆反应速率,V正=V逆,平衡不移动。
②压强变化是指平衡混合物体积变化而引起的总压变化,若平衡混合物的体积不变,而加入 “惰气”,虽然总压变化了,但平衡混合物的浓度仍不变,速率不变,平衡不移动。
③若加入“惰气”,保持总压不变,此时只有增大体系体积,这就相当于降低了平衡体系的 压强,平衡向气体体积增大的方向移动。
(3)温度:在其它条件不变时,升高温度,化学平衡向吸热反应方向移动。降低温度,平衡 向放热反应方向移动。
(4)催化剂:催化剂能同等程度地改变正、逆反应速率,因此不影响化学平衡,但可大大地 缩短反应达到平衡所需的时间。
(5)勒沙特列原理:如果改变影响平衡的一个条件,平衡就向能够减弱这种改变的方向移动 。注意:勒沙特列原理的适用范围是:化学平衡,电离平衡,溶解平衡,水解平衡,状态平衡等。
7.合成氨的反应原理:N2(g)+3H2(g)![]() 2NH3(g)+92.4KJ
2NH3(g)+92.4KJ
合成氨是一个气体体积缩小的放热可逆反应。
8.原料气的制备:
①空气中取氮:分离液态空气或用炽热的炭处理空气后再净化。
②水中取氢:水和焦炭反应。
9.合成氨适宜条件的选择。
①选择原则:能加快反应速率;提高原料的利用率;提高单位时间的产量;对设备条件要求不能太高。
②合成氨的适宜条件:使用催化剂;500℃;2×107~5×107Pa。
10.合成氨的简要流程
原料气的制备![]() 净化
净化![]() 压缩
压缩![]() 合成
合成![]() 分离
分离![]() 液氨
液氨
三、知识点、能力点提示

四、能力训练
1.100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可问反应物中加入适量的( )
A.Na2SO4(s) B.H2O C.K2SO4溶液 D.(NH4)2SO4(s)
知识点:本题考查浓度对反应速率的影响
能力点:培养学生正确理解和应用能力
2.设C+CO2![]() 2CO-Q1,反应速率为V1;N2+3H2
2CO-Q1,反应速率为V1;N2+3H2![]() 2NH3+Q2,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
2NH3+Q2,反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为( )
A.同时增大 B.同时减少
C.V1增大,V2减小 D.V1减小,V2增大
知识点:本题考查温度对反应速率的影响
能力点:培养学生理解能力
3.某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后,[X2]为0.4mol/L,[Y2]为0.8mol/L,生成的Z为0.4mol/L,则该反应式是( )
A.X2+2Y2![]() 2XY2
B.2X2+Y2
2XY2
B.2X2+Y2![]() 2X2Y
2X2Y
C.3X2+Y2![]() 2X2Y
D.X2+3Y2
2X2Y
D.X2+3Y2![]() 2XY3
2XY3
知识点:本题考查用不同物质表示化学反应速率时,速率比等于系数比这一知识
 能力点:
培养学生理解能力
能力点:
培养学生理解能力
4.右图为装有活塞的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标 准状况下测定),保持温度压强不变,则容器内的密度( )
A.等于1.369 g·L-1
B.等于2.054 g·L-1
C.在1.369g·L-1和2.054g·L-1
D.大于2.054g·L-1
知识点:本题考查气体密度的计算及2NO2![]() N2O4平衡
N2O4平衡
能力点:培养学生计算 能力和综合思维能力
5.下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强
C.升高温度 D.使用催化剂
知识点:本题考查外界条件对化学反应速率的影响
能力点:培养学生思维能力
6.将固体NH4I置于密闭容器中,在某温度下发生下列反应:( )
NH4I(固) ![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g) ![]() H2(g)+I2(g),当达到平衡时 ,[H2]=0.5mol/L,[HI]=4mol/L,则NH3的浓度为
H2(g)+I2(g),当达到平衡时 ,[H2]=0.5mol/L,[HI]=4mol/L,则NH3的浓度为
A.3.5mol/L B.4mol/L C.4.5mol/L D.5mol/L
知识点:本题考查关于化学平衡的有关计算
能力点:培养学生计算能力和理解能力
7.在一密闭容器中进行下列反应:2SO2+O2![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是( )
A.SO2为0.4mol/L,O2为0.2mol/L
B.SO2为0.25mol/L
C.SO2,SO3均为0.15mol/L
D.SO3为0.4mol/L
知识点:本题考查关于化学平衡的有关计算
能力点:培养学生综合思维能力
8.下列哪种说法可以证明N2+3H2![]() 2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
A.1个N≡N键断裂的同时,有3个H—H键形成。
B.1个N≡N键断裂的同时,有3个H—H键断裂。
C.1个N≡N键断裂的同时,有6个H—H键断裂。
D.1个N≡N键断裂的同时,有6个H—H键形成。
知识点:本题考查可逆反应达到平衡状态的特征之一:V正=V逆
能力点:培养学生理解能力
9.下列说法正确的是( )
A.可逆反应的特征是正反应速率总是和逆反应速率相等。
B.在其它条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态。
C.在其它条件不变时,升高温度可以使化学平衡向吸热反应的方向移动。
D.在其它条件不变时,增大压强一定会破坏气体反应的平衡状态。
知识点:本题考查外界条件对化学平衡的影响
能力点:培养学生理解能力
10.可逆反应:3A(g) ![]() 3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)-Q,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A.B和C可能均是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
知识点:本题考查温度对化学平衡的影响及平均分子质量的有关知识
能力点:培养学生综合思维能力
11.某体积可变的密闭容器,盛有质量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C,若维持温度和压强不变当达到平衡时,容器的体积为VL,其中C的气体体积占10%,下列推断正确的是( )
2C,若维持温度和压强不变当达到平衡时,容器的体积为VL,其中C的气体体积占10%,下列推断正确的是( )
①原混合气体的体积为1.2VL
②原混合气体的体积为1.1VL
③反应达到平衡时气体A消耗掉0.05VL
④反应达到平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
知识点:本题考查有关平衡的计算
能力点:培养学生计算能力
12.在一密闭容器中,用等物质的量的A和B发生如下反应:
A(g)+2B(g) ![]() 2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的 量相等,则这时A的转化率为:(
)
2C(g),反应达到平衡时,若混合气体A和B的物质的量之和与C的物质的 量相等,则这时A的转化率为:(
)
A.40% B.50% C.60% D.70%
 知识点:本题考查有关化学平衡及其转化率的相关计算
知识点:本题考查有关化学平衡及其转化率的相关计算
能力点:培养学生计算能力
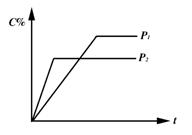
13.对于达到平衡的反应:2A(g)+B(g)〖FYKN〗nC(g),符合右图所示的结论是( )
A.P1>P2,n>3 B.P1>P2,n<3
C.P1<P2,n>3 D.P1<P2,n<3
知识点:本题考查外界条件对化学平衡的影响
能力点:培养学生正确识图能力
14.勒沙特列原理适用于( )
A.整个动态平衡 B.仅仅是平衡时的化学反应
C.一切化学反应 D.非动态平衡系统
知识点:本题考查勒沙特列原理的适用范围
能力点:培养学生理解、记忆能力
15.反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
知识点:本题考查化学反应速度的表示方法。
能力点:培养学生理解能力。
16.某温度下,在1L密闭容器中反应N2+3H2![]() 2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
2NH3达到平衡。当N2、H2、NH3的初始加入的物质的量分别为X=1mol,Y=3mol,Z=0mol,达平衡时这三种气体的物
质的量分别为A、B、Cmol,只改变初始物质的加入量,而要求A、B、C总量维持不变,请填
写下列各空。
(1)若X=0,Y=0,Z= 。
(2)若X=0.75,Y= ,Z= 。
(3)X、Y、Z应该满足的一般条件(用两个联立方程表示) 或 。
知识点:本题是一道关于化学平衡的综合试题,涉及到等效平衡,元素守恒及化学平衡的有关计算。
能力点:考查学生综合思维能力。
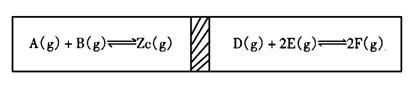 |
17.在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如下图所示的可逆 反应。各物质的起始加入量如下:A、B、C均为4.0mol,D为6.5mol,F为2.0mol。设E为Xmol。当X在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且 隔板恰好处于反应器的正中位置。请填写如下空白:
(1)若X=4.5时,则右侧反应在起始时间 (填“正反应”“逆 反应”)方向进行。欲使起始反应维持向该方向进行,则X的最大取值应小于 。
(1) 若X分别为4.5和5.0时,则在这两种情况下,为反应达平衡时,A的物质的量是否相等?
(填“相等”、“不相等”或“不能确定”)。其理由是 。
知识点:本题是一道信息试题,涉及到外界条件对化学平衡的影响及关于化学平衡的相关计 算。
能力点:培养学生自学能力、综合能力。
18.Fe3+和I-在水溶液中的反应如下:2I![]() +2Fe
+2Fe![]()
![]() 2Fe
2Fe![]() +I2(水溶液)。
+I2(水溶液)。
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后 ,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、 向左、不)。
(2)上述反应的正向反应速率和I![]() 、Fe
、Fe![]() 的浓度关系为:V=K[C(I-)]m[C (Fe
的浓度关系为:V=K[C(I-)]m[C (Fe![]() )]n(K为常数)
)]n(K为常数)
| C (I | C | V(mol/L·S) | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
通过所给的数据计算得知:在V=K[C(I-)]m[C(Fe3+)]n 中mn的值为 。
A.m=1 n=1 B.m=1 n=2
C.m=2 n=1 D.m=2 n=2
I-浓度对反应速率的影响 ,Fe3+浓度对反应速率的影响。(选填:大于、小于、等于)
知识点:本题是一信息试题。
能力点:培养学生自学能力,理解能力和应用能力。
参考答案
1.BC 2.A 3.C 4.D 5.CD 6.D 7.B 8.AC 9.BC 10.CD 11.A 12.A 13.C 14.A
15.④>③=②>①
16.①z=2 ②y=2.25 z=0.5③x+![]() =1 y+
=1 y+![]() Z=3 或x+y+2z=4 3x=y
Z=3 或x+y+2z=4 3x=y
17.①正反应 7.0
②不相等。因为两种情况是在两个不同温度下建立的化学平衡,平衡状态不同,所以物质的 量也不相同。
18.(1)[Fe2+]2[I2]向右 (2)C 大于