高三化学下学期期终考试试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分110分,考试时间为100分钟。
可能用到的相对原子质量:H:1 C:12 N14 O:16 Na:23 Cu:64
第I卷(选择题,共54分)
一、选择题(本大题有18小题 ,每小题3分,共54分。每题只有一个答案。)
1.加酶洗衣粉可洗去衣物上的汗渍、油渍和血迹,因而深受人们的喜爱。下列衣料中不能用加酶洗衣粉洗涤的是:①人造丝织物 ②蚕丝织物 ③涤纶织物 ④羊绒织物 ⑤维纶织物 ⑥棉麻织物
A.①③⑤ B.②③⑤ C.②④ D.②④⑥
2.科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种新微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中一定正确的是
A.是氢的一种新的同素异形体
B.是氢的一种新的同位素
C.它的组成可用H3表示
D.它比一个普通H2分子多一个氢原子核
3.钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为
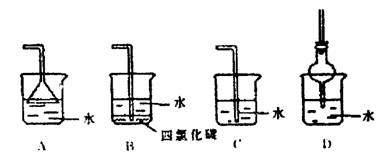
A.4H++ 4e-= 2H2↑ B.2H2O+O2+ 4e一 =4OH-
C.2Fe一 4e- =2Fe2+ D.4OH一—4e一=2H2O+O2↑
4.某溶液中含有 HCO3一、SO32一、CO32一、CH3COO一等 4种阴离子。向其中加入足量的 Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液体积无变化)
A.CH3COO一 B.SO32一 C.CO32一 D.HCO3一
5.下列物质发生变化,因反应条件或反应物的用量不同,能够得到不同生成物的是 ① Na和 O2 ②C2H5OH和浓 H2SO4 ③Ca3(PO4)2和 H2SO4 ④AlCl3和 NaOH ⑤Cu和HNO3
A.①③ B.①④⑤ C.除②③外 D.全部
6.下列反应的离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应 Ba2++SO42— = BaSO4↓
B.在氯化铝溶液中加入过量的氨水 Al3++3NH3·H2O = Al(OH)3↓+3NH4+
C.碳酸氢钠溶液中加入过量石灰水 HCO3-+OH-=CO32-+H2O
D.石灰石溶于醋酸 CaCO3+2H+ =
Ca2++CO2↑+H2O
7、下列各组离子,在强碱性溶液中可以大量共存的是.
A.K+ Na+ HSO-3 Cl- B.Na+ Ba2+ AlO-2 NO-3
C.NH+4 K+ Cl- NO-3 D.K+ Na+ ClO- S2-
8.室温下,Va LpH=a 的 HCl 溶液可恰好中和Vb LpH=b 的 Ba(OH)2 溶液,若 a+b=15, a+b=14, a+b=13,则 Va 与Vb 的比值应分别为
A.10,1/10,1 B.100,10,1 C.10,1,1/10 D.1,10,100
9.欲使CH3COONa稀溶液中c(CH3COO-)/c(Na+)的比值增大,可在溶液中(恒温)加少量的_
A.固体NaOH B.固体KOH_ C.固体CH3COONa D.固体NaHSO4
10.用pH值相同的盐酸和醋酸溶液分别跟锌反应,若最后锌都已完全溶解,但放出的气体一样多,则下列判断正确的是
① 整个反应阶段平均速率:醋酸>盐酸 ② 反应所需时间:醋酸>盐酸
③ 参加反应的锌的质量:盐酸=醋酸 ④ 开始反应速度:盐酸>醋酸
A、①、② B、①、③ C、②、③ D、②、④
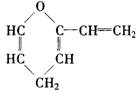 11.某有机物的结构简式为
它的同分异构体中含有羟
11.某有机物的结构简式为
它的同分异构体中含有羟
基(—OH)的芳香族化合物共有
A.3种 B.4种 C.5种 D.6种
12.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,他可由冰醋酸与过氧化氢在一定条件下制得;他可以迅速杀灭多种微生物,包括多种病毒(如:SARS 病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
13.判断物质在不同溶剂中的溶解性时,有一条经验规则;“极性分子组成的溶剂易于溶解极性分子组成的溶质;非极性分子组成的溶剂易于溶解非极性分子组成的溶质。”下列装置中,不适宜用作HCl气体尾气吸收的是
14.若发现114号元素X,它的最外层电子排布与碳相同,比碳多5个电子层,则下列叙述正确的是
A.X有稳定的气态氢化物 B.X应为非金属元素
C.X的最高价氧化物为XO2 D.X的低价氧化物是酸性氧化物
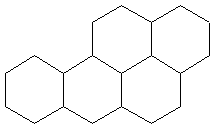 15.苯并[a]芘是一种稠环芳香烃(它的分子
15.苯并[a]芘是一种稠环芳香烃(它的分子
是研究致癌效应的参照标准),其结构式中有5个
环互相并合如图。每个碳原子上都有一个双键(C=
C),分子中共有m个双键,五个环都处于同一平
面上,分子中可能同时处于一个平面上的原子数
为n个,则m、n分别等于
A.10、30 B.10、32
C.11、30 D.11、32
16.常温下将甲酸和NaOH溶液积混合,所得溶液PH=7,则溶液中:
A. C(Na+)>C(HCOO-) B. C(Na+)<C(HCOO-)
C. C(Na+)=C(HCOO-) D.无法确定C(Na+)和C(HCOO-)的关系
17.下列说法正确的是
①、分子中都存在共价键。②、 23592U→20782Pb + 2010Ne + 810n属于化学变化。③质子数相等,电子数也相等的两种微粒可能是不同的离子。④把铜片和铝片紧靠在一起浸入稀硫酸中,铜片表面出现气泡。⑤把铜片插入三氯化铁溶液中,在铜片表面一层铁。⑥实验室制H2,把锌粒加入稀硫酸中,再加几滴硫酸铜溶液,气泡放出速率加快
A、③④⑤⑥ B、③④⑥ C、①③⑥ D、①②④⑥
18、1.92g铜投入一定量的浓HNO3中,铜完全溶解,共收集到672mL气体(标况)。将盛有此 气体的容器倒扣在水中,通入一定量的O2(标况),恰好使气体完全溶于水中,则通入O2 的体积是
A.504mL B.168mL C.336mL D.224mL
第II卷(非选择题,共56分)
二、填空与简答(本大题有6小题 ,共44分)
19.( 8 分) 某书本查得相对原子质量数据摘录如下:
(1)某书本查得相对原子质量数据摘录如下:
①34.969表示 ②35表示
③35.453表示 ④得35.485的计算式是_____________
20.( 4分) 三硅酸镁是一种胃病患者常用的制酸剂,该物质难溶于水,服用后能中和过多的胃酸。把三硅酸镁的化学式 Mg2 Si3O8·n H2O改写成氧化物的形式 ,写出它中和胃酸(主要是HCl)的化学方程式
。
21.( 6分)在2升的固定容积的密闭容器中进行如下反应:_mA(气)+nB(气) ![]() pC(气),若起始加入1mol A气体,2mol B气体,10s时达到平衡发现C的浓度为0.25mol/L,则_①、10s内的平均速度:V(A)=
pC(气),若起始加入1mol A气体,2mol B气体,10s时达到平衡发现C的浓度为0.25mol/L,则_①、10s内的平均速度:V(A)=
_②、达平衡时B的转化率为 。③若在平衡后再向容器中注入1mol A气体和2mol B气体,维持温度不变达新平衡时混合气体中B的体积分数增大,则m+n p (a、> b、= c、< d、> = <均可)。
22.( 4 分)在标准状况下,将 15.6 mL某氮的氧化物 NxOy与过量的氢气混合后反应生成氮气和水,若仍恢复至标准状况时,测得剩余气体的体积比原来缩小了46.8mL,通过计算确定该氧化物的分子式 。
23.(10分)PMAA是一种“智能型”有机高分子化合的,可应用于生物制药中大分子和小分子的分离。可以用下面的设计方案合成:
|
|
|
|
|
|
|
|
|
|
|
|
![]() R1
R1
已知:R2—C—OH 中羟基不能被氧化成相应的醛基或羧基。(R1、、R2、R3
R3
是相同或不同的烃基)
请填写下列空白:
(1) 写出A、G的结构简式:A:______________ ,G:___________ 。
(2)①②③④反应中属于取代反应的有_______________ 。
![]() (3)写出C D的化学方程式:
(3)写出C D的化学方程式:
____________________________________________ 。
(4)C与F在浓硫酸存在和加热条件下能够充分反应,此反应的反应类型是___________ ,1molC最多能与______________(填物质的量)F完全反应。
24.(12分)已知常温常压下CO2在水中的溶解度不大,CO2与NaOH溶液反应时没有明显现象,某研究小组同学,设计了下图A—E五套装置,欲利用这些装置,能通过观察现象,间接证明CO2与NaOH溶液发生了反应。
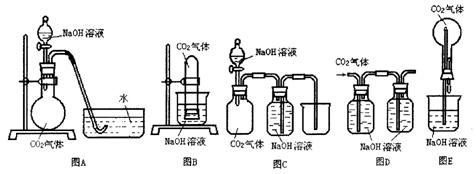
请选择以上实验装置,同时指出操作方法和观察到的实验现象,将答案填入下表:(表中已有一个示例)
| 所选装置 | 操作方法 | 实验现象 |
| B | 将充有CO2试管的橡皮塞打开 | 水槽中NaOH溶液上升到试管中 |
三、计算题(12分)
25. 分别取等物质的量浓度的氢氧化钠溶液 各100mL,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A.B两种情况):
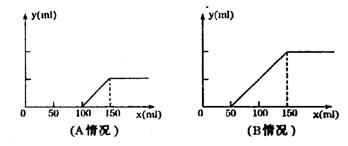
(1)在A情况下,溶质是(填化学式) ,其物质的量之比为_______________。
(2)在B情况下,溶质是(填化学式) ,其物质的量之比为_______________。
(3)在A、B两种情况下产生CO2的最大体积各为 mL和_____________mL
(4)原氢氧化钠溶液的物质的量浓度为:______________________。
高三化学参考答案
一、选择题(每小题3分,共54分)
1、C 2、D 3、B 4、A 5、D 6、B 7、B
8、C 9、B 10、B
11、B 12、A 13、C 14、C 15、B 16、C 17、B 18、C
二、填空与简答(44分)
19、(8分)① 35Cl的原子量 ② 35Cl的质量数(或近似原子量)
③Cl元素的(平均)原子量 ④35×75.77% +37×24.33%
20、(4分)2Mg0.3SiO2·nH2O
Mg2Si3O8·nH2O + 4HCl = 2MgCl2 + 3H4SiO4↓+(n-4)H2O
21、(6分)① ![]() ×0.025mol/L ②
×0.025mol/L ② ![]() ×100%或
×100%或
![]() % ③C
% ③C
22、(4分)N2O3
23、(10分)
CH3 CH3
![]()
![]()
![]()
![]()
![]()
![]()
![]() (1) CH3—C = CH2
CH2— C n
(2)②
(1) CH3—C = CH2
CH2— C n
(2)②
COOH
![]()
![]()
![]() CH3
CH3
CH3
CH3
(3)2CH3—C—CH2OH+O2 ![]() 2CH3—C—CHO+2H2O
2CH3—C—CHO+2H2O
![]()
![]()
OH OH
(4)取代(酯化) 2mol
24、(12分)
A、将分液漏斗旋塞打开,放出部分NaOH溶液;导管中水倒吸进入烧瓶
C、将分液漏斗旋塞打开,放出部分NaOH溶液;导管中有气泡产生
D、通入CO2气体; 左瓶导管中气泡多于右瓶
E、将胶头滴管中液体挤出; 烧瓶中产生喷泉
三、计算题(12分)
25、(1)Na2CO3 NaOH n(Na2CO3)∶n(NaOH)=1∶1
(2)Na2CO3 NaHCO3 n(Na2CO3)∶n(NaHCO3)=1∶1
(3)224ml 448ml
(4)1.5mol/L