高三化学专题检测
化学实验
(时间100min,总分120分)
一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意。)
1.下列除去杂质的方法正确的是
(A) 除去N2中的少量O2:通过灼热的CuO粉末,收集气体
(B) 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
(C) 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
(D) 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
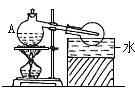
2.实验室制取并收集硝酸可用下图装置,其中仪器A为曲颈甑,颈管特别长。在曲颈甑内装入20g硝酸钠和20ml浓硫酸,小火加热之,随即有硝酸蒸气冷凝而成的液体出现。这个装置还可制取并收集下列哪些物质
(A)氯气 (B)二氧化碳
(C)氧气 (D)乙酸乙酯
3.下列各组物质在只提供水和若干支试管的情况下,达不到鉴别目的是
(A)硝基苯、苯、乙醇三种液体
(B)硫黄、Na2O2、CaCl2三种固体
(C)H3PO4、Ba(OH)2、Ba3(PO4)2三种固体
(D)Na2SO4、KNO3、BaCl2三种固体
4.下列试剂的贮存方法错误的是
(A)苯用带橡胶塞的试剂瓶贮存
(B)浓硝酸存放在棕色试剂瓶中
(C)少量白磷存放在水中
(D)少量金属钠存放在煤油中
5.下列实验中用错试剂的是
(A)用稀盐酸清洗做焰色反应的镍铬丝
(B)用酒精萃取碘水中的碘
(C)用稀硝酸洗去残留在试管壁上的铜
(D)用碱石灰吸收氨气中的水蒸气
6.下图分别表示四种操作,其中有两个错误的是
7.有一瓶96-98.3%的浓H2SO4,欲测定它的浓度值,可采用的有效方法是
(A)用pH试纸测其pH (B)用比重计测出其密度
(C)用电导仪测其导电性 (D)观察其粘稠程度
8.下列实验不能先用蒸馏水润湿试纸的是
(A)用品红试纸检验SO2
(B)用淀粉碘化钾试纸检验Cl2
(C)用红色石蕊纸检验NH3
(D)用pH试纸测定某溶液的pH值
二、选择题(本题包括12小题,每小题3分,共36分。有1~2个正确答案)
9.对下列定量实验中的基本操作和仪器的描述正确的是
(A)用托盘天平称取0.5molNaOH固体20.0g;
(B)将用水润湿的pH试纸,浸入稀盐酸溶液,测定溶液的pH值;
(C)滴定管的0刻度线在上部,而量筒的0刻度在下部;
 (D)在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时无须再加入蒸馏水使其液面与刻度持平
(D)在配制一定物质的量浓度的溶液时,定容后,经摇匀发现液面低于刻度线,此时无须再加入蒸馏水使其液面与刻度持平
10.用下图所示装置进行实验,表中所叙述的结论正确的是
| 甲 | 乙 | 丙 | 结论 |
| (A)盐酸 | 石灰石 | 苯酚钠 溶 液 | 酸性 HCl>H2CO3>苯酚 |
| (B)盐酸 | FeS | 溴水 | 还原性: S2->Br->Cl- |
| (C)浓盐酸 | KmnO4 | KBr溶液 | 氧化性: KmnO4>Cl2>Br2 |
| (D)水 | 电石 | 溴水 | 稳定性: 水>C2H2>Br2 |
11.下列各组混合物的分离或提纯方法不正确的是
(A)用过滤法分离Fe(OH)3胶体和FeCl3溶液的混合物
(B)用结晶法提纯NaCl和KNO3的混合物中的KNO3
(C)用蒸馏法分离乙醇和苯酚的混合物
(D)用加热法分离碘和氯化铵的混合物
12.下列各组溶液,不用其他试剂,只需两两混合就可以将它们区别开来的是
(A)硝酸银、氯化钠、硫化钾、溴化钾
(B)氯化钾、氯化钙、硫酸钠、硝酸钾
(C)氢氧化钠、氯化铵、硝酸钾、盐酸
(D)氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
13.下列说法正确的是(填写标号)
(A)配制0.1mol/L的NaCl溶液250mL,只需用以下仪器即可完成:托盘天平(带砝码)、烧杯、玻璃棒、250mL的容量瓶、胶头滴管
(B)快速配制室温时的NaCl饱和溶液不必使用温度计、溶解度表
(C)硅酸钠溶液可以保存在滴瓶中
(D)中和滴定时,眼睛必须注意:①滴定管中液面的变化,②锥形瓶内指示剂颜色的变化,③滴定管下端的液体流速
14.下列实验能够达到预期目的是
(A)用25mL量筒量取2.0mL稀H2SO4
(B)用碱式滴定管量取18.5mL 1mol/L的Na0H溶液
(C)用托盘天平称量50.56克KCl
(D)用50mL酸式滴定管量取25mL稀盐酸的操作是:将盐酸注入酸式滴定管,其凹液面正好与25mL刻度相切,将溶液全部放入烧杯中,可准确量取25mL稀盐酸。
15.为了检验某溶液中是否含有SO42-,下列操作最合理的是
(A)加入用HNO3酸化的Ba(NO3)2溶液
(B)用HNO3酸化,再加Ba(NO3)2溶液
(C)先用盐酸酸化,再加BaCl2溶液
(D)直接加入盐酸酸化的BaCl2溶液
16.下列实验中所选用的仪器合理的是
(A)用200mL量筒量取5.2mL稀硫酸
(B)用100mL烧杯配制100g质量分数为1%的食盐水
(C)用托盘天平称量11.7g氯化钠固体
(D)用酸式滴定管量取25.12mL某高锰酸钾溶液
(E)用瓷坩锅灼烧各种钠的化合物
17.下列配制溶液的操作能引起浓度偏高的是:
(A)1g98%的浓H2SO4加4g水中配制1∶4H2SO4溶液
(B)在100mL无水乙醇中,加入2g甲醛配制2%的甲醛的酒精溶液
(C)在80mL水中加入18.4mol/L硫酸溶液20mL,配制3.68mol/L稀H2SO4
(D)配制一定物质的量浓度的硫酸时,最后在容量瓶中加水稀释到标线,塞好塞子摇匀后,发现液面低于标线
18.为了除去粗盐中的Ca2+、Mg2+、SO![]() 及泥沙等,将粗盐溶于水,然后进行下列5项操作①过滤②加入过量NaOH溶液③加入适量盐酸④加入过量Na2CO3溶液 ⑤加入过量的BaCl2溶液,正确的操作顺序是
及泥沙等,将粗盐溶于水,然后进行下列5项操作①过滤②加入过量NaOH溶液③加入适量盐酸④加入过量Na2CO3溶液 ⑤加入过量的BaCl2溶液,正确的操作顺序是
(A)①④②⑤③ (B)②⑤④①③
(C)④①②⑤③ (D)⑤②④①③
19.实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:
①逐滴加入稀盐酸,调pH值为5;
②煮沸;
③加蒸馏水溶解;
④加热至不再产生气味为止;
⑤加入稍过量的Na2CO3溶液;
⑥加入稍过量的BaCl2溶液;
⑦过滤。
上述实验操作的正确顺序应是
(A)①②⑤⑥⑦③④ (B)③④⑥⑤⑦①②
(C)④③⑥⑤⑦①② (D)④③⑤⑥⑦②①
20.欲用试剂Y来检验物质X是否发生变质,下列X和Y的组合中不正确的是
| A | B | C | D | |
| X | FeSO4 | KI | Na2SO3 | 白磷 |
| Y | KSCN | 淀粉 | BaCl2 | 紫色石蕊试液 |
三、填空题(本题包括5个题。共68分)
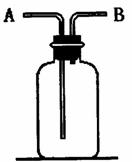 21.(12分)右图所示装置有多种用途,请回答下列问题:
21.(12分)右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛
(2)检验:证明CO中混有CO2,装置内应盛
(3)集气:若用排空气法收集比空气轻的气体时,气体应从装置的
端通人(填A或B,下同);若收集比空气重的气体,则气体从 端通人。若用排水法收集O2时,瓶内应先装满水,气体从 端通人。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应
从 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从
端通入。
22.(15分)纯碱中常含有少量的NaCl等杂质,利用下图仪器装置可用于测定纯碱中Na2CO3的质量百分含量(即质量分数)。
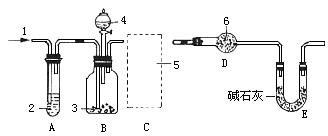
图中:1.空气 2.某溶液 3.纯碱 4.稀H2SO4 6.碱石灰
其实验步骤是:
a.按上图所示,组装好实验仪器,并检查其气密性;
b.准确称量盛有碱石灰的干燥管D的质量(设为m 1 g);
c.准确称量一定量的纯碱(设为ng),并将其放进广口瓶内;
d.从分液漏斗中缓缓滴入一定量稀硫酸,并从“1”处缓缓鼓入空气,至B反应器中不再产生气体为止;
e.准确称量干燥管D的总质量(设m 2 g)。
根据上述实验,回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,鼓入空气的作用是 。装置A中盛装的液体“2”应选用_ ;装置A的作用是 ;如果撤去装置A,直接向装置B中缓缓鼓入空气,则会导致实验测定结果 (填偏大、偏小或不变)。
(2)在空白格内画出装置C及试剂;装置C盛放的试剂“5”是 ;说明装置C的作用是 ;如果撤去装置C,则会导致实验测定结果 (填偏大、偏小或不变)。
(3)根据此实验,计算纯碱中Na2CO3的质量百分含量(即质量分数)的数学式为 。(用m1、m2、n表示)
(4)装置E的作用是 。
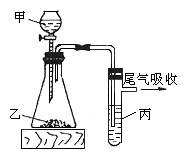
23.(13分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置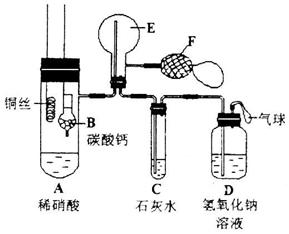 如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的为 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 。
装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧并E内气体颜色加深,产生上述现象的原因是 。一段时间后,C中白色沉淀溶解,其原因 。
(3)装置D的作用是 。
24.(15分)图是一个制取氯气并以氯气为原料进行特定反应的装置:
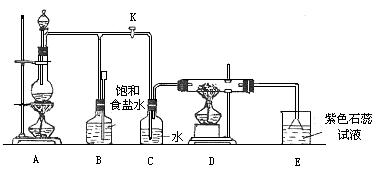
(1)A是氯气发生装置,其中的化学反应方程为
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式: 。装置C的作用是 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是 。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为 。
(选填标号)
(A)有白色沉淀生成 (B)无现象
(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,B的作用是 。
25.(13分)下图A—J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质。已知A—E和F—J中分别含有同一种元素。反应E→A+O2的条件未标出。
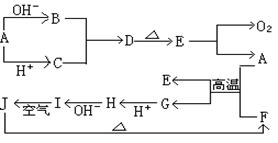
请填写下列空白:
(1)化合物H中的阳离子_______;D的化学式___________。
(2)A生成B反应的离子方程式是______________________________________。
(3)A和F的混合物叫做___________,发生反应的化学方程式是
_________________________________________________________________。
(4)I→J反应的化学方程式是___________________________________________。
该反应过程中发生的现象是_________________________________________。
高三化学专题检测:化学实验答案
一、选择题
1.D 2.D 3.D 4.A 5.B 6.B 7.B 8.D
二、选择题
9.AD 10.AC 11.AD 12.AD 13.B 14.B 15.A 16.CD 17.BC 18.BD 19.C 20.C
21.(1)浓H2SO4(2)澄清石灰水(3)B;A。B。(4)A (5)B
22.(1)把反应器B中产生的CO2气体送入干燥管D中;NaOH溶液;除去空气中的CO2;偏大
(2)浓硫酸;干燥CO2(吸水);偏大。
(3)![]()
(4)防止空气中水蒸汽、二氧化碳气进入干燥管D。
22.(1)用碳酸钙与稀硝酸反应产生的二氧化碳气赶走装置内的空气;
(2)3Cu+8HNO3![]() 3Cu(NO3)2+2NO2↑+4H2O;
3Cu(NO3)2+2NO2↑+4H2O;
CO2比空气重,从长管进入E,并没有把E中空气赶尽,致使部分NO先与未赶尽的空气生成少量红棕色NO2,当再从F鼓入空气时,E中有更多NO2生成,所以红棕色加深;
二氧化氮与水反应有硝酸生成,硝酸与碳酸钙反应使沉淀溶解;
(3)吸收NO、NO2、CO2尾气,防止污染大气。
②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2
23.(1)4HCl+MnO2![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)2Cl2+2H2O(气)+C![]() 4HCl↑+CO2↑吸收Cl2中的HCl气体,提供D处所需水蒸气。
4HCl↑+CO2↑吸收Cl2中的HCl气体,提供D处所需水蒸气。
(3)生成的HCl气体使紫色石蕊溶液变红,因未反应完的Cl2与H2O作用产生的HClO的漂白作用使红色消失。
(4)B
(5)瓶中液面下降,长颈漏斗内液面上升,贮存少量Cl2。
24.⑴、Fe2+ ;Al(OH)3
⑵、2Al+2OH-+2H2O===2AlO2_+3H2↑
⑶、铝热剂 (1分);2Al+ Fe2O3===2Fe+ Al2O3
⑷、4Fe(OH)2+ O2 +2H2O === 4Fe(OH)3
白色絮状沉淀变为灰绿色,最后变为红褐色沉淀。