高三化学综合测试 (一)
第Ⅰ卷(选择题共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是( )
A.NO B.CO C.O3 D.CCl2F2
2.美国在科索沃战场上投下了至少10 t贫铀弹。贫铀弹的主要成分是低放射性的铀238,它与制造原子弹的铀235属于( )
A.同素异形体 B.同位素 C.同分异构体 D.无法确定
3.下列各物质中,可用作潜水等供氧剂的是( )
A.Na2O B.H2O C.Na2O2 D.H2O2
4.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4。将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温耐磨材料,在工业上有广泛的应用。则氮化硅所属的晶体类型是( )
A.原子晶体 B.分子晶体 C.离子晶体 D.金属晶体
5.用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为( )
A.容量瓶 B.量筒 C.滴定管 D.以上均不对
6.人们在日常生活中,为了使菜变得味香可口,炒菜时加少许酒和醋。使菜变得味香可口的原因是( )
A.有盐类物质生成 B.有醇类物质生成
C.有酸类物质生成 D.有酯类物质生成
7.将氨水逐滴加入到稀盐酸中,使溶液呈中性,则此时( )
A.c(NH4+)>c(Clˉ) B.c(NH4+)=c(Clˉ)
C.c(NH4+)<c(Clˉ) D. c(NH4+)与c(Clˉ)之间关系不确定
O
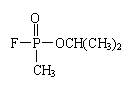
8.毒气沙林的主要成分甲氟磷酸异丙酯(结构为 ) ,消除环境中的沙林毒气最好喷洒 ( )
A.食盐水 B.酒精 C.稀盐酸 D.肥皂水
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分,若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.用石墨棒作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极 析出物质的质量为( )
A.35.5 g B.32 g C.16 g D.64 g
10.下列有关硼元素的叙述中,正确的是( )
A.根据硼的相对原子质量为10.8,可判断,硼原子核内的中子数为6
B.在三氯化硼分子中,所有原子均达到8电子结构
C.硼元素与氢氧根结合的化合物是一种强碱
D.硼元素可以和氢元素结合成为氢化物
11.在某温度下,可逆反应mA(g)+nB(g) == pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
A.K的表达式为K=![]()
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物的浓度改变而改变
D.K越大,达到平衡时,反应进行的程度越大
12.在蒸发皿中加热蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到该物质固体的是( )
A.AlCl3 B.NH4HCO3 C.MgSO4 D.KMnO4
13.设NA表示阿伏加德罗常数。下列说法中正确的是( )
A.18 g水所含电子数为10NA B.48g臭氧中含有氧原子数为NA
C.同温同压下,相同体积的CO2和SO2所含氧原子数均为2NA
D.2.3 g金属钠由原子变成离子时失去电子数目为0.1NA
14.在100 mL HNO3和H2SO4的混合溶液中,其物质的量浓度分别是0.4 mol·L-1和
0.1 mol·L-1。向该溶液中加入1.92 g铜粉,加热待充分反应后,所得溶液中Cu2+的物质的量浓度为( )
A.0.225 mol·L-1 B.0.15 mol·L-1 C.0.35 mol·L-1 D.0.45 mol·L-1
15.日本的白川英树和美国的马克迪尔米德和艾伦·黑格尔,由于发现聚乙炔具有良好的导电性,而共同成为2000年诺贝尔化学奖得主。那么关于聚乙炔的以下叙述错误的是( )
A.单体为不饱和烃 B.聚乙炔的分子中只含有碳碳单键
C.聚乙炔的相对分子质量为26 D.聚乙炔中碳的质量分数为92.3%
16.下列离子方程式中,正确的是( )
A.亚硫酸氢钠与过量的氢氧化钡溶液混合HSO3ˉ+Ba2++OHˉ=BaSO3↓+H2O
B.碳酸氢钠水解HCO3ˉ+H2O == H3O++ CO32-
![]() C.氯气和水反应Cl2+
H2O =2H++Clˉ+ClOˉ
C.氯气和水反应Cl2+
H2O =2H++Clˉ+ClOˉ
D.用铂电极电解氯化镁溶液
17.下列实验方案合理的是( )
A.混有乙酸、乙醇杂质的乙酸乙酯用饱和碳酸钠溶液进行除杂
B.用加入氢氧化钠溶液的方法分离苯和苯酚的混合物
C.用点燃的方法除去二氧化碳中混有少量的一氧化碳
D.用热的氧化铜除去氮气中少量氧气
18.将一定量的钠、铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液。然后用1 mol·L-1的盐酸滴定至沉淀量最大时消耗盐酸40 mL。原合金中钠的质量为( )
A.0.23g B.0.69g C.0.46g D.0.92g
第Ⅱ卷(非选择题共78分)
三、(本题2小题,共19分)
19.(12分)设A、B、C代表三种元素。已知①A+和B—两种离子相差一个电子层;②C元素核内质子数比B元素原子核内质子数少9个;③B和C两元素可以形成4核42个电子的负一价阴离子。据此请填空:
⑴A元素是 B元素是 C元素是 (填元素符号);
⑵A元素的原子结构示意图 A2C的电子式 ;
⑶A的氧化物对应水化物的冷溶液与B单质反应的离子方程式 ;
⑷由A、B、C三种元素所形成60个电子的盐类化合物的化学式 。
20.(7分)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会变成黑色(PbS)。从而使油画的色彩变暗。若用H2O2来“清洗”,则可将PbS转变成白色的PbSO4而使油画“复原”。请填空:
⑴上述“清洗”反应的化学方程式 ;
⑵若有0.1 mol PbS参加化学反应,则在此反应中发生电子转移的电子为 mol。
四、(本题2小题,共20分)
21.(8分)有A、B两种有机液体的混合物,如果AB互溶且相互不发生化学反应,在常压下A的沸点为35℃,B的沸点为200℃,用 方法分离。提纯该混合物必不可少的玻璃仪器和用品是 。
22.(12分)工业制纯碱时第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶它的反应原理可用下面的方程式表示:NH3+CO2+H2O = NH4HCO3;
NH4HCO3+NaCl(饱和)= NaHCO3↓+NH4Cl,以上反应的总结果是放热反应。请设计一个实验,用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。可供选择的实验用品有:
6 mol·L-1盐酸、6 mol·L-1硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。
⑴画出实验装置示意图,在仪器旁自左至右分别用A、B、C……符号标明。
⑵请写出在图中用A、B、C……各玻璃仪器中盛放物质的化学式或名称A: ;
B: ;C: ……
⑶利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶。
五、(本题2小题,共20分)
23.(10分)有三种只含C、H、O的有机物A1、A2、A3,它们互为同分异构体。室温时,A1为气态,A2、A3为液态。分子中C与H的质量分数之和是73.3%,在催化剂(Cu、Ag等)存在下, A1不起反应,A2、A3分别氧化得到B2、B3。B2可以被新制Cu(OH)2氧化得到C2,而B3则不能。 请用计算推理,填写下列空白:
⑴写出下列物质的结构简式:A2: ;B3: ;
⑵写出下列反应的化学方程式
①B2![]() C2
;
C2
;
②A3+C2![]() 。
。
24.(10分)有机化合物X在一定条件下有如下图所示的转化:

|
试推断:
⑴ 写出X的结构简式 ;写出B的结构简式 。
⑵ 指出下列转化的有机反应类型:X→A属 反应,X→C属 反应。
⑶ 完成下列反应的化学方程式
① 生成B的反应方程式____________________________________________;
② 生成C的反应方程式____________________________________________。
六、(本题2小题,共19分)
25.(7分)将一种化学式为R(NO3)X·nH2O的硝酸盐晶体6.05 g溶于水配成500 mL溶液,用石墨作电极电解,当通过电流强度为5A,时间为16.05 min时,溶液中阳离子全部放电,且一极增重1.60 g(已知M(晶体)=242 g·mol-1,一个电子电量为1.6×10-19C)
⑴X= ;⑵R的相对原子质量为 ;⑶n= 。
26.(12分)某试剂厂生产化学试剂FeCl3·6H2O,国家规定其二级品含量不低于99.0%,三级品含量不低于98.0%,现称取0.500 g样品,将其溶于水向所得溶液中加少量盐酸使其酸化,并加入过量的KI溶液充分反应2Fe3++2I-=2Fe2++I2,最后用0.100 mol·L-1的Na2S2O3标准溶液滴定,Na2S2O3 与I2 反应的化学方程式I2+2Na2S2O3=2NaI+Na2S4O6,滴定达终点时用去18.17 mL,试通过计算说明此样品属于哪一级产品?
综合测试(一)参考答案
第Ⅰ卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | C | B | C | A | C | D | B | D | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | C | D | D | C | AD | A | BC | A | AB | D |
第Ⅱ卷
三、
19.
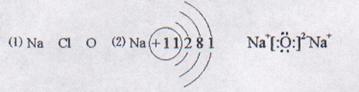
⑶ Cl2+2OH-=Cl-+ClO-+H2O ⑷ NaClO4
20.⑴ PbS+4H2O2=PbSO4+4H2O ⑵ 0.8
四、
21.分馏(蒸馏) 酒精灯 蒸馏烧瓶 温度计 冷凝管 锥形瓶 碎瓷片
22.⑴
⑵ A.CaCO3 6 mol·L-1盐酸 B.蒸馏水(饱和NaHCO3) C.冰水(冷水) D.氯化钠饱和浓氨溶液 E.6 mol·L-1H2SO4
⑶ 取少量产品放在试管中,在酒精灯上加热至不再有气体放出时,停止加热。试管中如有白色剩余物质,则得到产品不是碳酸氢铵。试管冷却后,向其中加入适量盐酸,反应激烈,冒出大量气泡,最后剩余物全部溶解,说明得到的结晶是碳酸氢钠。如果加入盐酸后,晶体全部溶解,但没有气泡产生,则得到的结晶可能是食盐。
23.⑴ A2 CH3CH2CH2OH B3 CH3COCH3
⑵ ① CH3CH2CHO+2Cu(OH)2![]() Cu2O↓+CH3CH2COOH+2H2O
Cu2O↓+CH3CH2COOH+2H2O
② CH3CH2COOH+(CH3)2CHOH![]() CH3CH2COOCH(CH3)2+H2O
CH3CH2COOCH(CH3)2+H2O
24.⑴X CH2(OH)CH2CH2COOH B CH3COOCH2CH2CH2COOH
⑵酯化(取代) 消去
⑶①CH3COOH+ CH2(OH)CH2CH2COOH
![]() CH3COOCH2CH2CH2COOH
+H2O
CH3COOCH2CH2CH2COOH
+H2O
②CH2(OH)CH2CH2COOH
![]() CH2=CH2CH2COOH+H2O
CH2=CH2CH2COOH+H2O
25. ⑴ 2 ⑵ 64 ⑶ 3
26. 设I2为x mol
由I2 + 2Na2S2O3 = 2NaI+Na2S4O6
1 2
x 0.100×0.01817mol
x=0.mol
设Fe3+为ymol
由2Fe3++2I-=2Fe2++I2
2 1
y 0.mol
y=0.001817mol
mFeCl3·6H2O=270.5g·mol-1×0.001817mol=0.4915g
ω(FeCl3·6H2O)%=0.4915g÷0.500g×100%=98.30%
属三级品![]()