高三化学综合测试(二)
第Ⅰ卷 选择题(共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是( )
A.K B.Ca C.Na D.Fe
2.据报道,某些建筑材料会产生放射性同位素氡![]() ,从而对人体产生伤害, 该同位素原子的中子数和质子数之差是( )
,从而对人体产生伤害, 该同位素原子的中子数和质子数之差是( )
A.36 B.50 C.86 D.222
3.用特殊方法把固体物质加工到纳米级(1~100 nm,1 nm=10-9 m)的超细粉末粒子,然后制得纳米材料。下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是( )
A.溶液 B.悬浊液 C.胶体 D.乳浊液
4.下列物质的水溶液能导电,但属于非电解质的是( )
A.食醋 B.氯气 C.碳酸氢铵 D.二氧化硫
5.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议 事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
6.只含有一种元素的物质( )
A.可能是纯净物也可能是混合物 B.可能是单质也可能是化合物
C.一定是纯净物 D.一定是一种单质
7.量筒和滴定管里所盛液体的凹面,皆在10 mL刻度,若均仰视液面,所得的读数前者与后者的关系( ).
A.大于 B.小于 C.等于 D.不能确定
8.我国规定食盐中含碘量(按每千克食盐含碘元素计)为20 mg/kg~40 mg/kg, 则每千克食盐中加入的碘酸钾物质的量应不少于( )(碘酸钾的摩尔质量为M g/mol)
A.(20×10-3/M)mol B.(20/M)mol
C.(20×10-3/127)mol D.(20/127)mol
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分。)
9.为减少汽车对城市大气的污染,1998年6月我国成功的开发了以新燃料做能源的“绿色汽车”,这种汽车可避免有机铅、苯、苯的同系物以及多硫化物的排放,保护环境,这种绿色汽车的燃料是
A.甲醇 B.汽油 C.柴油 D.重油
10.某种解热镇痛药的结构简式为 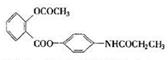 当它完全水解时,可得到的产物有( )
当它完全水解时,可得到的产物有( )
A.2种 B.3种 C.4种 D.5种
11.周期表中有些元素有“隔类相似”现象,即对角线规则,如Mg与Li;Si与B; Be与Al等性质相似。现用熔融LiCl 电解可得锂和氯气。若用已潮解的LiCl加热蒸干并加强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体,其理由是( )
A.电解出的锂与水反应放出氢气
B.电解前LiCl于加热时水解
C.电解时产生的气体是氧气
D.在高温时阳极放出的氯气与水作用释氧
12.吸进人体中的氧气,有20%转化为氧化性极强的活性氧副产物,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用含硒的化合物Na2SeO3清除体内的活性氧时,Na2SeO3的作用是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂
13.人体中的血红蛋白中应含有Fe2+,如误食亚硝酸盐,则导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是( )
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C将Fe3+转化为 Fe2+ D.亚硝酸盐被氧化
14.具有解热镇痛及抗生素作用的“芬必得”主要成分的结构式是:
![]()
,它属于( )
A.芳香族化合物 B.苯甲酸的同系物
C.易溶于水的有机物 D.易升华的物质
15. 某短跑运动员经化验其体液中Ca2+ 含量太低,比赛时因神经肌肉的兴奋性升高而出现抽搐,这一事实说明Ca2+的生物功能之一是( )
A.构成生物细胞的组成之一 B.维持生物细胞的正常形态
C.维持生物细胞的正常生理功能 D.调整渗透压和酸碱平衡
16.在陶瓷和陶瓷器皿的釉质中含有极微量的Pb、Cd、Sb 等有毒的金属类,为防止中毒,不能长期盛放下列物质中的( )
A.酱油 B.食醋 C.蔗糖 D.食盐
17.胆固醇是人体必需的生物活性物质,分子式为C25H45O, 一种胆固醇酯是液晶材料,分子式为C32H49O2,生成这种胆固醇酯的酸是( )
A.C6H13COOH B.C6H5COOH
C.C7H15COOH D.C6H5 CH2 COOH
第II卷(非选择题 共78分)
三、(本题包括2小题,共19分)
18.(6分)就氨的喷泉实验,回答下列问题:
(1)实验室欲快速制取大量氨气常用浓氨水加热,但当氨水浓度低于20%时,常向氨水中加入NaOH固体,此时仍能快速制取大量的氨气,其原因是:____________________;
(2)做完喷泉实验,在烧瓶内得到了氨水,为准确测定此氨水的物质的量浓度,可采用中和滴定的方法,中和滴定时,宜选用_________做指示剂。现有三种规格的锥形瓶:
A—50 mL 、 B—150 mL 、 C—500 mL, 若取20.00 mL氨水,应选用_________(填A、B、C)。现实验室有0.5mol/L、0.05mol/L和0.005mol/L的标准盐酸,中和滴定时宜选用________mol/L的标准盐酸。
19.(13分)磷化氢(PH3)是一种无色剧毒的气体(沸点为-89.70C)。夏夜,坟场附近游荡着的蓝莹莹的“鬼火”,就是PH3的自燃现象。PH3可以由碘化磷(PH4I)与强碱反应来制取,其原理类似于实验室制取氨气。现用下图所示装置进行PH3的制取和性质实验。
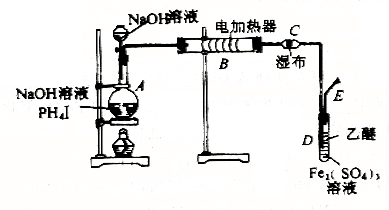
(1)实验室用PH4I和烧碱反应制取PH3的化学方程式为__________________;
(2)实验开始时,先从分液漏斗往盛有碘化磷的烧瓶(A)中加入适量的乙醚(乙醚为无色液体,沸点是34.5 ℃,微溶于水,与Fe2(SO4)3溶液不发生反应)。微热数分钟后,再从分液漏斗往烧瓶中加入一定量浓烧碱溶液,继续加热。在B处用电加热器控制硬质玻璃管温度在300℃左右。实验中可观察到:①在用湿布裹着的C管处有白色蜡状固体生成;②D试管中Fe2(SO4)3溶液由黄褐色变为浅绿色,同时也有白色蜡状固体生成;③E处点燃气体,火焰呈淡蓝色。
I.C管处白色蜡状固体是________,这一事实说明PH3受热________________。
II.D试管中发生反应的化学方程式为:__________________________,此反应说明PH3具有___________性。
III.E处导出的气体必须点燃的原因是___________________________________。
IV.实验开始时,先往烧瓶A中加入适量乙醚并加热,其目的是______________。
四、(本题包括2小题,共20分)
20.(10分)X、Y、Z、W四种元素,都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等,X原子半径是自然界元素中原子半径最小的,W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍,W原子最外层电子数为其电子层数的3倍,推断这四种元素的名称分别为:X______ Y______ Z______ W_______
由X、Y、Z、W四种元素形成的一种有机酸盐,其原子数之比为4∶1∶1∶2,该化合物的名称为___________,其结构简式为___________。
21.(10分)人体的胃液是一种无色而呈酸性的液体,pH在0.9~1.5之间,胃液中含有大量的盐酸,其中的H+浓度比血液高几万倍。回答下列问题:
胃液中含有大量的盐酸的意义是 ;
(2)若胃液酸度增高会患胃酸过多症,下列物质不适于用作治疗胃酸过多症的药物的主要成分的是 (A.小苏打粉 B.氢氧化铝粉C. 氧化钙粉D.纯碳酸钙粉)
(3)胃镜检查发现胃少量出血,说明溃疡以深及 (胃壁、胃粘膜下层),胃溃疡患者胃酸过多可考虑选用(2)中的试剂 。
(4)三硅酸镁晶体(Mg2Si3O8·nH2O)是一种常见的用来治疗胃溃疡的药物,该药物不溶于水,但能中和胃酸,作用持久。写出该药物中和胃酸的化学方程式: 。
五、(本题包括2小题,共20分)
22.(8分)缩聚产物:
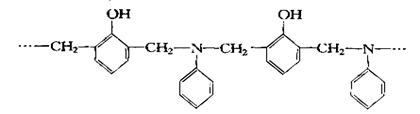 |
是一种具有较好耐热性,耐水性和高频电绝缘性的高分子化合物(树脂),它是由三种单体在一定条件下缩聚(同时还生成水)而成的。
这三种单体分别是(写结构简式):__________,_________和_________。
它们的物质的量之比(按以上回答单体的顺序写比例式)为___________。
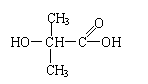
23.(12分)化合物C和E都是医用功能高分子材料,且有相同的最简式,均可由化合物A(C4H8O3)制得,如下图所示:

(1)A→D的化学方程式为_________________________。
(2)B→C的化学方程式为__________________________。
(3)A→B的反应类型为____________________________;
E的结构简式为__________________________。
与A同类别且有支链的A的同分异构体的结构简式为_________________。
六、(本题包括2小题,共19分)
24.(7分)排放的污水含氨量过高也会造成水体污染,使水中藻类大量繁殖,耗掉水
![]() 溶氧,形成“死水”。某废水处理站用甲醇处理含氨34 mg/L的废水,其反应原理如下:
溶氧,形成“死水”。某废水处理站用甲醇处理含氨34 mg/L的废水,其反应原理如下:
NH3+2O2 NO3-+H++H2O
6H++6NO3-+5CH3OH==3N2↑+5CO2↑+13H2O
如果每天处理500 m3废水,理论上需要用甲醇多少千克?
25.(12分)某厂生产时需用的烧碱为粗品(含NaOH和NaCl)。为测定碱中NaOH的![]() 含量B%(即NaOH的质量分数)是否在(80±2)%合格的范围内,该工厂化验室使用了下列方法:取W g粗碱样品配成500 mL溶液,取出V mL的碱液用0.2000 mol/L的硫酸标准溶液滴定。若要使达到滴定终点时,所加入的0.2000 mol/L的硫酸的体积(毫升数)恰好等于B的
含量B%(即NaOH的质量分数)是否在(80±2)%合格的范围内,该工厂化验室使用了下列方法:取W g粗碱样品配成500 mL溶液,取出V mL的碱液用0.2000 mol/L的硫酸标准溶液滴定。若要使达到滴定终点时,所加入的0.2000 mol/L的硫酸的体积(毫升数)恰好等于B的![]() 。求:
。求:
(1)应取多少毫升的待测样品溶液才适于滴定?
(2)若希望用20.00 mL待测液进行滴定,应称取样品质量(W)是多少克?
(3)在题设条件下,化验室滴定时所用的0.2000 mol/L的硫酸标准溶液,在多少毫升范围内,粗碱样品的质量才算合格?
综合测试(二)参考答案
一、(本题共32分)
1.B 2.B 3.C 4.D 5.B 6.A 7.A 8.C
二、(本题共42分)
9.A 10.C 11.BC 12.B 13.D 14.AB 15.C 16.B 17.B
三、(本题共19分)
18.NaOH固体溶于水加热,使NH3溶解度减小,NH3逸出;NaOH溶于水,电离出OH-,使NH3+H2O=(此处等号是一个可逆符号,请制作人员与我联系)![]() + OH-的电离平衡逆向移动,NH3逸出。(2分)
+ OH-的电离平衡逆向移动,NH3逸出。(2分)
(2)甲基橙,B,0.05(各2分)
分析:用盐酸滴定氨水,终点时溶液显酸性,不能用酚酞,误差太大。
经喷泉实验所得的氨水,理论上可计算出其浓度应为![]() mol/L,选择盐酸的浓度应与其相近,便于滴定。
mol/L,选择盐酸的浓度应与其相近,便于滴定。
19.(1)PH4I+NaOH = NaI+PH3↑+H2O
(2)Ⅰ.白磷,分解生成白磷
Ⅱ. 4PH3+6Fe2(SO4)3 = 12FeSO4+P4+6H2SO4,还原。
III.此气体除H2外,还有未反应的剧毒的PH3和乙醚蒸气,点燃可减少对空气的污染。
IV.乙醚蒸气密度大,可先将装置中的空气排尽,以保护PH3不致在装置中自燃,影响实验效果。
注(1)(2)各2分,后三问各3分
四、(本题共20分)
20.(10分)氢、碳、氮、氧,乙二酸铵(或草酸铵)
 |
21.(10分)(1)(4分)能激活胃蛋白酶原;为胃蛋白酶原提供所需的酸性环境;是食物中的蛋白质变性,易于水解;还能杀死随食物进入人体的细菌。(2)(2分)C;(3)粘膜下层,(各1分)B (2分)
(4)Mg2Si3O8·nH2O+4HCl = 2 MgCl2+3 SiO2+(n+2) H2O
五、(本题共20分)
22. 苯酚 甲醛 苯胺 1∶2∶1
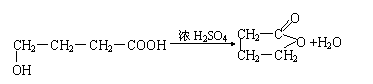
23. (1)
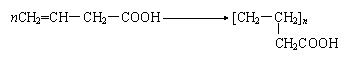 (2)
(2)
![]()
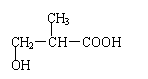 (3) 消去反应,
(3) 消去反应,
 (4)
(4)
,
六、(本题共19分)
24.(7分)m (NH3) = 500 × 103 L·34×10–3 g/L = 17000 g = 17 kg (1分)
6NH3 ~ 5 CH3OH (2分)
6×7 5×32
17 kg m(CH3OH)
m(CH3OH) = ![]() (2分)
(2分)
= 27 kg (2分)
25.(12分)
(1)
![]() (2分)
(2分)
![]() (2分)
(2分)
(2)将 20.00 mL代入(2)式 20.00 mL = ![]() (2分)
(2分)
W=10.00 g (2分)
(3)![]() (NaOH) = 78%
代入(1)式
(NaOH) = 78%
代入(1)式
![]()
V1= 0.0195 L
= 19.5 mL (2分)
![]() (NaOH) = 82% 代入(1)式
(NaOH) = 82% 代入(1)式
![]()
V2= 0.0205 L
= 20.5 mL (2分)