新课程高三化学综合测试题(2)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
相关相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
发展绿色食品,避免“白色污染”,增强环保意识,是保护环境,提高人类生存质量的重要措施,请回答1~3题。
1.绿色食品是指 ( )
A.绿颜色的营养食品店 B.有叶绿素的营养食品
C.附加值高的营养食品 D.安全、无公害的营养食品
2.通常所说的“白色污染”是指 ( )
A.冶炼厂的白色烟尘 B.石灰窑中的白色粉尘
C.聚乙烯等白色塑料 D.白色建筑废料
3.提倡“免赠贺卡”,“免用一次性木筷”的出发点是 ( )
A.减少个人经济支出 B.节约木材,保护森林
C.减少固体垃圾 D.移风易俗
4.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转化为
Fe3+,生成高铁血红蛋白而丧失与O2的结合能力,服用维生素C可以缓解亚硝酸盐的中
毒,这说明维生素C具有 ( )
A.酸性 B.碱性 C.氧化性 D.还原性
5.由于人类向大气中排放有毒气体,形成南极臭氧层空洞,下列气体哪种是形成南极臭氧
层空洞的罪魁 ( )
A.Cl2 B.HCl C.NO2 D.CCl2F2
6.关于卤族元素的下列说法不正确的是 ( )
A.原子半径的单位是10-10m
B.液态溴易溶于水形成溴水,也易溶于有机溶剂
C.溴蒸气和NO2可以用水区分
D.碘是紫黑色具有金属光泽的晶体
7.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→
暗→明,下列说法正确的是 ( )
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.灯泡最暗时溶液中无自由移动的离子
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
8.明矾的主要成分是KAl(SO4)2·12H2O,关于明矾的下列说法不正确的是 ( )
![]() A.电离方程式为:KAl(SO4)2 K++Al3++2SO
A.电离方程式为:KAl(SO4)2 K++Al3++2SO![]()
B.可以做食品的膨化剂
C.能净化水,但不能使硬水软化
D.明矾中有Al3+,多食对人体健康不利
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列说法不正确的是 ( )
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中能产生污染环境的有害气体如CO、SO2等
C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.固体煤变为气体燃料后,燃烧效率会降低。
10.下列各组物质充分混合后,再加热蒸干,并将得到的固体物质灼烧至质量不变,最终得
到混合物的是 ( )
A.物质的量浓度相等的(NH4)2SO4与BaCl2溶液等体积混合
B.向FeI2溶液中加足量H2O2
C.向FeSO4溶液中通入过量Cl2
D.等物质的量混合的钠和铝混合物投入到较多的水中
11.下列说法中不正确的是 ( )
A.传感膜和热电膜均是功能高分子材料的产品
B.传感膜能将化学能转换成电能
C.热电膜能将热能转换成化学能
D.热电膜能将热能转换成电能
12.已知某种元素一种同位素原子的核内质子数为m、中子数为n,则下列论断正确的是( )
A.若一个碳原子的质量为W g,则此种原子一个原子的质量为(m+n)W g
B.这种元素的相对原子质量为m+n
C.不能由此确定该元素的相对原子质量
D.核内中子的总质量一定小于质子的总质量
13.有关材料的用途不正确的是 ( )
A.高温结构陶瓷可以制作耐酸设备
B.氧化铝陶瓷不可以用于制耐高温设备
C.氮化硅陶瓷可以制造轴承
D.光导纤维可用于传能、传像照明等
14.下列离子方程式错误的是 ( )
A.向NaHSO4溶液中加入Ba(OH)2溶液呈中性:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.向NaAlO2溶液中加入盐酸至溶液呈酸性:
AlO2-+4H+=Al3++2H2O
C.在碳酸氢铵溶液中加入过量的NaOH溶液:
NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O
D.往苯酚钠溶液中通入足量的CO2:
![]()
15.关于原电池和电解池的叙述正确的是 ( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阳极一定是阴离子放电
![]() 16.在一定体积和一定条件下有反应N2+3H2 2NH3,现分别从两条途径建立平衡:
16.在一定体积和一定条件下有反应N2+3H2 2NH3,现分别从两条途径建立平衡:
Ⅰ.起始浓度N2 l mol·L-1,H2 3mol·L-1。
Ⅱ.起始浓度N2 2mol·L-1,H2 6mol·L-1,下列叙述正确的是 ( )
A.Ⅰ和Ⅱ两途径达到平衡时,体系内各成分的体积百分含量相同
B.达到平衡时,I途径的反应速率v(H2)等于Ⅱ途径的反应速率v(H2)
C.达到平衡时,Ⅰ途径体系内混合气体的密度为途径Ⅱ体系内混合气体的密度的![]()
D.达到平衡时,Ⅱ途径体系内混合气体的压强是I途径内混合气体压强的2倍
17.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和H2O时,放出
445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)→2CH4(g)+4H2O(l); △H=+890kJ/mol
B.CH4(g)+2O2(g)→CO2(g)+2H2O(l); △H=+890kJ/mol
C.CH4(g)+2O2(g)→CO2(g)+2H2O(l); △H=-890kJ/mol
D.![]() CH4(g)+O2(g)→
CH4(g)+O2(g)→![]() CO2(g)+H2O(l); △H=-890kJ/mol
CO2(g)+H2O(l); △H=-890kJ/mol
18.化学工作者把烷烃、烯烃、环烷烃、炔烃、……的通式转化成键数的通式,给研究有机
物分子中键能大小的规律带来了很大方便。设键数为I,则烷烃中碳原子数跟键数的关
系的通式为CnI3n+1,烯烃(视双键为两条单键)、环烷烃中碳原子数跟键数关系的通式为
CnI3n,则苯的同系物中碳原子数跟键数关系的通式为 ( )
A.CnI3n-1 B.CnI3n-2 C.CnI3n-3 D.CnI3n-4
第Ⅱ卷(非选择题 共78分)
三.(本题包括2小题,共19分)
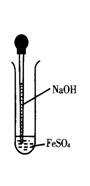 19.(9分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,
19.(9分)实验室用如图所示方法制Fe(OH)2,但一般看不到白色沉淀,
而是灰绿色转为红褐色的沉淀,请回答:
(1)滴管下端插入液面的原因是_____________________________
______________________________________________。
(2)生成红褐色沉淀的化学方程式为_________________________。
(3)此反应中的02可能来自于______________________________
_____________________________________________________。
(4)现欲用同样的装置制得Fe(OH)2白色沉淀(至少能存在较长的时间),
设计一个改良的实验方案。(提示:如何能减少02对生成Fe(OH)2的氧化)
| 操 作 方 法 | 目 的 |
|
| |
|
| |
|
| |
20.(10分)实验室有下列装置
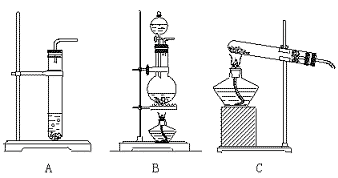
下列试剂:①一定浓度的氢氧化钠溶液 ②37%盐酸 ③40%硫酸 ④14%盐酸
⑤大理石 ⑥碳酸钾固体
按下列要求填空:
(1)要制取二氧化碳气体,应选用哪种装置__________________(填符号),选用哪些
试剂__________________(填代号),该装置检验气密性的方法_________
______________________________________________________________________,
有关的反应方程式____________________________________。
(2)制备碳酸钠的纯溶液,应选择的试剂为_____ ___(填代号),简述试验步骤。
四.(本题包括2小题,共20分)
21.(10分)A、B、C、D、E均为常见的分子或离子,它们都具有10个电子,A是有五个
原子核的离子,它们之间的关系如下:![]() ,B+E=2D,D与酸性氧化物
,B+E=2D,D与酸性氧化物
和碱性氧化物均反应,则A的符号为________________,B的符号为________________,
E的电子式为_____ _________________。实验室制取C的化学方程式为
_______________________________________________ _________。
22.(10分)现代生活中,人们越来越注意微量元素的摄入,碘元素对人体健康与发育有着
至关重要的作用。若缺少碘元素,则会造成幼儿痴呆、发育不良,易患地方性甲状腺肿。
为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50毫克的碘酸钾。
据此回答下列问题:
(1)食盐包装袋通常标有如下建议:菜未熟不宜加入碘盐。请简述其中所包含的化学原
理:_________________________________________________________________。_标有如下建议:菜未熟不宜加入碘盐。请简述其中所包含的化学原理。
(2)已知KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定
电流强度和温度下电解KI溶液。总反应化学方程式为KI+3H2O![]() KIO3十3H2↑
KIO3十3H2↑
则两极反应式分别为:阴极____________ _______,阳极__________ ______。
(3)为检验某食盐中是否含有碘酸钾。某同学取食盐样品428g溶解后,加入盐酸酸化
的淀粉碘化钾溶液,溶液呈蓝色。反应的离子方程式为_____________ ______,
氧化产物与还原产物的物质的量之比为________________ __。
(4)为进一步确证该样品是否为合格产品,该生再用0.030mol/L的硫代硫酸钠溶液滴
定,当用去18.00mL时蓝色刚好又褪去(I2+2S2O32-—→2I-+S4O62-)由此可通过计算判
断该加碘食盐为____________ (填合格或不合格)食盐。
五.(本题包括2小题,共20分)
23.(9分)CH3COOH是一种弱酸,而氯乙酸(CH2ClCOOH)的酸性强于CH3COOH,这是
因为—Cl是一种强吸引电子基团,能使—OH上的H 原子具有更大的活动性。有的基团
属于斥电子基团,能减弱—OH上H 原子的活动性,这种作用叫“诱导效应”。
根据以上规律判断:
(1)HCOOH 显酸性,而H2O 呈中性,这是由于HCOOH分子中存在__ __电子基
团,这种基团是___ ______。( )
(A)吸,羟基 (B) 吸,羧基 (C)斥,羧基 (D) 斥,羟基
(2)CH3COOH 的酸性弱于HCOOH,这是由于CH3COOH 分子中存在(斥)电子基团,
这种基团是(甲基)。 请判断:( )。 (填“对”或“错:)
(3)C6H5-(苯基)也属于吸电子基团,所以C6H5COOH(苯甲酸)酸性比乙酸的酸性
( )。(填 1---“强”或
2---“弱”)。 ![]()
24.(11分)药用有机物A为一种无色液体。从A出发可发生如下一系列反应
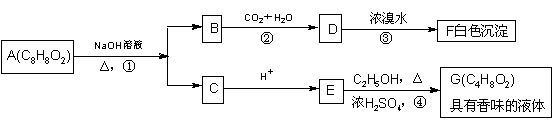
试回答:
(1)化合物A、B的结构简式:A____________________;B___________________。
(2)用化学方程式表示反应③和④
③_________________________________________________________。
④_________________________________________________________。
(3)有机物A的同分异构体甚多,其中属于羧酸类化合物,且含有苯环结构的异构体有
4种,它们是____________、______________、______________、_____________。
六.(本题包括2小题,共19分)
25.(7分)用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、
阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的
量浓度。
26.(12分)CuSO4溶液和强碱反应得碱式硫酸铜,其化学组成为aCuSO4·bCu(OH)2(a、b
为正整数,且2<b<6,![]() ),有的还含一定数目的结晶水,其组成随反应条件不同
),有的还含一定数目的结晶水,其组成随反应条件不同
而异。
(1)取一种不含结晶水的某碱式硫酸铜样品高温灼烧后只得CuO固体,另取等质量的该
样品,滴加稀盐酸至恰好完全反应。两次实验中消耗HCl与生成CuO的物质的量
之比为3:2,则该碱式硫酸铜的化学组成为__________________。
(2)某含结晶水的碱式硫酸铜aCuSO4·bCu(OH)2·cH20(c也是正整数),已知a+b+c=9。
取一定量样品高温灼烧至质量不再改变,将反应产生的气体通过盛有足量P205的U
型管,U型管增重1.26g。残留固体冷却后质量为5.60g。通过计算求该含结晶水
的碱式硫酸铜的化学组成。
新课程高三化学综合测试
参考答案
综合二
1.D 2.C 3.B 4.D 5.D 6.B 7.A 8.A 9.AD [解析]化石燃料只用在适当的温度和有氧条件下才能燃烧。化石燃料不经处理直接燃烧可产生污染物CO、SO2等有害气体。化石燃料(煤)经深加工后变成气体燃料再燃烧,不仅可以减少SO2对大气的污染,而且能提高燃烧效率。 10.C 11.C 12.C 13.B 14.D 15.B 16.C 17.C 18.C
19.(9分)(1)避免和减少空气中的氧气对Fe(OH)2氧化(2分) (2)4Fe(OH)2+O2+2H20=4Fe(OH)3(2分)
(3)溶入NaOH溶液的02,溶入FeSO4溶液的02,空气中的O2。(2分)
(4) (3分)
| 操作方法 | 目的 |
| 将NaOH溶液加热到沸腾后冷却使用 | 减少NaOH溶液中的O2 |
| 用加热到沸腾后冷却的蒸馏水配FeSO4溶液。 | 减少FeSO4溶液中的O2 |
| 在试管液面上滴少量油 | 隔绝空气中的02 |
注:学生如有其他合理的设计方案也是对的,此答案仅供参考。
20.(10分)(1)A (1分) ④⑤(1分)
检验气密性的方法是:用橡皮管连接一段导管,将导管的出口浸入水槽中,手握住试管,有气泡从导管
口逸出,放开手后,有少量水进入导管,表明装置不漏气。 (2分)2HCl+CaCO3====CaCl2+H2O+CO2↑
(1分) (2)①④⑤(1分)
步骤:①取同体积的氢氧化钠溶液分放在两只烧杯中;(1分)
②用14%的盐酸与大理石作用,将产生的二氧化碳通入盛有氢氧化钠溶液的一只烧杯中,使之全
部转化为碳酸氢钠;(1分)
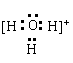 ③将另一只烧杯中的氢氧化钠倒入其中,可得碳酸钠的纯溶液。(2分)
③将另一只烧杯中的氢氧化钠倒入其中,可得碳酸钠的纯溶液。(2分)
21.(10分) A:NH4+ (2分) B: OH- (2分) E: (3分)
![]() (3分)
(3分)
22.(10分) (1)因C1、Br同属卤族元素,所以KIO3的性质可由KClO3类似获得,由于KClO3受热易分解,
所以KIO3在高温下受热同样易分解。(2分)
(2) 6H2O+6e-=3H2↑+6OH-;(1分)I-+3H2O-6e-=IO3-+6H+。(1分)
(3) 5I-+IO3-+6H+=3I2+3H2O,(2分) 5:1。(2分)
(4)合格(2分)
提示:由I2十2S2O32-—→2I-十S4O62-知:
n(I2)=0.03mol/L×0.018L×![]() =0.27×10-3mol
=0.27×10-3mol
由IO3-~3I2得:
n(KIO3)=0.27×10—3mol×![]() =9×10—5mol 因此每千克食盐中含KIO3
=9×10—5mol 因此每千克食盐中含KIO3
![]() ×1000mg/g=45mg
所以该盐为合格食盐。
×1000mg/g=45mg
所以该盐为合格食盐。
23.(9分)(1) B(3分) (2) 对 (3分) (3) 1(3分)
24.(11分) (1)A.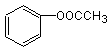 (2分) B.
(2分) B.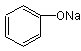 (2分)
(2分)
(2) ③ 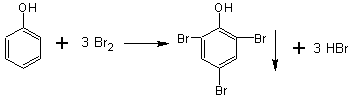 (2分)
(2分)
④![]() (1分)
(1分)
(3)
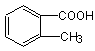
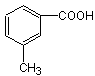
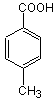 (4分)
(4分)
![]() 25.(7分(解:有关的电有反应:阴极:
25.(7分(解:有关的电有反应:阴极:![]() (1分)
(1分)
![]() (1分)
(1分)
阳极: (1分)
![]()
∴阳极转移的电子的物质的量为 (1分)
![]()
![]() 阴极上 得到电子的物质的量为
(1分)
阴极上 得到电子的物质的量为
(1分)
![]()
![]() 的物质的量为
(1分)
的物质的量为
(1分)
![]()
![]() 原溶液中 的物质的量浓度为
(1分)
原溶液中 的物质的量浓度为
(1分)
26.(12分) [说明] 本题考查有关结晶水合物的计算,要求学生根据Cu(OH)2、CuS04灼烧分解的性质,结
合实验数据推测结晶水合物的化学式。有些学生可能不注意a与b的比值范围,造成多解,也有些同学
不善于运用讨论法解题,使解题不能继续下去,因而,此题能较好的检查学生分析问题、解决问题的能
力。 [答案] (1)该碱式硫酸铜的化学式为 CuSO4·3Cu(OH)2 (4分)
(2)根据题意,1.26g为样品加热生成水蒸气的质量,5.60g为样品分解生成CuO的质量。
n(CuO):n(H20)=![]() ∶
∶![]() =0.07∶0.07=1∶1
(4分)
=0.07∶0.07=1∶1
(4分)
即a+b=b+c
所以a=c 因![]() <
<![]() <
<![]() a+b+c=9 若a=c=1 b=7 不符 a=c=2 b=5 符合
a+b+c=9 若a=c=1 b=7 不符 a=c=2 b=5 符合
a=c=2 b=3 不符合 a=c=2 b=1 不符合
所以该含结晶水的碱式硫酸铜的化学式为 2CuSO4·5Cu(OH)2·2H20 (4分)