新课程高三化学综合测试题(3)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
相关相对原子质量:H 1 C 12 N 14 O 16 K 39
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.下列说法中错误的是 ( )
A.铅笔不含铅 B.水银不含银 C.白金不是金 D.重水不是水
2.氯化铁溶液与氢氧化铁胶体具有的共同性质是 ( )
A.分散质颗粒直径都在1~100nm之间 B.都能透过半透膜
C.加热蒸干灼烧后都有氧化铁生成 D.呈红褐色
3.某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数 ( )
A.只有x+1 B.可能是x+8或x+18
C.可能是x+2 D.可能是x+1或x+11或x+25
4.将NO3-+Zn+OH-+H2O—→NH3+Zn(OH)42-配平后,离子方程式中H2O的系数是( )
A.2 B.4 C.6 D.8
5.压强变化不会使下列化学反应的平衡发生移动的是 ( )
A.H2(气)+I2(气)![]() 2HI(气) B.3H2(气)+N2(气)
2HI(气) B.3H2(气)+N2(气)![]() 2NH3(气)
2NH3(气)
C.2SO2(气)+O2(气)![]() 2SO3(气) D.C(固)+CO2(气)
2SO3(气) D.C(固)+CO2(气)![]() 2CO(气)
2CO(气)
6.给出下列条件,无法确定该物质摩尔质量的是 ( )
A.已知气态物质在标准状况时的密度 B.已知物质的体积和质量
C.已知一定量物质的质量和物质的量 D.已知物质一个分子的实际质量
7.下列各组物质在溶液中的反应,不管反应物的量的多少,都只能用一个离子方程式来表
示的 ( )
A.FeBr2和C12 B.Ba(OH)2和H2SO4
C.HCl与Na2CO3 D.Ca(HCO3)2与NaOH
8.一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是 ( )
2NH3(g)达到化学平衡状态的标志是 ( )
A.c(N2):c(H2):c(NH3)=1:3:2
B.N2,H2和NH3的质量分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每增加lmol N2同时增加3mol H2
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.在常温下10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7
(假设反应前后总体积不变),则对反应后溶液的叙述正确的是 ( )
A.c(A-)=c (K+) B.c (H+)= c (OH-)< c (K+)< c (A-)
C.V总≥20ml D.V总≤20ml
10.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外
电子层结构,B2-具有与Ar相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第Ⅲ族的元素 D.B是第3周期ⅥA族的元素
11.在pH=1的无色溶液中能大量共存的离子组是 ( )
A.NH4+ Mg2+ SO42- Cl- B.Ba2+ K+ OH- NO3-
C.Al3+ Cu2+ SO42- Cl- D.Na+ Ca2+ Cl- AlO2-
12.将颜色相近的NO2和Br2(气)分别装入注射器中,将活塞同时向外拉,使气体体积扩大
1倍后,下列叙述错误的是 ( )
A.NO2的颜色比Br2(气)颜色深 B.两种气体颜色均比原来浅
C.Br2(气)的压强比NO2变化小 D.Br2(气)的压强比NO2变化大
13.有关材料分类正确的是 ( )
A.硅酸盐材料属于新型无机非金属材料
B.高温结构陶瓷属于新型无机非金属材料,金属属于金属材料,但都属于结构材料
C.新型无机非金属材料包括半导体材料、光导纤维、氧化铝陶瓷等
D.氮化硅陶瓷属于新型无机非金属材料,但不是高温结构材料
14.硫酸铵在强热的条件下分解,生成NH3,SO2,N2和H2O,该反应中的氧化产物和还原
产物的物质的量之比为 ( )
A.1:3 B.2:3 C.4:3 D.1:1
15.氧只有35C1和37C1两种稳定同位素,它们在氯气中的原子数之比35C1:37C1为3:1,
则分子量为70、72、74的氯气分子数之比可能是 ( )
A.5:2:1 B.5:2:2 C.9:3:1 D.9:3:2
16.下列说法正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应在一定条件下(如常温、加热等)也能发生反应
17.对尼古丁和苯并[a]芘的分子组成与结构描述正确的 是 ( )
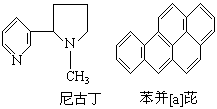 A.尼古丁为芳香族化合物
A.尼古丁为芳香族化合物
B.苯并[a]芘的分子式为C20H18
C.苯并[a]芘分子中含有苯环结构单元, 是苯的
同系物
D.尼古丁分子中的所有碳原子可能不在同一平
面上, 苯并[a]芘分子中的所有氢原子可能都在同一平面上
18.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电
时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电
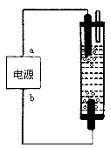 源电极名称和消毒液的主要成分判断正确的是
( )
源电极名称和消毒液的主要成分判断正确的是
( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
第Ⅱ卷(非选择题 共78分)
三.(本题包括2小题,共19分)
19.(9分)下图为常用玻璃仪器组成的七种实验装置,根据需要可在其中加入适量液体或固
体试剂。请选择适宜装置的序号填于空白处(多选、漏选或错选均扣分)
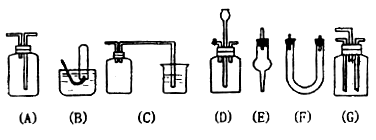
(1)既能用于收集Cl2又能用于收集NO的装置是________________________________。
(2)能用作干燥CO2气流的装置是________________________________________。
(3)能用于实验室制取Cl2并检验Cl2性质的连续实验中,除去Cl2中的HCl杂质的最佳
装置是________________________。
(4)合成NH3,可用于干燥、混合H2和N2的装置是________________________。
(5)接在气体的连续实验中间,用于达到控制气流使其平稳目的的装置是__________。
(6)用于尾气吸收并能防止液体倒吸到其它装置中的是________________________。
20.(10分)实验室可以用下图所示仪器连接起来制备纯净的二氧化碳并测定其式量。
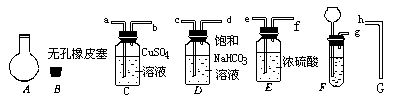
现用含有少量硫化亚铁的大理石和盐酸反应制备二氧化碳气体,实验步骤如下:
(1)将橡皮塞B塞在A烧瓶口,并用橡皮筋套在烧瓶的瓶颈处以标记橡皮塞所塞入瓶颈
的深度,准确称其质量为m1g。
(2)连接制备和净化气体的装置,其连接顺序是:
_ _接 __,_ _接_ _,_ _接_ _,_ _接_ _。
(3)将导管G插入烧瓶A中用向___ _(填“上”或“下” )排空气法收集
二氧化碳气体;检验二氧化碳气体已经充满烧瓶的方法是___ _ __。若经
检验,二氧化碳气体已经充满烧瓶,迅速用橡皮塞塞好烧瓶瓶口,并称其质量为m2g。
(4)将烧瓶口橡皮塞取下,向烧瓶内注水至标记线,再将水小心地倒入量筒测量出水的
体积为V1 mL;将该体积换算成标准状况时的体积为V2 mL。
请写出二氧化碳式量的计算式__ _____。
若不将气体净化和干燥,所测定的二氧化碳式量的数值将会____ _(填“偏高”或
“偏低” ),其理由是:___ ________________________
_ ________________________________________________________________________。
四.(本题包括2小题,共20分)
21.(12分)有A、B、C、D、E、F六种短周期的主族元素、原子序数依次增大,其中A、
D元素的原子最外电子层均只有一个电子,且A和D可形成离子化合物;C、F同主族,
B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元
素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,请回答:
(1)写出AD元素组成化合物的电子式_________ _______
(2)写出BDE元素组成化合物的名称___________ _______
(3)工业生产E的方法是___ ____________
(4)D、F两元素最高价氧化物的水化物之间发生反应的化学方程式______________
(5)D的氢氧化物和C的氢化物在水溶液中反应的离子方程式为________________
(6)若以上(4)、(5)两个反应物间恰好完全反应,且得到等体积,等物质的量浓度的
溶液,则(4)、(5)反应所得溶液中的离子个数是(4)_____________(5)(空格内选填“大
于”,“小于” 或“等于”)
|
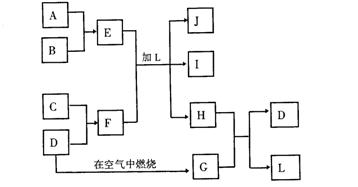
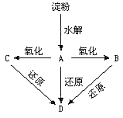
产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为________________ ___
(2)F的化学式为______________ ______
(3)写出J受热分解反应的化学方程式__________ __________________
(4)H和G之间反应的化学方程式为______________ _______________。
五.(本题包括2小题,共20分)
23.(8分)如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成
B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂
 还原成为D(C6H14O6)。
还原成为D(C6H14O6)。
已知相关物质被氧化的难易次序是
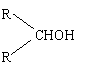 |
RCHO最易,RCH2OH次之, 最难,请在下列空格
中填写相应的结构简式
A___________________________________________ __________
B_______________________________________ _______________
C___________________________________ ___________________
D__________________________________________ __________
24.(12分)松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由
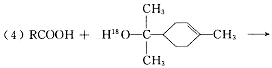
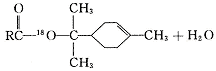
松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:
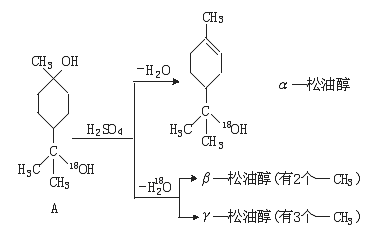
试回答:
(1)α—松油醇的分子式 。
(2)α—松油醇所属的有机物类别是 (多选扣分)。
A.醇 B.酚 C.饱和一元醇
(3)α—松油醇能发生的反应类型是 (多选扣分)。
A.加成 B.水解 C.氧化
(4)在许多香料中松油醇还有少量以酯的形式出现,写出RCOOH和α—松油醇反应的
化学方程式 。
(5)写结构简式:β—松油醇 ,γ—松油醇 。
六.(本题包括2小题,共19分)
25.(8分)实验室用电解食盐水装置电解0.5mol/L的氯化钾溶液100mL,当电路中通过
0.25mol电子时
(1)电解后所得溶液中溶质的质量为多少克?
(2)在标准状况下,阳极上放出气体多少升?
26.(11分)向100 mL某二价金属M的氢氧化物澄清溶液中加入过量的 NaHCO3溶液,生
成了MCO3沉淀,过滤,将沉淀置于足量的盐酸溶液中,在标准状况下收集到4.48L
气体。将滤液加水稀释至 250 mL,取出 25 mL恰好与 20 mL盐酸完全反应,在标准
状况下收集到1.12L气体。
(1)M的氢氧化物澄清溶液与NaHCO3溶液反应的化学方程式为:
_ __ __。
(2)要计算金属M的相对原子质量,你认为还必须提供下列哪项数据(填写供选项字母
序号)____。
(A)M的氢氧化物溶液的物质的量浓度(设为2mol·L-1)
(B)M的碳酸盐的质量(设为39.4 g)
(C)与M的碳酸盐反应的盐酸的物质的量浓度(设为 0.1mol·L-1)
(D)题设条件充足,不需要补充数据。
(3)根据你的选择,试计算金属M的原子量和加入的NaHCO3溶液中所含的NaHCO3
的质量。
新课程高三化学综合测试
参考答案
综合三
1.D 2.C 3.D 4.C 5.A 6.B 7.B 8.B 9.AD 10.BD 11.A 12.C 13.BC 14.A 15.AD 16.CD [解析](A) 需要加热才能发生的反应不一定是吸热反应,如煤的燃烧,一开始需要加热,但该反应是放热反应。(B) 放热反应也需要在一定条件下才能发生反应。如可燃物的燃烧必须达到一定的着火点。(C)反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小。(D)放热反应和吸热反应在一定的条件下都能发生。反应开始时需加热的反应可能是吸热反应,也可能是放热反应。 17.D 18.B
19.(9分)(1)AB (2)AEF (3)A (4)G (5)D (6)C
20.(10分)
(1)g接a,b接c,d接e,f接h。或g接c,d接a,b接e,f接h。(2分)
(3)上;用燃着的木条放在瓶口,若火焰熄灭,则证明CO2已经充满。(3分)
![]()
偏低:因为含有H2S、HCl、H2O等杂质气体的式量均小于CO2的式量。
21.(12分)每线2分
(1)Na+[·H·]- (2)偏铝酸钠 (3)电解氧化铝(或电解法)
(4)NaOH+HClO4=NaClO4+H2O (5)OH-+HF=F- +H2O (6)大于
22.(8分)每线2分
(1)H2O (2)Na2S (3)2Al(OH)3![]() A12O3+3H2O (4)2H2S+SO2=3S+2H2O
A12O3+3H2O (4)2H2S+SO2=3S+2H2O
23.(8分)A.HOCH2(CHOH)4CHO (2分) B.HOCH2(CHOH)4COOH (2分)
C.HOOC(CHOH)4COOH (2分) D.HOCH2(CHOH)4CH2OH (2分)
24.(12分)
(1)C10H18 18O (2分) (2)A (2分) (3)AC(2分)
 (2分)
(2分)
(5)
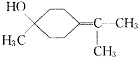 (2分)
(2分) 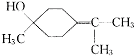 (2分)
(2分)
25.(8分) (1)KCl 0.05mol电解生成KOH 0.05mol 2.8克(4分)
(2)产生C12 0.025mol(1分) O2 0.05mol(1分) 合计生成气体1.68升(2分)
26.(11分)(1)M(OH)2+2NaHCO3=MCO3↓+2H2O+Na2CO3(2分) (2)B (3分)多选不得分
(3)解: MCO3 ~ CO2
1mol 22.4 L
x 4.48 L
x=0.20 mol
![]()
M的相对原子质量=197-60=137………………………………………(6分)