高三化学模拟试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分。考试时间120分钟。
可能用到的原子量:
H:1 C:12 O:16 Na:23 Mg:24 Zn:65 S:32 K:39 Mn:55 Fe:56
一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
( )1.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是
A、提高汽油燃烧效率 B、降低汽油成本
C、避免铅污染大气 D、铅资源短缺
( )2.生物体中细胞膜内的葡萄糖.细胞膜外的富氧液体及细胞膜之间可构成微型的生物原电池,下列有关判断正确的是
①正极的电极反应可能是:O2+4e-+2H2O=4OH—
②负极的电极反应可能是:O2+4e-+2H2O=4OH—
③负极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3—
④正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3—
A.①② B.①③ C.②③ D.②④
( )3.室温下,在pH=12的某溶液中,由水电离的c(OH—)为
①1.0×10—7mol• L—1 ②1.0×10—6mol• L—1
③1.0×10—2mol• L—1 ④1.0×10—12mol• L—1
A.① B.①③ C.④ D.③④
( )4.向100mL的FeBr2溶液中通入标准状况下的Cl23.36L时,Cl2全部被还原,测得此时溶液中c(Br—)=c(Cl—),则原FeBr2溶液的物质的量浓度是
A.0.75mol• L—1 B.1.5mol• L—1 C.2mol• L—1 D.3mol• L—1
( )5.已知2H2S+SO2=3S+2H2O,现将等物质的量的SO2和H2S常温下在定容的密闭容器中反应,待充分反应后恢复至常温。容器内的压强是原压强的
A.1/2 B.1/4 C.<1/4 D.>1/4
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
( )6.具有解热镇痛及抗生素作用的药物“芬必得”,其主要成分的结构式如图,它属于
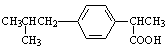 A.芳香族化合物
A.芳香族化合物
B.苯甲酸的同系物
C.易溶于水的有机物
D.易升华的物质
( )7.由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为
A.29:8:13 B.22:1:14 C.13:8:29 D.26:16:57
( )8.下列离子方程式中正确的是
A、偏铝酸钾溶液和过量盐酸:AlO2-+4H+=Al3++2H2O
B、醋酸铵溶液和盐酸反应:CH3COONH4+H+=CH3COOH+NH4+
C、碳酸氢钙溶液中加入少量氢氧化钙溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D、氢氧化亚铁在空气中氧化:4Fe2++O2+2H2O=4Fe3++4OH-
( )9.下列反应中,若调节反应物的用量或浓度,不会改变反应产物的是
A、白磷在Cl2中燃烧 B、铁在硫蒸气中燃烧
C.二氧化硫通入石灰水 D、H2SO4中加入锌粉
( )10.将2 mol H2O和2 mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)![]() 2H2+O2,2CO+O2
2H2+O2,2CO+O2![]() 2CO2。若平衡时O2和CO2的物质的量分别为n(O2)平=a mol ,n(CO2)平=b mol。则n(H2O)平为
2CO2。若平衡时O2和CO2的物质的量分别为n(O2)平=a mol ,n(CO2)平=b mol。则n(H2O)平为
A.2-2a-b B.2-b C.a-b D.a+b
( )11.要从苯酚的乙醇溶液中回收苯酚,合理的操作步骤是:①蒸馏 ②过滤 ③静置分液 ④通入过量CO2 ⑤加入足量Na ⑥加入足量NaOH溶液 ⑦加入乙酸和浓H2SO4的混合液后共热 ⑧加入足量的溴水
A.⑦① B.⑧②④③ C.⑥①④②或③ D.⑤④②
( )12.下列各组中的两组物质,既不是同系物,又不是同分异构体,但不论它们以何种比例混合,只要总质量不变,完全燃烧后生成的水的质量都相同的是
A、乙烯和丁烯 B、乙醛和乙酸乙酯
C、甲苯和甘油 D、丙醛和丙酮
( )13.根据下列反应判断有关物质还原性由强到弱的顺序是:
H2SO3+I2+H2O=2HI+H2SO4 2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO+2H2O+Fe(NO3)3
A、H2SO3>I->Fe2+>NO B、I->Fe2+>H2SO3>NO
C、Fe2+>I->H2SO3>NO D、NO>Fe2+>H2SO3>I-
( )14. 下列关于卤素单质及其化合物的叙述中,正确的是
① 随着原子序数增大,卤化氢(HX)分子中的化学链极性逐渐减弱
② 向含有卤离子(X-)的溶液中,滴加AgNO3溶液,均有颜色不同的卤化银沉淀析出。
③ ⅠA 族和ⅡA 族的金属卤化物(RX 和RX2)均是易溶于水的离子化合物。
④ 卤素单质(X2)与铜、铁反应,其生成物分别为CuX2和FeX3
A.①③ B.①④ C.②④ D.③④
( )15. 在托盘天平两端各放一个质量相等的烧杯,内盛4 摩/升的盐酸溶液50 毫升,调节天平使其平衡,分别向烧杯中加入下列各种物质,反应完毕天平仍为平衡的是
① 6.5克Fe和0.1摩Zn ② 0.1摩Fe和0.1摩Zn
③ 0.1摩Fe和5.6克Zn ④ 0.1摩Na和0.1摩Mg
A.①、② B.①、③ C.②、③ D.①、④
三.本题包括2小题,共28分。
16.有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe3+、Ba2+、 NO3-、SO42+、 Cl-、I-、HCO3-,取该溶液实验如下:
| 实验步骤 | 实验现象 | 结论 |
| ①观察溶液的外观 | 溶液无色透明 | |
| ②取少量原溶液,加几滴石蕊 | 溶液变成红色 | |
| ③另取少量原溶液,_____________,加热 | 有无色气体产生,后在空气中又变成红棕色 | |
| ④另取少量溶液,加BaCl2溶液 | 有白色沉淀生成 | |
| ⑤取④中上层清液,加AgNO3溶液 | 无法说明是否含_______离子 | |
| ⑥另取少量原溶液,加________ | 存在Al3+离子,无________ | |
| ⑦ | 存在Na+离子 | |
| ⑦ | 存在Cl-离子,无I-离子 |
 |
17.下图是一个制取氯气并以氯气为原料进行特定反应的装置:
(1)A是氯气发生装置,其中的化学反应方程式为______。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:
______________________________________________________,装置C的作用是______。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因____________________________________________________________________________。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为下列选项中的_________。
A.有白色沉淀生成
B.无明显现象
C.先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是______,B的作用是______。
四.本题包括3小题,共22分
18.不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷的一方。
下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴通过分析x值变化规律,确定N、Mg的x值范围:
_______<x(Mg)<____________,_________<x(N)<_____。
⑵推测x值与原子半径关系是 ____________________________ 。
根据短周期元素的x值变化特点,体现了元素性质的 变化规律。
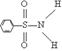
⑶某有机化合物结构式为:其中S—N中,你认为共用电子对偏向谁?
(写原子名称)。
⑷经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
⑸预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
19.查看下列数据,
|
| 乙醇 | 乙烷 | 氯乙烷 | 氯化钠 | 二氧化硅 |
| 熔点 | -117.3℃ | -183.3℃ | -136.4℃ | 801℃ | 1723℃ |
| 沸点 | 78.5℃ | -88.6℃ | 12.3℃ | 1465℃ | 2230℃ |
(1)一般来说,决定组成与结构相似的分子晶体的熔沸点的主要因素是______________________________;
(2)按照以上规律,无法解释乙醇与乙烷、氯乙烷之间熔点与沸点的大小的关系,可能原因是____________________________;
(3)氯化钠的熔沸点比较高的原因是__________________________;二氧化硅的熔沸点很高的原因是____________________。
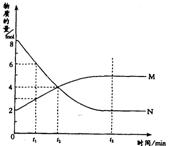 20、在恒定压强下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,且已知在反应达到平衡时,体系的体积有所增加。请填写下列空格:
20、在恒定压强下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,且已知在反应达到平衡时,体系的体积有所增加。请填写下列空格:
(1)该反应的化学方程式为:
_____________________________________;
(2)该反应的平衡常数表达式K=___________;该反应的K值随温度的升高而________(填增大、减少或不变),理由是________________________________。
(3)t1时,正反应速率______逆反应速率,t2时,正反应速率_______逆反应速率,t3时,正反应速率_______逆反应速率(填<、>或=);
(4)该反应在_______时刻到达平衡;
(5)达到平衡后,如果再加压,平衡______________移动(填“正方向”“逆方向”或“不”)。
五.本题包括2小题,共24分
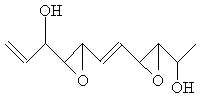 |
21.据报道,最近有人第一次人工合成了一种有抗癌活性的化合物Depudecin,这种物质曾从真菌里分离出来,其结构如下:
(1)试写出这种化合物的化学式 ;
(2)该物质可能发生的反应有________;
A、加成 B、氧化 C、水解 D、酯化
(3)该物质可以称为_________;
A、烃类 B、烯烃 C、烃的衍生物 D、醇类
(4)若分子中一个碳原子连着四个不同的原子或原子团称不对称碳原子,请在结构简式上用*号标出不对称碳原子。
(5)如果一个不对称碳原子都可以出现两个光学异构体,则这种抗癌分子有 _________种不同的光学异构体。
22. 某液态有机物A6.2 克与足量镁粉反应,生成2.24 升H2(标准状态下),A与Na2CO3溶液不反应;在同温同压下测得A气体的密度为CO2气体密度的1.41倍。A分子内脱水可得B,A分子间脱水可得C或D。A氧化得E,E再氧化得F。A与F脱水可得G或H。
(1) 推断、写出结构简式:A______________C______________D_______________。
(2) 写出A与F分子间脱水的化学方程式.
_____________________________________________
六.本题包括2小题,共16分。
23.取0.04mol KMnO4固体加热一段时间后,收集到a mol气体,此时KMnO4的分解率为X,在反应后的残留固体中加入一定量的浓盐酸,又收集到b mol气体,设此时Mn元素全部以Mn2+存在于溶液中,则:
(1)a+b=_________________(用X表示)
(2)当X=___________时,(a+b)取最小值,且最小值为 。
(3)当a+b=0.09mol时,0.04 mol KMnO4加热后所得固体残余物各是什么物质?其物质的量分别是多少?
24.有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2 L X蒸气和16.0 L O2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5 L(已知在该实验状况下气体的摩尔体积为42.0 L·mol-1);②当A处于标准状况下时,气体体积变为7.3 L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
(3)确定X的分子式和结构简式。
高三化学模拟试卷答案
1、C ±、B 3、D 4、C 5、C 6、AB 7、CD 8、AC 9、B 10、A 11、C 12、BC 13、A 14、A 15、D
16.
| 实验步骤 | 实验现象 | 结论 |
| ① | 无Fe3+离子 | |
| ② | 原溶液中含有能发生水解的离子 | |
| ③浓缩,加Cu片,再加浓硫酸 | 原溶液含有NO3-离子 | |
| ④ | 原溶液含有SO42-离子 | |
| ⑤ | 产生不溶于HNO3的白色沉淀 | Cl- |
| ⑥氢氧化钠溶液 | 加少量NaOH时产生白色沉淀,加过量NaOH时沉淀溶解 | HCO3- |
| ⑦)焰色反应 | 产生黄色火焰 | |
| ⑦取原溶液,加AgNO3溶液和稀HNO3 | 产生白色沉淀 |
17.(1)MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
(2)2Cl2 + C + 2H2O ![]() 4HCl + CO2;提供反应物Cl2和H2O
4HCl + CO2;提供反应物Cl2和H2O
(3)HCl溶解后溶液显酸性,使石蕊试液变红,过量的Cl2与H2O反应生成的HClO有漂白性,可使红色褪色
(4)B
(5)长颈漏斗中液面上升;作安全装置
18、⑴ 0.93 < x (Mg) < 1.61 ; 2.55 < x (N) < 3 .44
⑵同周期(同主族)中,x值越大,其原子半径越小; 周期性。
⑶氮原子 ⑷共价键 ⑸第六周期第ⅠA族(铯)
19.(1)相对分子质量越大,分子间作用力越大,物质的熔沸点越高
(2)甲醇的分子中存在氢键
(3)氯化钠是离子晶体,物质熔化必须克服离子间的作用力;二氧化硅是原子晶体,要熔化必须克服较强的共价键;
20.(1)2N(g)![]() M(g)
M(g)
(2)c(M)/{c(N)}2 ;减少;该反应为体积缩小的反应,但事实上反应后体积增大,所以只能有反应后温度升高引起体积膨胀;可见,只有当放热反应时,才能使体积膨胀。
(3)>;>;=
(4)t3
(5)正向
21. ⑴C11H16O4
⑵ABCD
(3)CD
(4)(含6个不对称C原子)(图略)
(5)26种
22. (1)A、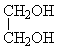
C.![]()
D、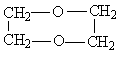
(2) 
23.![]() (1)0.1-0.02x
(1)0.1-0.02x
(2)1;0.08
(3)KMnO4 0.02 mol K2MnO4 0.01 mol MnO2 0.01 mol
24.(1)CO2、O2和H2O;
(2)CO2:0.2 mol、O2:0.13 mol、H2O:0.3 mol
(3)C2H6O2 HOCH2CH2OH