高三化学实验设计单元测试
一、选择题:(每题有1~2个答案)
1.制备1,2—二溴乙烷的合理反应是 ( )
A、乙烷光照下与Br2反应 B、乙烯加成HBr
C、乙炔与过量Br2反应 D、乙烯加成Br2
2.下列事实中,能证明氯化氢是共价化合物的是 ( )
A、氯化氢易溶于水 B、氯化氢的水溶液能导电
C、液态氯化氢不导电 D、氯化氢不易分解
3.在实验中手不慎被玻璃划破,可用FeCl3溶液紧急止血,其主要原因是 ( )
A、FeCl3溶液能使血凝聚 B、FeCl3溶液具有杀菌消毒作用
C、FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 D、FeCl3溶液能使血液发生化学变化
4.下列实验中,能验证乙二酸比乙酸酸性强的是 ( )
A、分别将未知浓度的两种酸滴在Na2CO3粉末上
B、同温时取等物质的量的浓度的两种酸分别滴定0.1mol·L-1的NaOH溶液
C、相同温度时取等物质的量的浓度的两种酸分别滴在pH试纸上
D、分别将乙二酸晶体和冰醋酸置于pH试纸上
5. 验证乙酸乙酯密度,溶解性和水解三项性质的合理实验是 ( )
A、将其滴入水中,随即滴加碱液并迅速加热至沸腾
B、将其滴入沸腾的碱液中观察
C、将其滴入水中观察片刻,再滴加含有酚酞的碱液并缓缓加热
D、将其滴入沸腾的水中观察
6.现有一种未知液,若加入过量盐酸,生成白色沉淀。过滤后向滤液加入过量的氨水使溶液呈碱性,又产生白色沉淀。再向滤液中加入小苏打液,还产生白色沉淀。根据以上事实,原溶液中可能存在的离子是 ( )
A、![]() 、Ba2+、Mg2+
B、Ag+、Ca2+、Mg2+
、Ba2+、Mg2+
B、Ag+、Ca2+、Mg2+
C、Ag+、Mg2+、Na+ D、Ag+、Al3+、Ba2+
7.向某一溶液里加入过量氨水,得到白色沉淀和无色溶液,将沉淀过滤并使其与过量烧碱作用,沉淀全部溶解,则原液里可能含有的离子是 ( )
A、Fe3+ B、Mg2+ C、Al3+ D、Ag+
8.某有机物x溶解于烧碱液(滴有酚酞)中,开始溶液呈红色,煮沸5分钟后,溶液褪色;加入盐酸至酸性时,沉淀出白色的晶体,该晶体溶于水,加入FeCl3溶液呈现紫色。该有机物x是 ( )
 O
O
A、 HO— —NH2 B、HO— —C—O—CH3
O
C、 HO—CH2— —C—OCH3 D、HO— —COOH
9.下列各组物质,只用一种试剂就能鉴别的是(允许加热) ( )
 ①Al2(SO4)3、FeCl2、Mg(NO3)2、NH4NO3四种溶液
①Al2(SO4)3、FeCl2、Mg(NO3)2、NH4NO3四种溶液
② 、 、 、 四种液体
③CuO、FeS、FeO、C四种黑色粉末
④KNO3、Al2(SO4)3、Ba(OH)2、HCl四种溶液
A、只有①③ B、只有①③④ C、只有②③④ D、全部
 10.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
( )
10.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
( )
A、 a为正极,b为负极;NaClO和NaCl
B、 a为负极,b为正极;NaClO和NaCl
C、 a为阳极,b为阴极;HClO和NaCl
D、 a为阴极,b为阳极;HClO和NaCl
11.Cu+在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质。若要检验用氢气还原CuO后所得的红色固体产物中是否含有Cu2O,应选用的试剂和相应的实验现象正确的是 ( )
A、浓H2SO4;是否有无色气体生成 B、稀HNO3;是否生成蓝色溶液
C、稀H2SO4;固体物质是否溶解 D、稀HCl;是否生成蓝色溶液
12.下列事故中,处理不当的是 ( )
A、皮肤上沾有苯酚时,立即用酒精洗涤
B、误食重金属盐,立即喝生牛奶或蛋清
C、不慎将水银温度计打碎,立即用硫磺覆盖水银
D、不小心将装浓硫酸的试剂瓶撞翻,立即用自来水冲洗
二、填空题:
13.现有右图所示装置,为实现下列实验目的,其中y端适合于作入口的是
(A)瓶内盛液体干燥剂,用以干燥气体
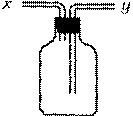 (B)瓶内盛液体洗涤剂,用以除去某气体中的杂质
(B)瓶内盛液体洗涤剂,用以除去某气体中的杂质
(C)瓶内盛水,用以测量某难溶于水的气体的体积
(D)瓶内贮存气体,加水时气体可被排出
(E)收集密度比空气大的气体
(F)收集密度比空气小的气体
14.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入98% H2SO4,充分搅拌直到固体不再溶解。 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀 |
15.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与澳发生加成反应,其理由是 (多选扣分)。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(a) (b) (c) (d)
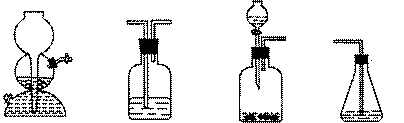
→ b → → d
(电石、水)( ) ( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
16.某试剂厂用银(含杂铜)和硝酸(含杂质Fe3+)反应制取硝酸银。步骤如下:
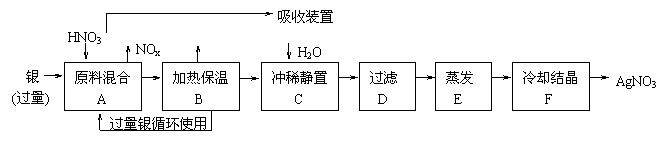
根据上述步骤,完全下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀),原因是 。
a、减少过程中产生NOx的量
b、减少原料银的消耗量
c、节省硝酸物质的量
(2)步骤B加热保温的作用是 。
a、有利于加快反应速率
b、有利于未反应的硝酸挥发
c、有利硝酸充分反应,降低溶液中的C(H+)
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀静置时发生的化学反应是 。
a、置换反应 b、水解反应 c、氧化还原反应
产生沉淀的化学式是 、 。
17.为证明在加热条件下,浓硫酸能将碳氧化成CO2,请根据所提供的如图所示的仪器装置设计实验,回答有关问题:
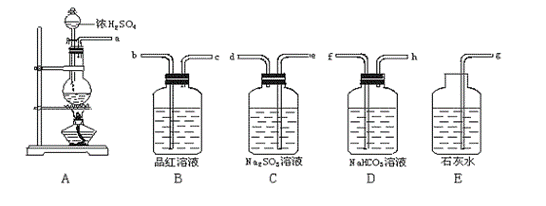
(1)仪器接口的连接顺序为 ;
(2)是否选择装置B的理由是 ;
(3)是否选择装置C的理由是 ;
(4)是否选择装置D的理由是 ;
(5)是否选择装置E的理由是 。
1、D 2、C 3、A 4、C 5、C 6 、BD 7、CD 8、B
9、D 10、B 11、D 12、D
13.(A)(B)(D)(E)
14.②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液。
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体。
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体。
⑤ 用蒸馏水冲洗滤纸上的固体若干次,直至洗净。
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净。
15.(1)CaC2+2H2O→C2H2↑+Ca(OH)2
HC≡CH+Br2→![]()
(或HC≡CH+2Br2→![]() )
)
(2)不能 a、c
(3)H2S Br2+H2S→S↓+2HBr
(4) c b
(CuSO4溶液)(CuSO1溶液)
(5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
16.(1)稀 a、c (2) a、c (3)b Fe(OH)3 Cu(OH)2
17.(1)a-e-d-b-c-g(2分)
(2)选择B的目的是检验SO2是否被吸收完全;(2分)
(3)选择C的目的是吸收SO2时,CO2不被吸收,同时也不生成CO2;(4分)
(4)不选D,因为NaHCO3溶液能与SO2生成CO2,干扰检验被氧化生成的CO2;(4分)
(5)选择E,检验是否生成CO2。(2分)