高三化学实验专题复习指导
高考走向
根据对近年来高考实验试题的分析,下列内容是实验考查的重点:
l.实验基本操作和技能
这类试题的特点通常是给出限定的仪器、药品和一些操作步骤,要求正确完成某项实验操作,既有常见仪器的使用,又有正确操作的辨别,着重考查考生的实验基本操作技能。
2.正确运用实验原理和正确认识实验装置
这类试题通常是给出限定的实验装置、反应条件、实验现象和有关数据,要求考生根据实验原理及试题中所给予的信息,结合元素化合物知识,选用仪器药品,正确认识、选择装置,说明装置中某些仪器的作用,描述实验现象,写有关化方程式,进行数据分析.指出实验中必须注意的某些问题等等,主要考查考生的观察能力与分析综合及评价的能力。
3.运用所学知识和技能进行实验设计或处理
这类试题的特点多是利用给出装好药品的单个实验装置,根据实验要求进行正确连接,或给出全部或部分实验环节,根据实验要求安排正确的实验步骤或补充实验。主要用于考查考生实验综合能力和评价能力。
由以上分析不难看出,尽管涉及到的知识和能力点是分散的,但高考试题中实验考查的内容和形式是较为稳定的,这给实验复习中突出重点提供了可能。实验复习可根据考纲和上述几方面内容设计一定的专题加以重点复习,这样就会起到事半功倍的效果。
知识点拨
化学实验的复习是整个化学总复习中一个非常重要的环节。实验复习必须有的放矢、突出重点。这个“的”就是“考试说明”所规定的考查内容,而重点就是历年来高考试题中所反映的考试内容。
1、实验复习必须集中和分散相结合,提高重要实验的复现率
“集中”,就是集中复习实验的基本操作和技能,集中复习一些综合性的实验专题,集中归纳总结实验知识。而“分散”则是指一些性质实验、制法实验、验证或探索性实验等应分散到元素化合物、有机物、基本理论等的复习过程中去。通过实验,进一步理解元素化合物等知识,进一步理解相关的实验原理,提高运用实验手段解决化学问题的能力,节省复习时间,提高考试成绩。
2、训练发散思维以增强实验设计能力,提高信息迁移水平
实验方案的设计往往有许多途径。为了适应中学生的知识能力水平,中学课本中的某些实验可能不是最优的方案。所以在实验复习中要根据实验原理来设计实验步骤和装置,掌握一些装置和仪器药品的替代方法,力求使设计的实验仪器简单、操作便捷、节省试剂、现象明显、安全防污等,培养和增强实验设计能力和创造性思维能力。近年来,实验题中新情境试题不断增多,这类试题的特点是将基本的实验操作设计置于新的情境中(主要是中学课本没有的新反应或新装置或是能使中学生理解的最新科技知识、简化的改进的装置等),结合学生原有的知识和能力,来进行仪器组装、现象描述、数据分析、考虑安全和防污等,用来考查考生自学能力、思维能力、分析综合及评价的能力。由于这类实验试题情境新颖、设问巧妙、铺垫得当、知识新、思维量大、所以区分度很好,能确实将一些基础扎实、自学能力强、思维敏捷、心理素质好的考生选拨出来。所以,新情境实验试题将是今后实验试题的命题方向。
典型例题
例1、某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铅的分解产物之一是氧气;将试管中的硝酸铅加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铅受热分解有氧气放出。请你对上述实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
 |
例2、研究某一化学反应的实验装置如下图所示:
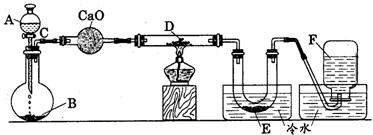 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A ,B ,C ,D ,E ,F 。
2、写出有关的化学方程式:
A与B ;C与D ;E与无水硫酸铜 ;F与Mg ;F与Mg的反应产物与水 。
[解析]“该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝”是解答此题的突破口,此气体只能是NH3,结合题意,F就是N2。因此,从限定的反应物中,只能设法从氨水中获取.然后结合发生装置特点(固、液、不加热)及其他实验现象,便可推断其他的物质。
解答:1、A、浓氨水;B、氧化钙;C、氨气;D、氧化铜;E、水;F、氮气。 2、(略)
知识过关
1、实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向旋动。
(2)某学生用已知质量为 y g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作 ;
 (3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
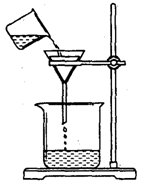
(4)过滤,某学生欲用右图装置操作,错误之处应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C的名称是 ;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
(答案:(1)左;(2)往左盘表面皿上慢慢加少量样品,使指针指向标尺中间;(3)氨水;(4)漏斗下端管口应紧靠烧杯内壁,倾倒液体时应用玻璃棒引流;(5)Al(OH)3;(6)W1:(W-W1)或W1:133.5W2/78)
2、实验室利用乙醇脱水制备乙烯的步骤如下;
①在一蒸馏烧瓶中加人95%的乙醇和浓硫酸(体积比为l:3),再加入少量干净的河沙;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)步骤①中混合乙醇和浓硫酸时应注意的问题是 。
(2)在反应液中加入河沙的原因是 。
(3)步骤②中温度计水银球的正确位置是 。
(4)加热时,使反应液温度迅速升高到I7O℃的原因是 。
(5)步骤④中.用稀NaOH溶液洗涤气体,能除去可能伴随乙烯生成的气体是 。
(答案:(1)将浓硫酸缓慢加入乙醇中并不断搅拌,必要时冷却。(2)河砂对乙烯的生成有催化作用,且能防止反应中形成大量的泡沫。(3)温度计水银球应浸没于反应液中。(4)若温度在140 C,生成的主要物质是乙醚并非乙稀。(5)硫酸与乙醇发生氧化还原反应生成的CO2及SO2)
3、欲制无水氯化铝并保存备用。现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。
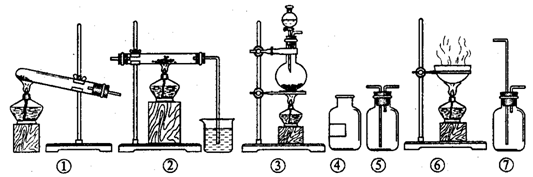
设计的制取过程是:制氯气 → 加净化和干燥氯气 → 制氯化铝
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满),并写出各仪器里放入的试剂的化学式。
仪器编号 、 、 、 、 ;
放入试剂 、 、 、 、 。
(2)写出实验过程中有关反应的化学方程式。
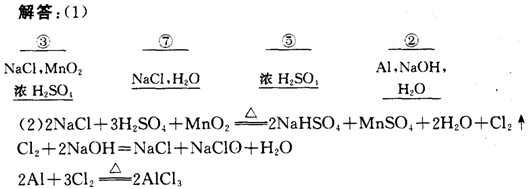
4、实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
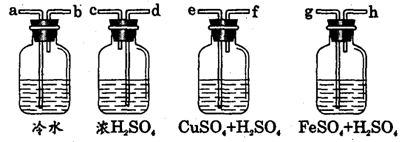 |
(1)它们连接的顺序为 ;
(2)除去H2S的离子方程式为 ;
(3)除去O2观察到的现象为 。
(答案:(1)ab—ef—gh—dc;(2)H2S+Cu2+= CuS↓+2H+;(3)溶液由浅绿色逐渐变成黄色)
化学实验专题复习指导
高考走向
根据对近年来高考实验试题的分析,下列内容是实验考查的重点:
l.实验基本操作和技能
这类试题的特点通常是给出限定的仪器、药品和一些操作步骤,要求正确完成某项实验操作,既有常见仪器的使用,又有正确操作的辨别,着重考查考生的实验基本操作技能。
2.正确运用实验原理和正确认识实验装置
这类试题通常是给出限定的实验装置、反应条件、实验现象和有关数据,要求考生根据实验原理及试题中所给予的信息,结合元素化合物知识,选用仪器药品,正确认识、选择装置,说明装置中某些仪器的作用,描述实验现象,写有关化方程式,进行数据分析.指出实验中必须注意的某些问题等等,主要考查考生的观察能力与分析综合及评价的能力。
3.运用所学知识和技能进行实验设计或处理
这类试题的特点多是利用给出装好药品的单个实验装置,根据实验要求进行正确连接,或给出全部或部分实验环节,根据实验要求安排正确的实验步骤或补充实验。主要用于考查考生实验综合能力和评价能力。
由以上分析不难看出,尽管涉及到的知识和能力点是分散的,但高考试题中实验考查的内容和形式是较为稳定的,这给实验复习中突出重点提供了可能。实验复习可根据考纲和上述几方面内容设计一定的专题加以重点复习,这样就会起到事半功倍的效果。
知识点拨
化学实验的复习是整个化学总复习中一个非常重要的环节。实验复习必须有的放矢、突出重点。这个“的”就是“考试说明”所规定的考查内容,而重点就是历年来高考试题中所反映的考试内容。
1、实验复习必须集中和分散相结合,提高重要实验的复现率
“集中”,就是集中复习实验的基本操作和技能,集中复习一些综合性的实验专题,集中归纳总结实验知识。而“分散”则是指一些性质实验、制法实验、验证或探索性实验等应分散到元素化合物、有机物、基本理论等的复习过程中去。通过实验,进一步理解元素化合物等知识,进一步理解相关的实验原理,提高运用实验手段解决化学问题的能力,节省复习时间,提高考试成绩。
2、训练发散思维以增强实验设计能力,提高信息迁移水平
实验方案的设计往往有许多途径。为了适应中学生的知识能力水平,中学课本中的某些实验可能不是最优的方案。所以在实验复习中要根据实验原理来设计实验步骤和装置,掌握一些装置和仪器药品的替代方法,力求使设计的实验仪器简单、操作便捷、节省试剂、现象明显、安全防污等,培养和增强实验设计能力和创造性思维能力。近年来,实验题中新情境试题不断增多,这类试题的特点是将基本的实验操作设计置于新的情境中(主要是中学课本没有的新反应或新装置或是能使中学生理解的最新科技知识、简化的改进的装置等),结合学生原有的知识和能力,来进行仪器组装、现象描述、数据分析、考虑安全和防污等,用来考查考生自学能力、思维能力、分析综合及评价的能力。由于这类实验试题情境新颖、设问巧妙、铺垫得当、知识新、思维量大、所以区分度很好,能确实将一些基础扎实、自学能力强、思维敏捷、心理素质好的考生选拨出来。所以,新情境实验试题将是今后实验试题的命题方向。
典型例题
例1、某学生根据高中课本中硝酸钾受热分解的实验操作来判断硝酸铅的分解产物之一是氧气;将试管中的硝酸铅加热到熔融,把带有火星的细木条伸进试管口,检验放出的气体,当发现木条复燃时该学生即断言,硝酸铅受热分解有氧气放出。请你对上述实验及结论的合理性作出评价。如有必要,可提出改进的实验方案。
例2、研究某一化学反应的实验装置如下图所示:
 |
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A ,B ,C ,D ,E ,F 。
2、写出有关的化学方程式:
A与B ;C与D ;
E与无水硫酸铜 ;F与Mg ;
F与Mg的反应产物与水 。
知识过关
1、实验室有一包 KCl和 AlCl3的固体混合物,通过以下实验可确定 KCl和 AlCl3的质量之比,试根据实验方法和主要步骤,回答有关问题:
(1)调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向旋动。
(2)某学生用已知质量为 y g的表面皿准确称取 W g样品,他在托盘天平的右盘上放上(W+y)g的砝码,在左盘的表面皿中放入样品,此时指针稍偏右边,该学生应怎样操作 ;
 (3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(3)将样品置于烧杯中加适量水溶解,滴入过量的A溶液,烧坏中有沉淀物,则A溶液的名称是
;
(4)过滤,某学生欲用右图装置操作,错误之处应怎样纠正?
答: ;
(5)甲学生用水多次洗涤过滤所得沉淀物,然后使其干燥,得到固体纯净物C,质量为W2g,C的名称是 ;
(6)乙学生将过滤所得滤液跟甲学生洗涤沉淀所得液体混合,然后蒸干溶剂,再充分加热,最后得到纯净KCl固体W1g,则原混合物中KCl与AlCl3的质量之比的计算式为 。
2、实验室利用乙醇脱水制备乙烯的步骤如下;
①在一蒸馏烧瓶中加人95%的乙醇和浓硫酸(体积比为l:3),再加入少量干净的河沙;
②瓶口插上带塞的温度计;
③加热并迅速使反应温度上升到170℃;
④气体通过稀NaOH溶液进行洗气后,用酸性KMnO4溶液检验乙烯的还原性。
据此回答下列问题:
(1)步骤①中混合乙醇和浓硫酸时应注意的问题是 。
(2)在反应液中加入河沙的原因是 。
(3)步骤②中温度计水银球的正确位置是 。
(4)加热时,使反应液温度迅速升高到I7O℃的原因是 。
(5)步骤④中.用稀NaOH溶液洗涤气体,能除去可能伴随乙烯生成的气体是 。
3、欲制无水氯化铝并保存备用。现有仪器如下图所示,并有食盐晶体、水、固体烧碱、铝粉、二氧化锰、浓硫酸等六种试剂。

设计的制取过程是:制氯气 → 加净化和干燥氯气 → 制氯化铝
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(不一定填满),并写出各仪器里放入的试剂的化学式。
仪器编号 、 、 、 、 ;
放入试剂 、 、 、 、 。
(2)写出实验过程中有关反应的化学方程式。
4、实验室用Zn粒和盐酸反应制H2,其中含酸雾、水气、硫化氢及少量氧气等杂质气体,某同学设计了以下几种装置,按一定顺序连接,气体通过时,达到每一装置除去一种气体的目的。
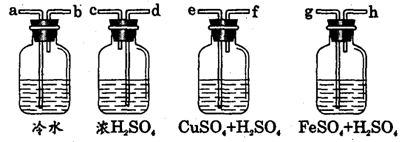 |
(1)它们连接的顺序为 ;
(2)除去H2S的离子方程式为 ;
(3)除去O2观察到的现象为 。