高三化学试题8
第Ⅰ卷
可能用到的数据
原子量
H 1 C 12 N 14 O 16 Na 23 Mg 24 P 31 S 32 Cl 35.5
Ca 40 Ba137
一、选择题(本题包括5小题,每小题2分,共10分.每小题只有一个选项符 合题意.)
1.下列物质中属于纯净化合物的是
(A)福尔马林 (B)干冰 (C)凡士林 (D)石墨
![]()
(A)Fe(OH)3溶液与硅酸胶混和将产生凝聚现象
(B)Fe(OH)3胶体粒子在电场影响下将向阳极运动
(C)Fe(OH)3胶体微粒不停地作布朗运动
(D)光线通过Fe(OH)3溶胶时会发生丁达尔现象
3.既有离子键又有共价键和配位键的化合物是
(A)NH4NO3 (B)NaOH (C)H2SO4 (D)H2O
4.在炼铁、制玻璃和制水泥三种工业生产中,都需要的原料是
(A)生石灰 (B)石灰石 (C)石英 (D)纯碱
5.下列所述情况可能引起水污染的是:①城市生活污水的任意排放;②农业生产中农药、化肥使用不当;③海上油轮石油泄漏;④工业生活中废液、废渣、废气的排放
(A)只有①③ (B)只有①④ (C)只有②④ (D)①②③④
![]()
选项符合题意.若正确答案只包括一个选项,多选时,该小题0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分.但只要选错一个,该小题就为0分.)
6.元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的分子式为
(A)Y3X2 (B)X2Y3 (C)X3Y2 (D)Y2X3
7.能够使醋酸溶液的pH值和醋酸的电离度都减小的是
(A)滴加少量H2SO4溶液 (B)加入少许水稀释
(C)滴加少量NaOH溶液 (D)加入少许CH3COONa晶体
8.下列各组中的两种物质通常都可作为还原剂使用的是
(A)SO2、H2SO4 (B)Cl2、FeCl3
(C)H2、CO (D)Br2、HNO3
9.能正确表示下列反应的离子方程式是
(A)碳酸钙跟醋酸反应 CaCO3+2H+=Ca2++H2O+CO2↑
(B)铁跟稀盐酸反应 Fe+2H+=Fe2++H2↑
(C)碘化钾溶液跟适量溴水反应 I-+Br2=2Br-+I
(D)铁跟硫酸铜溶液反应 Cu2++Fe=Fe2++Cu
10.下列物质跟氢氧化钠溶液不能发生反应的是
(A)Mg(OH)2 (B)Al(OH)3 (C)CO (D)SO2
11.中和相同体积相同、pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则
(A)V3>V1=V2 (B)V3>V2>V1 (C)V1>V2>V3 (D)V3<V1=V2
12.下列方法可用于制备卤化氢气体的是
(A)NaCl与浓硝酸加热制备HCl (B)NaF与浓硫酸加热制备HF
(C)NaBr与浓磷酸加热制备HBr (D)NaI与浓硫酸加热制备HI
13.在某无色透明溶液中,三种离子能大量共存的是
![]()
![]()
14.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是
(A)酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
(B)锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液
(C)滴定时,没有逐出滴定管下口的气泡
(D)读数时,视线与滴定管内液体的凹液面最低处保持水平
15.R代表第三周期元素,若它的原子最外电子层上只有一个不成对电子,则关于R的正确说法是
(A)常温常压下,R的单质都不能跟水剧烈作用
(B)常温常压下,R的单质中有的可能是强氧化剂
(C)R的氧化物中,有的可能是两性氧化物
(D)R的氧化物的分子式一定是R2O
![]()
符合题意.)
16.下列关于氧化物的叙述正确的是
(A)酸性氧化物均可跟碱起反应
(B)酸性氧化物在常温常压下均为气态
(C)金属氧化物都是碱性氧化物
(D)不能跟酸反应的氧化物一定能跟碱反应
17.A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解
②电解摩尔浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)
(A)A>B>C (B)B>C>A (C)C>A>B (D)B>A>C
18.钢铁在潮湿空气中发生电化腐蚀时,正极发生的主要反应是
(A)Fe-2e=Fe2+ (B)2H2O+O2+4e=4OH -
(C)4OH --4e=2H2O+O2 (D)2H++2e=H2
19.将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是
(A)FeS (B)Fe2O3 (C)FeCl3 (D)Fe2(SO4)3
![]()
![]()
(A)加压时(体积变小),将使正反应速度增大
(B)保持体积不变,加入少许NO2,将使正反应速度减小
(C)保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
(D)保持体积不变,升高温度,再达平衡时颜色变深
21.不用其它试剂,限用化学方法区别下列两组内的四瓶溶液
①NaOH、NaCl、AgNO3、NH3·H2O
②NaCl、MgCl2、Al2(SO4)3、NH4Cl
(A)只有①组可以 (B)只有②组可以
(C)两组均可以 (D)两组均不可以
22.根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序
I2+SO2+2H2O=H2SO4+2HI
2FeCl2+Cl2=2FeCl3
2FeCl3+2HI=2FeCl2+2HCl+I2
(A)I->Fe2+>Cl->SO2 (B)Cl->Fe2+>SO2>I-
(C)Fe2+>I->Cl->SO2 (D)SO2>I->Fe2+>Cl-
23.已知维生素A的结构简式如下,关于它的正确说法是
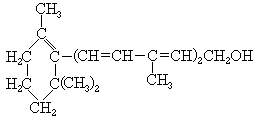
(A)维生素A是一种酚
(B)维生素A的一个分子中有三个双键
(C)维生素A的一个分子中有30个氢原了
(D)维生素A具有环已烷的结构单元
24.已知元素X的原子序数小于元素Y的原子序数,X、Y间形成的常见化合物的分子式可表示为:Y2X,Y2X2.则这两种元素的原子序数之和等于
(A)16 (B)17 (C)18 (D)19
25.将空气与CO2按5:1体积比混和,跟足量的赤热焦炭充分反应,若反应前后的温度相同,则在所得气体中,CO的体积百分含量为(假设空气中氮、氧体积比为4:1,其它成分可忽略不计)
(A)29% (B)43% (C)50% (D)100%
第Ⅱ卷
可能用到的数据
原子量H 1 C 12 N 14 O 16 Na 23 Mg 24 P 31 S 32 Cl 35.5
Ca 40 Ba137
四、(本题包括2小题,共17分)
26.(6分)根据从草木炭中提取钾盐的实验,填写下列空白:
(1)此实验操作顺序如下:①称量样品,②溶解沉降,③ ,④ ,⑤冷却结晶.
(2)用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示(填下列正确选项的代码) .
(A)左盘重,样品轻 (B)左盘轻,砝码重
(C)右盘重,砝码轻 (D)右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是由于 .
(4)在进行第④步操作时,要用玻璃棒不断小心地搅动液体,目的是防止 .
(5)所得产物中主要的钾盐有 、 、
等(填化合物分子或名称).
27.(11分)(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是: .
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
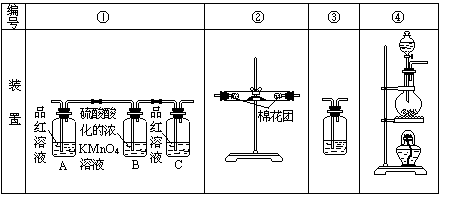
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):
→ → → .
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是 ,B瓶溶液的作用是 .
C瓶溶液的作用是 .
(4)装置②中所加的固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是 .
(5)装置③中所盛溶液是 ,可验证的产物是 .
五、(本题包括5小题,共18分)
28.(2分)磷酸二氢钙溶液跟足量NaOH溶液反应生成磷酸钙沉淀.写出配平的化学方程式.
29.(3分)1摩氢气燃烧时约放热286千焦,而每千克汽油燃烧时约放热46000千焦.氢气被公认是21世纪替代矿物燃料的理想能源.试简述氢气作为能源的三个主要优点:(1)
(2) (3) .
30.(3分)0.1摩/升Na2CO3溶液中,三种阴离子摩尔浓度由大到小的顺序为: > > .
31.(4分)在某温度下,一定量的元素A的氢化物AH3,在一定体积的密闭容器中可完全分解成两种气态单质,此时压强增加了75%.则A单质的一个分子中有 个A原子,AH3分解反应的化学方程式是 .
32.(6分)三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-.
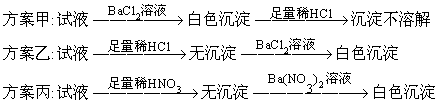
试评价上述各种方案是否严密,并分别说明理由.
六、(本题包括3小题,共17分)
33.(4分)写出用下列化合物作为单体聚合生成的高分子化合物的结构简式(将答案填在横线上):
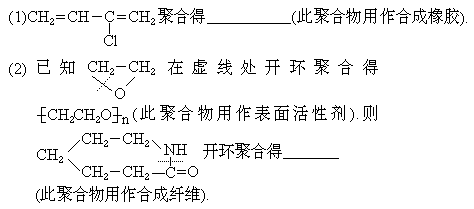
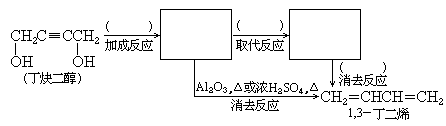
4.(5分)由丁炔二醇可以制备1,3-丁二烯.请在下面这个流程图的空框中填入有机产物的结构简式,在括号中填入反应试剂和反应条件.
35.(8分)羧酸A(分子式为C5H10O2)可以由醇B氧化得到.A和B可以生成酯C(分子量172).符合这此条件的酯只有4种.请写出这4种酯的结构简式.
七、(本题包括2小题,共18分)
36.(6分)常温下,将20.0克14.0%的NaCl溶液,跟30.0克24.0%的NaCl溶液混和,得到密度为1.15克/毫升的混和溶液.计算:
(1)该混和溶液的质量百分比浓度;
(2)该溶液的摩尔浓度;
(3)在1000克水中需溶入多少摩NaCl,才能使其浓度恰与上述混和溶液的浓度相等.
37.(12分)某学生对久置于空气中已部分变质的CaO取样分析,实验如下:取10.00克样品高温灼烧,将生成的气体全部通入足量的Ba(OH)2溶液中,得到3.94克沉淀;另取1.00克样品,加入40毫升1.0摩/升稀盐酸,充分反应后稀释后500毫升.从中取出25毫升溶液,以0.020摩/升NaOH溶液中和其中过量的盐酸,用去23毫升NaOH溶液.试计算样品中各种物质的质量百分组成.
试题答案及评分标准
湖南、云南、海南三省用题
一、(本题包括5小题,每小题2分,共10分)
1.B 2.B 3.A 4.B 5.D
二、(本题包括10小题,每小题3分,共30分)
6.A 7.A 8.C 9.B、D 10.A、C
11.A 12.B、C 13.C、D 14.B、D 15.B、C
(每小题有1个或2个选项符合题意.对于正确答案只包括1个选项的:只选1项且选对者给3分;其它选法,该小题均为0分.对于正确答案包括2个选项的:只选2项,且全选对者给3分;只选1项且选对者给1分;其它选法,该小题均为0分.)
三、(本题包括10小题,每小题4分,共40分)
16.A 17.D 18.B 19.A 20.B
21.A 22.D 23.C 24.D 25.C
四、(本题包括2小题,共17分)
26.(6分)
(1)过滤、蒸发 (1分)
(2)(B) (2分)
(3)滤液浑浊 (1分)
(4)液体飞溅 (1分)
(5)KCl、K2SO4、K2CO3 (1分)
(答对2个为0.5分,只答对1个为0分)
27.(11分)
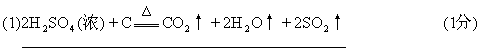
(在水的分子式H2O后不注↑的不扣分)
(2)④→②→①→③ (2分)
(错1个编号为0分)
(3)验证产物气流中有SO2 (1分)
将产物气流中SO2全部氧化吸收 (1分)
确认产物气流中SO2已被B瓶溶液全部吸收 (1分)
(4)无水硫酸铜(或变色硅胶),水气 (每空1分,共2分)
由于产物气流通过①、③时会带出水气,所以②必须在①、③之前 (1分)
(5)澄清石灰水(或其他合理答案),CO2(二氧化碳)
(每空1分,共2分)
五、(本题包括5小题,共18分)
28.(2分)3Ca(H2PO4)2+12NaOH=Ca3(PO4)2↓+4Na3PO4+12H2O) (2分)
29.(3分)
(1)来源丰富 (1分)
(2)单位质量的氢燃烧时发热量大 (1分)
(3)燃烧后不产生污染(意思正确均给分) (1分)
![]()
31.(4分)
A4 4AH3=A4+6H2 (每空2分,共4分)
(若答案中将A写成P或As,都可当作A,同样给分)
![]()
透明溶液,也会出现此方案的现象 (2分)
![]()
(2分)
![]()
此方案的现象 (2分)
(每个方案分析2分,其中判断1分,理由1分.其它合理的分析也给分).
六、(本题包括3小题,共17分)
33.(4分)
![]()
(每空2分,共4分)
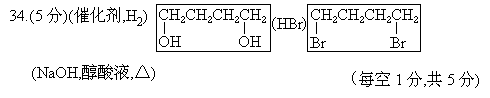
注:不写HBr,而是写HCl,HX,1,4-二溴丁烷写成二氯,二X丁烷都是对的.但是从第1个错误答案起,后面均不给分.
35.(8分)CH3CH2CH2CH2COOCH2CH2CH2CH2CH3、
(CH3)2CHCH2COOCH2CH2CH(CH3)2、
![]()
(每空2分,共8分)
七、(本题包括2小题,共18分)

x=4.27(摩) (2分)
37.(12分)判定CaO样品中可能含有Ca(OH)2和CaCO3(各1分,共2分)

设0.80克中含x克CaO,含(0.80-x)克Ca(OH)2,
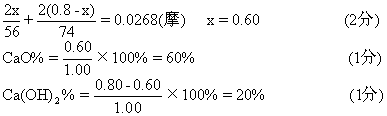
[说明]
1.第1个采分点共2分,若开始时没有作出判定,但在解题过程中表明样品中含有CaCO3和Ca(OH)2,该采分点同样给分.
2.本题第4个采分点共4分,可分段给分如下:计算盐酸的总物质的量,应扣除的NaOH的物质的量、CaCO3消耗的盐酸物质的量各给1分,答案[0.0268(摩)]给1分.