高 三 化 学(第24周)
【高三化学第一学期期末考试试题】
一、选择题(本题包括5小题,第小题3分,共15分,每小题只有一个选项符合题意)
1. 当前,我国环境保护急待解决的白色污染问题指的是 ( )
A 白色建筑废料 B 纸张的大量浪费
C 粮食产品大量使用的漂白剂 D 塑料制品废弃物
2. 下列各组变化中,前者是物理变化,后者是化学变化的是 ( )
A 胶体的电泳、活性炭吸附有色物质 B 油脂的硬化、石油裂化
C 萘升华、石蕊试液变色 D 蛋白质变性、冰熔化
3. 下列有关物质的性质比较中,正确的是 ( )
A 热稳定性:![]() B 酸性
B 酸性![]()
C 导电性:![]() D 熔点
D 熔点![]()
4. 在相同温度下,PH=4的硫酸溶液和PH=10的NaOH溶液,其水的电离度分别为![]() 和
和![]() ,则
,则![]() 和
和![]() 的关系为
( )
的关系为
( )
A ![]() B
B ![]() C
C ![]() D 无法确定
D 无法确定
5. 下列贮存药品的方法错误的是 ( )
A 氨水可贮存在无色试剂瓶中 B 氢氟酸可盛放在密封的瓷瓶中
C 硝酸银必须盛放在棕色瓶中 D 少量白磷可保存于水中
二、选择题(本题包括12小题,每小题3分,共36分。每小题有一个或二个选项符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1份,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6. 所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| Na | Cu | Al | Fe | |
| 熔点 | 97.5℃ | 1083℃ | 660℃ | 1535℃ |
| 沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
其中不能形成合金的是( )
A Cu和Na B Fe与Cu C Fe与Na D Al与Na
7. 下列物质不能同时倒入废液缸的是 ( )
A 氢氧化钡与盐酸 B 硫化锌与稀硫酸
C 硫酸钠与BaCl2溶液 D 浓盐酸和高锰酸钾
8. 以下分子或离子结构为正四面体且键角为![]() 的是
( )
的是
( )
①CH4 ②P4 ③CH3Cl ④SO42-
A ①②④ B ①③④ C ①④ D ②④
9. 将Wg NaCl与Wg98%的浓H2SO4混合,微热收集到m mol气体,再强热又收集到n mol气体,则m与n的关系是 ( )
A ![]() B
B ![]() C
C ![]() D 不能确定
D 不能确定
10. 有下列六种物质,①NO2和Br2②乙醛、苯、CCl4③硝铵、食盐、烧碱④重晶石、CaCl2、无水CuSO4⑤电石、生石灰、氮化镁⑥硫、Na2O2,只用水就能将它们一一区别开来的是( )
A ①④⑤⑥ B ①②③④⑤ C ②③④⑤ D 全部
11. 下列反应的离子方程式正确的是 ( )
A 碳酸钡与醋酸反应:![]()
B 向偏铝酸钠溶液中通过量CO2:![]()
C 向氯化铁溶液中通H2S:![]()
![]() D
向漂白粉溶液中通SO2:
D
向漂白粉溶液中通SO2:![]()
12.可逆反应: ,通入不参加反应的
水蒸气后,下列叙述正确的是
( )
A 在恒容过程中,平衡向正反应方向移动 B 在恒容过程中,平衡不移动
C 在恒压过程中,平衡向正反应方向移动 D 在恒压过程中,平衡不移动
13. 短用周期元素A、B、C原子序数依次逆增,它们原子的最外层电子数之和为10,A与C在周期表中位置相邻,B原子最外层电子数等于A原子次外层电子数,下列叙述正确的是 ( )
A 原子半径A<B<C
B A的氢化物的稳定性大于C的氢化物的稳定性
C B的氧化物的熔点比A的氧化物的熔点高
D A与C可形成离子化合物
14. 设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A 一个氧原子的质量为ag,则氧元素的原子量为aNA
B 在标准状况下,2g重氢气(D2)所占体积约为22.4L
C 0.1mol H218O2所含的中子数为2.0NA
D 1L 1.5mol·L-1的AlCl3溶液中含Al3+数为1.5NA
15. 已知分子为C10H14的烃,其一溴代物的同分异构体有四种,则该烃的结构简式可能是 ( )
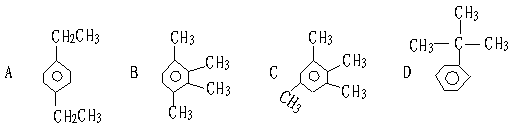 |
16. 下列既可以是原电池发生的电极反应,又可以是电解池发生的电极反应式的是( )
①![]() ②
②![]() ③
③![]()
④![]() ⑤
⑤![]() ⑥
⑥![]()
A ①③④ B ①②④⑥ C ②③④⑤ D ②④⑥
17. 将1.2g碳与下列物质完全反应可生成2.24L(标况)气体。该氧化物一定不是( )
A H2O B CuO C SiO2 D CO2
三、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意。)
18. 在恒温恒压下,合成氨反应达到平衡后,混合气体中氨气的体积分数为25%,则反应后的总体积是反应前总体积的 ( )
A ![]() B
B ![]() C
C ![]() D
D ![]()
19. O2、CO2、N2、Cl2各0.1mol,分别与足量镁粉充分反应,生成固体的质量依次为W1、W2、W3、W4,下列关系正确的是 ( )
A W1<W2<W3<W4 B W1<W2<W4<W3
C W1=W2<W4<W3 D W3<W4<W1<W2
20. 室温时,乙烷、乙炔、丙烯和H2的混合气体32mL(其中乙烷与丙烯的体积比为5:1)与过量的氧气混合点燃后,恢复到原来的温度和压强,气体体积缩小了72mL,原混合气体中丙烯的体积分数是 ( )
A 12.5% B 13.5% C 20% D 无法确定
21. 用惰性电极电解NaCl和CuSO4的混合液250mL,经过一段时间后,两极分别得到11.2L(标况)气体,则原混合液中NaCl物质的量浓度不可能为(mol·L-1) ( )
A 0.5 B 1 C 1.5 D 4
![]()
![]()
![]() 22. 在物质CH3—CH=CH—C C—CF3中,可能在同一平面上的原子数目最多为( )
22. 在物质CH3—CH=CH—C C—CF3中,可能在同一平面上的原子数目最多为( )
A 12 B 10 C 8 D 6
23. 已知反应![]() 能完全进行,则下列推断正确的有
( )
能完全进行,则下列推断正确的有
( )
A BeCl2溶液的PH<7,将其蒸干,灼烧后得残留固体Be(OH)2
B Na2BeO2溶液PH>7,将其蒸干灼烧得残留物为BeO
C Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D BeCl2水溶液导电性强,故BeCl2为离子化合物
24. 将4mol化合物A放入某密闭容器中,加热至t℃,存在以下两个平衡:
![]()
![]()
![]() 2A(s) 3B(g)+C(g),2C(g) D(g)+3B(g),这时测得容器中含0.5molC,2.4molB,则A的转化率是
( )
2A(s) 3B(g)+C(g),2C(g) D(g)+3B(g),这时测得容器中含0.5molC,2.4molB,则A的转化率是
( )
A 20% B 35% C 70% D 45%
25. 有一铁的氧化物样品,用5mol·L-1盐酸140mL恰好完全溶解,所得溶液还能吸收0.56L(标况)Cl2,Fe2+全部变成Fe3+,则该氧化物的化学式可能为 ( )
A Fe2O3 B Fe3O4 C Fe4O5 D Fe5O7
四(本题包括2小题,其17分)
26.(6分)化学实验具有一定的危险性,但如严格按照操作规定进行实验,危险也能变为安全。请回答下列问题:
(1) 在制取或使用Cl2、H2S、NO2、CO等有毒气体时,必须在 _____中进行。
(2) 在制乙烯时,在大试管里倒入酒精和浓H2SO4的混合液,加热时可能会发生 _______
事故,防止该事故发生的办法是 __________。
(3) 配制银氨溶液时为防止爆炸事故的发生,应注意 _________。
27.(11分)在75℃左右,用HgSO4做催化剂,乙炔可水化为乙醛,但HgSO4遇到某些特定物质常会发生催化剂中毒而失去催化作用。现用乙炔水化合,只用块状电石、浓H2SO4、水、CuSO4溶液、NaOH溶液、氧化汞粉末等物质制乙醛,可选用的主要仪器如下表所列(其它玻璃导管和胶管省略。)
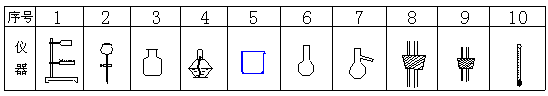 |
请回答以下问题:
(1)组装乙炔气体发生装置可选用仪器序号为 ____________
组装制乙醛的发生器,应选用仪器序号为 ____________
(2)若要防止催化剂中毒,应采取的措施是 _______________
(3)要使反应在75℃条件下进行,所采取的操作方式叫 ____________,它们主要应用范围是 ______________
(4)在乙醛发生器中加入的药品及顺序为 ___________________
(5)实验中吸收乙醛的试剂为 ________,检验乙醛已制出的操作、现象是 ___________。
五、(本题包括3小题,共18分)
28.(4分)H2、C是工业上常用的还原剂,Na2S是工业上有较多用途的一种水溶性硫化物,常用Na2SO4与过量的碳或H2在高温下反应制取Na2S。写出制取Na2S的这两个反应的化学方程式 ___________________; ______________________
29.(8分)有一种稀有气体化合物六氟铂酸氙XePtF6,研究报告指出:“关于XePtF6的电价有Xe2+[PtF6]2-、Xe+[PtF6]-两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入RbF可得到RbPtF6;加入CSF可行到CSPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答:
(1)XePtF6中各元素的化合价分别是 ____、 _____、 _____
(2)XePtF6是 ______(离子、共价)化合物
(3)写出Xe与PtF6反应生成XePtF6的反应式是 ___________________.
而且O2与PtF6可发生类似的反应,其反应式是 ____________________。
上述两反应属( )
A 均为氧化还原反应 B 前者为氧化还原反应,后者为非氧化还原反应
C 均为氧化还原反应
30.(6分)
A、B、C、D四种短周期元素;原子序数依次增大,它们的单质在一定条件下都能与水反应。A与水反应的产物都是气体;1molB与水反应产生0.5mol气体F;1molC与水反应产生0.5mol气体E;E、F相化合生成水;D与水反应生成两种酸。则
(1)B单质与水反应的化学方程式为 ____________
(2)C与D所形成的化合物,其晶体的微粒间以 _______相结合,一个D的微粒周围最
近距离上有 _____个C的微粒。A与D所形成的化合物,其晶体的微粒以 ______相结合。
(3)四种元素中,最高价氧化物的水化物酸性最强的是 ________(填化学式)
六(本题包括3小题,共18分)
31. 烯烃与有机过酸可以加成,得环氧化合物,此反应被称为环氧化反应,如:
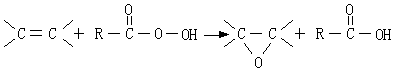
所得的环氧化合物可进一步与羧酸反应,生成相应的羟基酯:
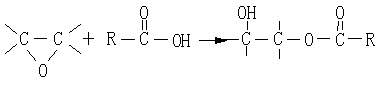 |
请写出以乙烯和过乙酸为原料,合成乙二醇的化学反应方程式。
32. 下图中A—F都是含苯环的化合物,其中化合物A在不同条件下可自相反应,化合物F是香烟中存在一种含有羰基的化合物,其分子为C13H8O,该有机物分子中有两个苯环和一个由五个碳原子组成的环,但羰基不在苯环上。
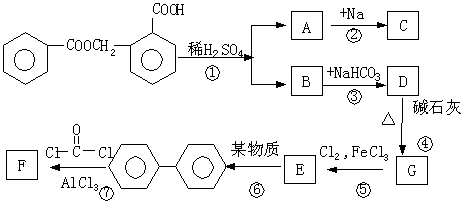 |
请回答下列问题:
(1)写出下列有机物的结构简式:C ________;F ___________
(2)写出④的化学方程式 ____________________
(3)上述反应属于取代反应的有 _______________(填序号)
![]()
![]() O
O
33. 已知(1)烯键经臭氧氧化,再用Zn与水还原,可得到含—C—的化合物,如:
![]()
![]()
![]()
|
![]()
![]()
![]()
![]() R—CH=C
RCHO+R'—C —R''
R—CH=C
RCHO+R'—C —R''
|
![]()
![]() O
O
(2)酰卤极易与水反应,如:R—C—X+H2O→R—COOH+HX
某高分子化合物(C4H5Cl)n发生如下转化:
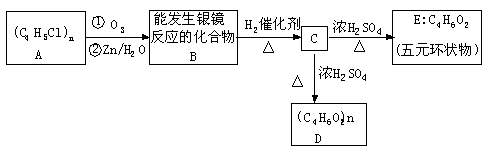 |
(1) 写出A、E的结构简式:A __________ E ___________
(2) 写出B转化为C的化学方程式 _____________________
(3) 写出C转化为D的化学方程式 _______________________
七、(本题包括2小题,共15分)
34.(6分)现有碳酸钠和碳酸氢钠的混合物6.85g,加热灼烧后,再跟足量的盐酸反应,放出1.12L CO2(标况),计算原混合物里Na2CO3和NaHCO3各占多少克?
35.(9分)向a mol NaOH溶液中逐滴加入b mol AlCl3溶液,试回答:
(1)依次写出溶液中发生反应的化学方程式 ________________________
(2)若a+b=1,当a取不同值时,生成物可能有如下情况:
①全部是Al(OH)3,a的取值范围是 ___________
②全部是NaAlO2,a的取值范围是 ___________
③部分是NaAlO2,部分是Al(OH)3,a的取值范围是 ________,反应所生成的Al(OH)3的物质的量为 _____ mol,反应所生成的各物质的总物质的量(包括水)为 _____mol(用含b的式子表示)
④在上述条件下,若要生成7.8g沉淀,则a的值等于 _____或 _____。
【第一学期期末考试高三化学试题答案】
一、二、三题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| D | C | A | C | B | AC | BD | C | B | D | BC | BC | BC |
|
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | |
|
| CD | A | AD | C | B | A | D | B | C | B | D |
四、26.(1)通风橱 (2)暴沸冲出、碎瓷片
(3)①不能加入过量氨水 ②不能久置,要随配随用。
27.(1)①②⑧⑥ 或 ①②⑦⑨ 或 ②③⑧;
①④⑤⑦⑨⑩ 或 ①④⑤⑥⑧⑩
(2)在乙炔与乙醛发生装置之间连接一个盛有CuSO4溶液的洗气瓶
(3)水浴加热 ≤100℃需加热的操作
(4)HgO、水、浓H2SO4
(5)水,取吸收液加入新制Cu(OH)2中加热,有红色沉淀生成
28. ![]()
![]()
29. (1)+1、+5、-1 (2)离子
(3)Xe+PtF6=XePtF6 (4)O2+PtF6 = O2PtF6, A
30. (1)![]()
(2)离子键,b,分子间作用力 (3)HClO4
![]()
![]() O
O
![]()
![]() 31. CH2=CH2+CH3—C—O—OH→CH2—CH2+CH3COOH
31. CH2=CH2+CH3—C—O—OH→CH2—CH2+CH3COOH
O
![]()
![]() O
O
![]()
![]()
![]() CH2—CH2+CH3COOH→CH2—CH2—O—C—CH3
CH2—CH2+CH3COOH→CH2—CH2—O—C—CH3
O OH
![]()
![]() O
O
|
OH OH OH
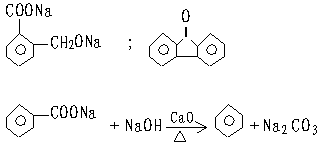 |
|
(2)
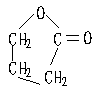 (3)①②③④⑤⑥⑦
(3)①②③④⑤⑥⑦
![]()
![]()
![]() 33.(1)[CH2—CH=C—CH2] n,
33.(1)[CH2—CH=C—CH2] n,
Cl
![]()
![]() O
O
![]()
|
![]()
![]() OH
O
OH
O
![]()
![]()
![]()
|
OH
七、34. Na2CO3 : 2.65g NaHCO3 : 4.2g
35.(1)![]()
![]()
(2)①![]() ②
②![]()
③![]() ,5b-1,2-4b
,5b-1,2-4b
④ 0.3mol或0.78mol.