高三化学计算综合练习(三)
可能用到的相对原子质量: H: 1 O: 16 C: 12 N: 14 F:19 Cl: 35.5 Br:80
Na: 23 Mg: 24 Al:27 K:39 Cu:64 Ca:40 Fe:56 Zn:65 Ba:137 Ag:108
一、选择题(下列各题只有1个选项符合题意。每小题2分,共16分。)
1.NA表示阿伏加德罗常数的值,下列说法正确的是
A.53gNa2CO3固体含有的CO32-离子数为0.5 NA
B.0.5mol氖气含有的原子数为NA
C.常温常压下,11.2L氧气含有的分子数为0.5 NA
D.1molNa2O2与水充分反应后转移的电子数为2NA
2.设阿伏加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m克含有b个分子,则n克该混合气体在相同状况下所占的体积(单位L)应是
A.22.4mb/NA B.22.4nb/mNA C.22.4nNA/mb D. nbNA/22.4m
3.标准状况下,一个装满氯气的容器质量为74.6 g,若装满氮气质量为66 g ,则此容器的容积为
A.22.4 L B.44.8 L C.1.12 L D.4.48 L
4.有Wg浓度为15%的NaNO3的溶液,若想将其浓度变为30%,不可采取的方法是
A.蒸发掉溶剂的1/2 B.蒸发掉W/2 g溶剂
C.加入3/14 W gNaNO3 D.加入W g45%的NaNO3溶液
5.将1L C3H8与aL O2混合起来点燃,C3H8完全反应后所得混合气体的体积为bL(气体的体积均在120℃、101Kpa时测定),使得bL混合气体通过足量的碱石灰,知气体的体积为 cL。若b-c=6,则a值为
A.4.3 B.4.5 C.5.0 D.6.0
6.中和相同体积、相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则
A.V3>V1=V2 B.V3>V2>V1 C.V1>V2>V3 D.V3<V1=V2
7.0.6molCu2S与足量稀HNO3反应,生成物为Cu(NO3)2、H2SO4、NO、H2O,则被还原和未被还原的HNO3的物质的量分别为
A.0.6mol、0.3mol B.1.2mol、0.6mol C.2mol、0.6mol D.2mol、2.4mol
8.有n mol金刚石中,含C—C非极性键数是
A.2n×6.02×1023 B.n×6.02×1023
C.4n×6.02×1023 D.8n×6.02×1023
二、选择题(下列各题只有1个选项符合题意。每小题3分,共30分。)
9.t℃时在一烧杯中盛有一定量KCl溶液,若向该溶液中加X g KCl晶体,充分搅拌后仍有Y g晶体末溶:若将原溶液加热蒸发掉Z g水,再冷却到t℃,溶液恰好达到饱和.则t℃时KCl的溶解度为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
10.在标准状况下,将CO和CO2的混合气体(体积比为3:1)充满一容积为22.4L且盛有足量的Na2O2密闭容器中,用间断的电火花引发到反应完全。下列对容器里最后存在的物质及其物质的量的判断均正确的是(忽略固体物质占有的体积)
A.存在0.5molNa2CO3,0.25molCO B.存在0.125molO2, ,1mol Na2CO3
C.存在0.5molCO, 0.5molNa2CO3 D.存在0.75molNa2CO3,0.25molCO
11.将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)==2C(g),若经2s(秒)后测得C的浓度为0.6mol·L-1,现有以下几种说法,其中正确的是
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
A.①② B.①④ C.③② D.③
12.将2.3 g钠与另一种金属元素组成的合金放入足量盐酸中,完全反应时收集到1.13 L H2(标准状况),则另一种金属可能是①K ②Mg ③Al ④Li ⑤Rb ⑥Fe
A.①⑤⑥ B.①⑤ C.②③④ D.①②③④
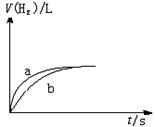 13.一定质量的Na、K分别投入一定量的稀盐酸中(Na、K均反应完全),在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是
13.一定质量的Na、K分别投入一定量的稀盐酸中(Na、K均反应完全),在相同条件下产生氢气的体积随时间变化的曲线如图中a、b所示,则下列说法中不正确的是
A.投入的Na、K物质的量一定相等
B.曲线a对应的反应使用了催化剂
C.曲线a代表K的反应,曲线b代表Na
D.盐酸中氯化氢可以是足量的也可不足量
14.在15gFe和Fe2O3的混合物中,加入稀硫酸200mL,放出标准状况下的H21.68L,反应停止后,溶液中无Fe3+.为中和过量的硫酸,并使Fe2+完全转化为Fe(OH)2沉淀,共用去3mol·L—1NaOH溶液200mL,则稀硫酸的物质的量浓度为
A.6.0mol·L—1 B.3.0 mol·L—1 C.1.5 mol·L—1 D.1.0 mol·L—1
15.已知甲、乙溶质质量分数与密度的关系如下表:
| 溶质质量分数 | 甲溶液密度(g/cm3) | 乙溶液密度(g/cm3) |
| 1% | 0.95 | 1.02 |
| 5% | 0.92 | 1.04 |
| 10% | 0.90 | 1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合后,下列叙述正确的是
A.混合后甲、乙溶液质量分数均大于5%
B.混合后乙溶液质量分数大于5%,甲溶液质量分数小于5%
C.混合后甲溶液质量分数大于5%,乙溶液质量分数小于5%
D.混合后甲、乙溶液质量分数均等于5%
16.电解普通水和重水的混合物,通电一定时间后,两极共生成气体18.5g,其体积为33.6L(标况),在所生成的气体中重氢和普通氢的原子个数比为
A.2:3 B.2:5 C.1:2 D.1:3
17.1L1.00mol·L-1的纯碱溶液逐滴加入到1L1.25mol·L-1的盐酸中;再做相反操作:将1L1.25mol·L-1的盐酸逐滴加入到1L1.00mol·L-1的纯碱溶液中,两次操作在同温同压下产生气体的体积比是
A.2:5 B.5:2 C.2:1 D.1:1
18.碱金属溶于汞可形成良好的还原剂“汞齐”。取某种碱金属的汞齐46g投入足量水中产生2.24L气体(标准状况),并得到密度为ρg/cm3的溶液1L,则该溶液中溶质的质量分数为
A.1.12/ρ% B.0.8/ρ% C.0.48/ρ% D.0.24/ρ%
三、简答填空(30分)
19.(9分)(1)脂肪烃CnHm分子中,碳原子与碳原子之间共用电子对数为__________(用含n 、m的式子表示)。
(2)若将Cn看作烃完全失去氢原子后的产物,则C60分子中碳碳原子间共用电子对数为__________________。
(3)对不同系列的脂肪烃CnHm而言,分子中碳碳原子间共用电子对数不确定,则H原子数(m)的取值范围是_____________(碳原子数用n表示)。
20.(9分)298K时,向VL真空容器内通入n mol SO2和m mol H2S。
⑴若n=2,则当m= 时,反应后容器内气体的密度最小;
⑵若2n>m,则反应后氧化产物与还原产物的质量差为 g;
⑶若5n=m,且反应后氧化产物与还原产物的质量和为48g,则n+m= 。
21.(12分)合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)。
(1)1m3(标准状况)CH4按上式完全反应,产生H2 mol。
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)。设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如右表所示,计算该富氧空气中O2和N2的体积比V(O2)/V(N2)= 。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为 。
四、分析推理(8分)
22.(8分)准确移取25.00mL某未知浓度的盐酸溶液于一洁净锥形瓶中,然后用0.20 mol/L NaOH溶液滴定(指示剂为酚酞)。滴定结果如下:
| NaOH溶液起始读数 | NaOH溶液终点读数 | |
| 第一次 | 0.01Ml | 18.60mL |
| 第二次 | 0.20Ml | 18.00mL |
(1)根据以上数据可计算出盐酸的物质的量浓度为______________mol/L。(精确到0.01)
(2)如标准NaOH溶液由于保存不妥而变质(和空气中CO2反应产生少量Na2CO3),测出的盐酸浓度__________(填“偏高”、“偏低”或“不变”)。
(3)若操作有误,则导致待测盐酸溶液浓度偏低的错误操作是____________(填序号)。
A.滴定管用蒸馏水洗后未用标准碱液润洗,直接装入标准碱液
B.滴定前滴定管尖端有气泡,滴后气泡消失
C.滴定管读数时,滴定前仰视滴定后俯视
D.待测液中指示剂酚酞(为有机弱酸)加得太多
(4)如果准确移取25.00mL 0.20mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?____________(填“是”或“否”)
五、数形结合问题(16分)
23.(6分)现将600 mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果(H2体积已折算为标准状况)。
| 实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
| Zn粒质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
| H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________________。
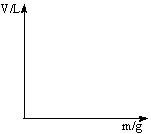 实验②收集到H2的体积为____________________。
实验②收集到H2的体积为____________________。
(2)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图象。
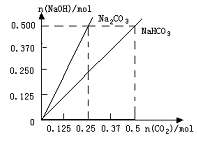 24.(10分)现有NaOH(s)、水、大理石和盐酸,制取33g纯NaHCO3。请参照物质的溶解度表回答下列问题:
24.(10分)现有NaOH(s)、水、大理石和盐酸,制取33g纯NaHCO3。请参照物质的溶解度表回答下列问题:
| 25℃ | 溶解度/g |
| NaOH | 110 |
| NaHCO3 | 9 |
| Na2CO3 | 30 |
(1)制取过程中反应的化学方程式为:
。
(2)若提供100g水则需NaOH的物质的量为 mol。
(3)简述实验的操作过程:
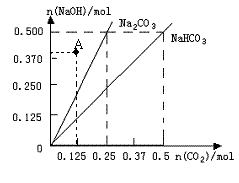
(4)在如图反映上述实验过程的图象中,标出A点(即当![]() 125mol时)的位置,此时所得盐及其物质的量为 。
125mol时)的位置,此时所得盐及其物质的量为 。
化学计算综合练习(三)参考答案
| 1 | A | 2 | D | 3 | B | 4 | A | 5 | B |
| 6 | A | 7 | D | 8 | A | 9 | C | 10 | B |
| 11 | B | 12 | C | 13 | B | 14 | C | 15 | B |
| 16 | D | 17 | B | 18 | C |
| |||
19.(1)(4n-m)/2 (2)120 (3)2≤m≤2n+2
20.⑴ 4 ⑵ 16m ⑶ 3
21.(1)133.9
(2)3m3<V<4m3
(3)设H2O为Xmol,O2为Ymol
则:![]() X=10 Y=7.5
X=10 Y=7.5
VO2/VH3=(7.5+2.5)/15=2/3
 (4)设富氧空气中O2的体积分数为a,反应用去的H2O(g)与富氧空气的体积分别为X、Y。
(4)设富氧空气中O2的体积分数为a,反应用去的H2O(g)与富氧空气的体积分别为X、Y。
(3X+4aY)/[(1-a)Y]=3/1 X/Y=1-7/3a
(用其它方法解得也给分)
22.(1)0.15(2)不变(3)C(4)是
23.(1)2.0 mol·L-1 2.76 L
(2)如右图所示。
24. (1)①NaOH+CO2=NaHCO3
 (2)0.5mol
(2)0.5mol
(3)称取20gNaOH放入烧杯中,缓缓加入100g H2O并不断搅拌,待充分溶解并冷却后,将由 大理石和HCl反应制得的CO2通入烧碱溶液中,直到沉淀不再增加为止,过滤,再用滤纸吸 干固体表面的水份。
(4)在图中标出点A(0.125,0.375) Na2CO3 ;0.125mol