高三第一次统一测试化学试卷
第Ⅰ卷(选择题 共72分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Cl 35.5 K 39 Fe 56
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
2、下列各组中两种浓溶液相混合时既无沉淀析出又无气体放出的是
A、Ba(HCO3)2 NaHSO4 B、NaHCO3 Al2(SO4)3
C、Mg(HCO3)2 CaCI2 D、Na2SiO3 HCl
3、在密闭容器中,对于反应2A(g)+ B(g)![]() 2C(g),A和B起始时分别为20mol和10mol,达到平衡时,A的转化率为80%。若从C开始进行反应,在相同条件下,欲使平衡时各成分的百分含量与前者相同,则起始时C的物质的量及C的转化率分别为
2C(g),A和B起始时分别为20mol和10mol,达到平衡时,A的转化率为80%。若从C开始进行反应,在相同条件下,欲使平衡时各成分的百分含量与前者相同,则起始时C的物质的量及C的转化率分别为
A、10mol,10% B、20mol,20% C、30mol,40% D、20mol,80%
4、HNO2的下列性质中,可以证明它是弱电解质的是
A、0.1mol·L-1HNO2溶液pH值约为2; B、用HNO2溶液作导电性实验,灯泡很暗
C、HNO2与NaCI溶液不反应; D、含0.1molHNO2和0.1molNaOH的两溶液恰好反应
5、12月1日是世界艾滋病日。2003年的主题是:相互关爱,共享生命。防治艾滋病是人类的一项重要研究课题,最近美国的《农业研究》杂志报道,半胱氨酸[HS-CH2-CH(NH2)-COOH]能增强艾滋病感染者的免疫力,对控制艾滋病毒的蔓延有奇效。下列有关叙述不正确的是
A、半胱氨酸属于α-氨基酸 B、HS-CH2-CH(NH2)-COONH4能与NaOH溶液反应放出氨气
C、半胱氨酸是一种两性物质 D、两分子HS-CH2-CH(NH2)-COOH不能脱水形成二肽
6、下列分子中所有原子都满足最外层8电子结构的是
(1)光气(COCI2) (2)六氟化硫 (3)三氯化磷 (4)二氯化铍
(5)二氧化碳 (6)三氟化硼 (7)五氯化磷 (8)四氟化氙
A、(1)(2)(3)(5) B、(3)(4)(5)(8) C、(1)(3)(5) D、(2)(3)(6)(8)
7、吸进人体内的O2有约2%转化为氧化性极强的活性氧副产物(如O![]() ),这些活性氧能加速人体衰老,被称为“夺命杀手”。人们尝试:①用含硒化合物Na2SeO3消除人体内活性氧;②在护肤品中加入SOD(超氧化物歧化酶),促使O
),这些活性氧能加速人体衰老,被称为“夺命杀手”。人们尝试:①用含硒化合物Na2SeO3消除人体内活性氧;②在护肤品中加入SOD(超氧化物歧化酶),促使O![]() 等转化为双氧水、氧气等,从而消除体内活性氧。在消除活性氧时,下列说法不正确的是
等转化为双氧水、氧气等,从而消除体内活性氧。在消除活性氧时,下列说法不正确的是
A、方法②护肤品中加入的SOD是消除体内活性氧的催化剂
B、方法②的反应可表示为:2O![]() +2H2O
+2H2O![]() H2O2 +O2 + 2OH-
H2O2 +O2 + 2OH-
C、方法①可取,因为Na2SeO3可作还原剂,且硒又是人体内的一种必需微量元素
D、方法①不可取,因为Na2SeO3不可作还原剂,且硒元素是对人体非常有害
8、在25℃时,向体积为V、pH=a的盐酸中滴加体积为10V、pH=b的NaOH溶液,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)为
A、15 B、14 C、13 D、不能确定
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确的选项只包括一个选项,多选时,该题为0分;若正确的选项包括两个选项,只选一个且正确的给2分,选两个且都正确的得4分,但只要选错一个,该小题为0分。)
9、一定温度下、用水稀释0.1mol·L![]() 氨水时,若用KW表示水的离子积,a表示氨水的电离度,则溶液中随水量的增加而减小的是( )
氨水时,若用KW表示水的离子积,a表示氨水的电离度,则溶液中随水量的增加而减小的是( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
10、过氧乙酸(CH3COOOH)具有很强的广谱杀菌作用,其0.3%-0.5%的溶液即可杀灭SARS病毒。下列关于过氧乙酸的说法不正确的是
A、过氧乙酸具有强氧化性 B、可用乙醇等有机溶剂配制
C、盛过氧乙酸的容器盖可留1-2个透气小孔
D、过氧乙酸分子中具有过氧键,性质与双氧水相似
11、在同温同压下,下列各组热化学方程式中,Q2>Q1的是
A、2CH3OH(l)+3O2(g)=4H2O(g) + 2CO2(g);△H= -Q1
2CH3OH(l)+3O2(g)=4H2O(l) + 2CO2(g);△H= -Q2
B、3H2 (g)+N2 (g)![]() 2NH3
(g);△H= -Q1
2NH3
(g);△H= -Q1 ![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g)![]() NH3
(g);△H= -Q2
NH3
(g);△H= -Q2
C、C(s)+ O2 (g)=CO2 (g);△H= -Q1 C(s)+![]() O2 (g)=CO(g);△H= -Q2
O2 (g)=CO(g);△H= -Q2
D、S(s)+O2(g)=SO2(g);△H= -Q1 S(g)+O2 (g)=SO2 (g);△H= -Q2
12、下列各组离子在溶液中既可以大量共存,通入CO2 后也不产生沉淀的是
A、Ca2+ Na+ HCO![]() Cl-
B、K+ AlO
Cl-
B、K+ AlO![]() NO
NO![]() OH-
OH-
C、Na+ AlO![]() HCO
HCO![]() SO
SO![]() D、H+ Cl- Ca2+ ClO-
D、H+ Cl- Ca2+ ClO-
13、能正确表示下列化学反应的离子方程式是
A、Mg(HCO3)2 溶液与过量 NaOH 溶液反应:
Mg2++2HCO![]() +2OH- == MgCO3↓ + CO
+2OH- == MgCO3↓ + CO![]() + 2H2O
+ 2H2O
B、氢氧化铁溶于氢碘酸中 Fe(OH)3 + 3H+ == Fe3+ + 3H2O
C、氯气通入硝酸银溶液中 Cl2 + H2O + Ag+ == H+ + AgCl↓ + HClO
D、向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全
Al3+ + SO![]() + Ba2+ +3OH- = BaSO4↓ + Al(OH)3↓
+ Ba2+ +3OH- = BaSO4↓ + Al(OH)3↓
14、设NA表示阿伏加德罗常数,下列叙述中正确的是
A、5.6g金属铁与氯气反应时失去的电子数为0.2NA
B、1.6g的NH![]() 离子中含有的电子数为NA
离子中含有的电子数为NA
C、标准状况下,22.4LSO3含有的氧原子数为3NA
D、常温常压下,16g氧气所含的原子数为NA
15、R为短周期元素,其原子所具有的电子层数为最外层电子数的![]() 。它可能形成的含氧酸根离子有:①R2O
。它可能形成的含氧酸根离子有:①R2O![]() 、②RO
、②RO![]() 、③R2O
、③R2O![]() 、④RO
、④RO![]() 。则下列判断正确的是
。则下列判断正确的是
A、当它形成①时,不可能形成④ B、当它形成②时,可以形成③、④
C、当它形成①时,不可能形成②、③ D、当它形成②时,可以形成①
16、将1L含有0.4molCuSO4和0.2molNaCl的水溶液用Pt电极进行电解。电解一段时间后,在一个电极上得到是0.3molCu,则另一电极上放出气体的体积(标准状况)为
A、4.48L B、5.6L C、6.72L D、13.44L
17、酸溶液甲和碱溶液乙等体积混合后,溶液pH<7。以下叙述一定不符合这一情况的是
A、甲是弱酸,乙是强碱,混合后原酸碱完全中和
B、甲是强酸,乙是弱碱,混合前甲中c(H+)和乙中c(OH-)相等
C、甲是强酸,乙是强碱,混合前甲、乙的物质的量浓度相等
D、甲是弱酸,乙是强碱,混合前甲中c(H+)和乙中c(OH-)相等
18、将0.2mol•L-1氨水和0.1mol•L-1H2SO4溶液等体积混合后,下列关系式中正确的是
A、2c(SO![]() )=c(NH
)=c(NH![]() )>c(H+)= c(OH-) B、c(SO
)>c(H+)= c(OH-) B、c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C、c(NH![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-) D、c(NH
)>c(H+)>c(OH-) D、c(NH![]() )>c(SO
)>c(SO![]() )>c(H+)>c(NH3·H2O)
)>c(H+)>c(NH3·H2O)
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共22分)
19、(12分)(1)选择适当的序号填写于相应的横线上
Ⅰ.可用于加热的玻璃仪器有 ①烧杯、②烧瓶、③试管、④锥形瓶、⑤表面皿、⑥坩埚
Ⅱ.实验室常用于分离物质的仪器是 ①漏斗、②滴定管、③蒸馏烧瓶、④分液漏斗、⑤容量瓶、⑥U型管
Ⅲ.属于危险品,不允许旅客带上车、船的物质是 ①浓硫酸、②天那水、③硝酸钾、④四氯化碳、⑤芒硝、⑥花生油
(2)向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:Mg(OH)2(s) ![]() Mg2+
+ 2OH- ①
Mg2+
+ 2OH- ①
NH![]() + H2O
+ H2O![]() NH3·H2O
+ H+ ②
NH3·H2O
+ H+ ②
H+ + OH- = H2O ③
由于③的发生,使①电离平衡右移,沉淀溶解。
乙同学的解释是:Mg(OH)2(s) ![]() Mg2+
+ 2OH- ①
Mg2+
+ 2OH- ①
NH4Cl = NH![]() + OH- ②
+ OH- ②
NH![]() + OH-
+ OH- ![]() NH3·H2O ③
NH3·H2O ③
由于③的发生,使①电离平衡右移,沉淀溶解。
你认为哪位同学的解释正确呢?请你用一种试剂,设计一个实验验证你观点的正确性。
Ⅰ实验步骤:
Ⅱ实验结论: 。
20、(10分)A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B,按如图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4一起微热,放出无色气体C。用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
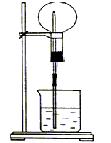
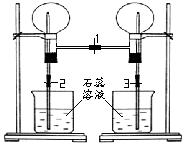
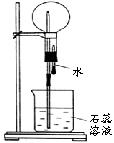
(图1) (图2) (图3)
(1)写出A与浓H2SO4反应生成C的化学方程式为_______ __ __.
(2)请说明观察到蓝色喷泉的原因________ __。
(3)另取两个圆底烧瓶分别收集干燥的B和C ,然后按图2的装置联接好,当打开止水夹1时,看到的现象是 ;过一会,关闭止水夹1,同时打开止水夹2、3,此时看到的现象是 。
(4)若在烧瓶中收集满乙烯,且只提供如图3的装置(烧杯中溶液未确定),请说明引发喷泉的方法。
四、(本题包括2小题,共18分。)
21、(6分)在一定条件下,测得反应2CO2 (g) ![]() 2CO(g) + O2 (g)达到平衡:
2CO(g) + O2 (g)达到平衡:
(1)若其它条件不变,增大CO2浓度,重新建立平衡后,逆反应的速度将比原逆反应的速度要 (填大、小或相等)。
(2)若其它条件不变,将原平衡混合物中各组份的浓度都增大2倍,平衡将 移动。
(3)若平衡体系中混合气体的平均相对分子质量为M,则此时CO2的分解率为
(用含M的式子表示)。
22、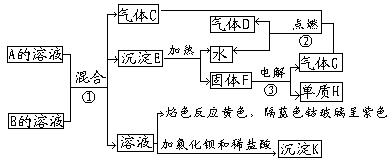 (12分)A、B均为正盐,有关物质之间的转化关系如框图所示。已知:A溶液呈碱性,③是工业生产单质H的反应。试回答:(1)写出A和B的化学式,
(12分)A、B均为正盐,有关物质之间的转化关系如框图所示。已知:A溶液呈碱性,③是工业生产单质H的反应。试回答:(1)写出A和B的化学式,
A B
(2)写出:①反应的离子方程式
②反应的化学方程式
(3)若将气体D(至过量)通入A溶液中,能否发生反应?若不能反应,说明理由。若能反应,有何现象?并写出有关反应的化学方程式。
。
五、(本题包括2小题,共18分。)
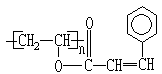 23.(7分) 感光高分子是制作大规模集成电路不可缺少的材料,感光高分子在曝光时会发生二聚反应,生成不溶性的交联高分子硬化膜,未感光部分可用溶剂或其它药品洗去。常用的感光高分子有聚肉桂酸乙烯酯,它的结构如右,请据此回答:
23.(7分) 感光高分子是制作大规模集成电路不可缺少的材料,感光高分子在曝光时会发生二聚反应,生成不溶性的交联高分子硬化膜,未感光部分可用溶剂或其它药品洗去。常用的感光高分子有聚肉桂酸乙烯酯,它的结构如右,请据此回答:
(1)聚肉桂酸乙烯酯在光照下发生二聚反应,其产物的化学式为
(2)聚肉桂酸乙烯酯可水解生成两种产物,其中含苯环的产物的名称为肉桂酸,其结构简式为: ;另一产物的名称为: 。
(3)肉桂酸有多种同分异构体,其中含苯环且苯环上只有一个侧链状取代基并属于酯类的肉桂酸的同分异构体,除![]() 和
和![]() 外,还有两种,请写出其结构简式: 。
外,还有两种,请写出其结构简式: 。
24.(11分)乳酸![]() 是人体生理活动的一种代谢产物。下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.
是人体生理活动的一种代谢产物。下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物.
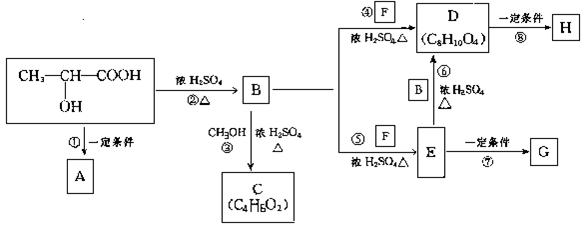 请回答下列问题:
请回答下列问题:
(1)用A加工成的纤维非常适合于做手术缝合线,尤其是人体内部器官的手术,试分析其原因: 。(请结合化学方程式说明)
(2)指出反应②③所属的类型:② ③ ;C物质的结构简式为 。
(3)写出下列反应的化学方程式:①
⑥ .
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性.一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是 .
六、(本题包括2小题,共20分。)
25、(8分)为分析某呼吸面具使用过的过氧化钠的组成,进行如下实验:
称取一定质量的样品,溶于足量水中,收集到气体560mL(标准状况)。在样品的水溶液中滴加足量的MgCl2溶液,过滤并洗涤沉淀,低温下干燥沉淀,得固体10.0g。将所得到的固体溶于盐酸,收集到气体1120mL(标准状况)。
计算该呼吸面具中已消耗的Na2O2在原Na2O2中的质量分数。
26、(12分)现有铁和铜组成的混合物物质的量之和为a ,其中铜的物质的量分数为x,研成粉末后全部投入含HNO3的物质的量为b的稀硝酸中,微热使充分反应,且HNO3的还原产物只有NO,试求:
(1)当溶液中金属离子只有Fe![]() 、Cu
、Cu![]() 时,b的取值范围是(用a、b、x表示)
时,b的取值范围是(用a、b、x表示)
(2)当x=0.5,溶液中Fe![]() 和Fe
和Fe![]() 的物质的量相等时,在标准状况下共产生672mLNO气体,求a和b。(写出计算过程)
的物质的量相等时,在标准状况下共产生672mLNO气体,求a和b。(写出计算过程)