高三第一次月考化学试题
可能用到的原子量数据:H:1 N:14 O:16 Na:23 S:32 Al:27 Cu:64
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分,只有一个正确选项)。
1.工业上生产硫酸,回收尾气中SO2气体,选用的试剂是( A )
A.NH3·H2O B.NaOH C.Ca(OH) 2 D.浓H2SO4
2.用铂电极电解某溶液一段时间,该溶液浓度增大而pH减小,该溶液是( C )
A.NaOH B.CuCl2 C.H2SO4 D.CuSO4
3.下列有关晶体的说法中,正确的是( C )
A.分子晶体中一定存在共价键 B.离子晶体中不一定存在离子键
C.原子晶体的熔、沸点均较高 D.金属晶体的硬度均较大
4.在pH=1的无色透明溶液中能大量共存的离子组是( A )
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、HS-、K+、SO42-
5.用特殊方法把固体物质加工到纳米级(1 nm~100 nm,1nm=![]() m)的超细粉末粒子,
m)的超细粉末粒子,
然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同数量级的是( C )
A.NaCl溶液 B.泥浆水 C.Fe(OH)3胶体 D.油水混合物
6.实现下列变化时,需克服相同类型作用力的是( D )
A.二氧化硅和干冰的熔化 B.液溴和液汞的汽化
C.食盐和冰的熔化 D.纯碱和烧碱的熔化
7. 能用来鉴别Na2S、Na2SiO3、Na2CO3、NaAlO2、NaNO3、AgNO3六种无色溶液的试剂是( D )
A.酚酞 B.氨水 C.BaCl2 D.盐酸
8.煅烧硫铁矿时,氧化产物与还原剂的物质的量之比是( B )
A.8∶4 B.5∶2 C.6∶4 D.4∶8
二、选择题:(本题包括10小题,每小题4分,共40分,有一个或二个正确选项。)
9.在同温同压下,下列各组热化学方程式中,△H1>△H2的是(AC )
A.2H2(g)+O2(g)==2H2O(g);△H1 2H2(g)+O2(g)==2H2O(l);△H2
B.S(g)+O2(g)==SO2(g);△H1 S(s)+O2(g)==SO2(g);△H2
C.C(s)+1/2O2(g)==CO(g);△H1 C(s)+ O2(g)==CO2 (g);△H2
D.H2(g)+ Cl2(g)==2HCl(g);△H1 1/2H2(g)+1/2Cl2(g)==HCl(g);△H2
10.下列说法中正确的是( B )
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101kPa时,1 mol碳燃烧所放出的热量一定为碳的燃烧热
D.CO燃烧是吸热反应
11.下列有关化工生产的叙述正确的是( B )
A.氯碱工业中,阳极发生的反应是:2H++2e—=H2↑
B.粗铜精炼电解池中,粗铜作阳极
C.硫酸工业上,二氧化硫经接触氧化生成三氧化硫后,在吸收塔中用水吸收
D.硫酸工业上,二氧化硫氧化为三氧化硫常采用高压
 12.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用
12.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用
热能,采用了中间有热交换器的接触室(见右图)。按此密闭体
系中气体的流向,则在A处流出的气体为( C )
A. SO2 B.SO3,O2 C.SO2,O2 D.SO2,SO3
13.下列物质按熔点由高到低的顺序排列的是( B )
A.F2、Cl2、Br2、I2 B.Li、Na、K、Rb
C.HF、HCl、HBr、HI D.Si、SiC、金刚石
14.将淀粉-KI混合液装在一半透膜袋中,浸泡在盛有蒸馏水的烧杯中,过一段时间后取烧杯中液体进行实验,能证明半透膜有破损的是( A )
A.加碘水变蓝色 B.加碘水不变蓝色
C.加AgNO3有黄色沉淀 D.加氯水变蓝色
15.X元素的1个原子失去2个电子,被Y元素的2个原子获得,形成离子化合物Z,下列说法中正确的是( BC )
A.固态Z能导电 B.Z可表示为XY2
C.液态Z能导电 D.Z可表示为X2Y
16.硒有两种同素异形体:灰硒和红硒。灰硒溶于三氯甲烷,红硒溶于二硫化碳,它们都不溶于水,则灰硒和红硒的晶体是( B )
A.原子晶体 B.分子晶体 C.金属晶体 D.以上均有可能
17.下列可以证明铁的还原性比铜强的实验方案是( AD )
A.将铁棒插入硫酸铜溶液
B.将铜棒插入氯化铁溶液
C.铁作阴极、铜作阳极均插入硫酸铜溶液中电解
D.铁片、铜片用导线连接后,两片浸入稀硫酸
18.下列各组物质中,前者是欲检验在放置过程中是否已部分氧化变质的物质(都是溶液),后者是验证时使用的试剂,其中正确的是( BC )
A.Na2SO3,BaCl2 B.FeCl2,NH4SCN C.NaI,淀粉 D.苯酚,FeCl3
第Ⅱ卷(非选择题,共78分)
三、(本题包括7小题,共60分)
19.(10分)选择以下物质,填写下列空白(填序号)。
A.干冰 B.金刚石 C.氯化铵 D.氟化钙 E.固体碘 F.烧碱
⑴熔化时不需要破坏化学键的是 。
⑵熔化时需要断裂共价键的是 。
⑶熔点最低的是 。
⑷晶体中存在分子的是 。
⑸晶体中既有离子键又有共价键的是 。
20.(4分)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧生成固态三氧化二硼和液态水,放出649.5 kJ的热量,其热化学方程式为 ;
又已知H2O(液)=H2O(气);ΔH=+44 kJ/mol,则标准状况下,22.4 L乙硼烷完全燃烧生成水蒸气时放出的热量为 kJ。
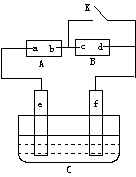 21.(10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸(B中的电极为石墨),C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
21.(10分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸(B中的电极为石墨),C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
⑴电源A上的a为______________极。
⑵滤纸B上发生的总化学方程式为:
。
⑶欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点
短路,则电极e上发生的反应为 ,
电极f上发生的反应为: ,
C槽中盛放的镀液可以是 。
(只要求填两种电解质溶液)。
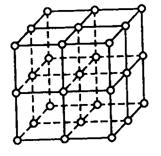
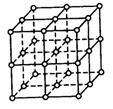 22.(12分)如右图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
22.(12分)如右图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
⑴请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成
NaCl晶体的结构示意图。
⑵晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+
离子共有_______个。
⑶晶体中每一个重复的结构单元叫晶胞。在NaCl晶胞中正六面体
的顶点上、面上、棱上的Na+或Cl-离子为该晶胞与其相邻的晶胞所共有。一个晶胞中,Cl-离子的个数等于______,Na+离子的个数等于_______。
⑷设NaCl的摩尔质量为M g/mol,食盐晶体的密度为ρ g/cm3,阿伏加德罗常数为NA。则食盐晶体中两个距离最近的钠离子中心间的距离为 cm。
23.(6分)有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、NO3-、SO42-、CO32-、C1-和I-。取该溶液进行以下实验:
⑴用pH试纸检验,表明溶液呈强酸性;
⑵取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后,CCl4层呈紫红色;
⑶另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过
程中及滴加完毕后,溶液中均无沉淀生成;
⑷取部分上述碱性溶液加热,加Na2CO3溶液,有白色沉淀生成;
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:在该溶液中肯定存在的离子是 ,肯定不存在的离子是 ,不能确定是否存在的离子是 。
24.(8分)根据实验要求,回答下列问题:
⑴精制硫酸亚铁晶体(含少量不溶性杂质)时,将晶体溶于水后,为什么还需加热到50℃~80℃?为减少硫酸亚铁的损失,应采取什么分离方法?
、
。
⑵某溶液中含有OH–、CO32–、SO42–三种阴离子,要求只取一次待测液就能将阴离子都检验出来,试设计一种简便的检验方法(不选用指示剂)。
。
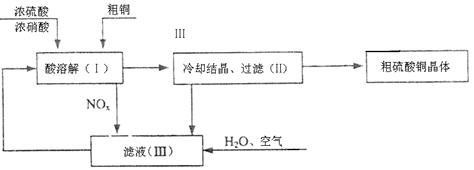
25.
|
回答下列问题:
⑴配平在滤液(Ⅲ)中发生反应的化学主程式:
NOx+ H2O+ O2= HNO3。
⑵写出制取硫酸铜的总反应方程式 。
⑶在上述生产过程中,被循环使用的物质是 。
|
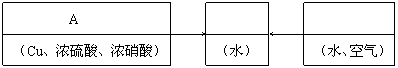 |
四、(本题包括2小题,共18分)
26.(8分)为了充分利用原料降低成本,现有70%的H2SO4溶液35 g,含杂质为20%的烧碱25 g(假设杂质不参与任何化学反应)和足量的铝屑。求最多可制得氢氧化铝多少克?
27.(10分)用铂电极电解500 mL含KNO3和Cu(NO3)2两种溶质的溶液,一段时间后在两个电极上均生成11.2 L气体(标准状况)。试求:
⑴原溶液中Cu2+的物质的量浓度。
⑵当两个电极上均产生11.2 L气体时,所得溶液中H+的物质的量浓度是多少?(忽略溶液体积的变化)
高三化学答卷纸
一、二选择题(每小题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
三、(本题包括7小题,共60分)
19. ⑴ 、⑵ 、⑶ 、⑷ 、⑸ 。
20. ⑴ ;
⑵ kJ。
21.⑴ 个。
⑵ 。
⑶ , , 。
 22.⑴
22.⑴
⑵ 。
⑶ 、 。
⑷ cm。
23.⑴ 、 、 。
24.⑴ 、
。
⑵ ,
。
25.⑴ NOx+ H2O+ O2= HNO3。
⑵ 。
⑶ 。
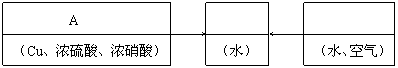 ⑷
⑷
四、计算题:(共18分)
26.
27.