高三第一学期化学科期终考试题
第Ⅰ卷(选择题共72分)
一、单项选择题(本题包括8小题,每小题4分,共32分。)
1、2001年9月北京世界大学生运动会结束时,数万只小气球腾空而起,若从安全角度考虑,气球中不应充H2,而适宜用下列气体中的:
A、Ne B、He C、CH4 D、空气
2、最近,科学家在实验室成功地在高压下将CO2转化为类似SiO2的原子晶体结构,下列对CO2晶体的叙述中不正确的是:
A、晶体中C、O原子个数比为1:2 B、该晶体的熔点、沸点高,硬度大
C、晶体中C–O–C键角为180º D、晶体中C、O原子最外层都满足8电子结构
3、下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是:
A、稀盐酸,Na2CO3溶液 B、Cu,FeCl3溶液
C、稀H2SO4溶液,NaAlO2溶液 D、铁与稀硝酸溶液
4、X、Y为短周期元素,X原子所具有的电子层数是最外层电子数的1/2,Y原子次外层电子数是最外层电子数的1/3,X与Y能形成多种原子团,其中一定不存在的是:
A、X2Y42– B、XY4– C、XY32– D、X2Y32–
5、一定量的质量分数为6%的NaOH溶液(密度为d1 g/cm3),物质的量浓度为a mol/L,加热溶液使其质量分数变为30% (密度为d2 g/cm3),此时溶液的浓度为b mol/L,则a与b的关系是:
A、b=5a B、 b<5a C、b>5a D、无法判断
6、在pH=1的NaNO3溶液中能够大量共存的是:
A、K+、Na+、SO32–、Cl– B、Na+、Ba2+、AlO2–、Cl–
C、NH4+、K+、Cl–、SO42– D、K+、Fe2+、Cl–、SO42–
7、pH值相同的四种一元酸A、B、C、D的溶液各20 mL,与过量Mg充分反应后,产生氢气的质量是D>C>A=B。下列说法正确的是:① D的酸性最强;② A与B的酸性最强且彼此相当; ③ 反应后原D溶液的PH最大;④ 反应后原A和B溶液的PH最大;⑤ 反应前D溶液的物质的量浓度最大;⑥反应前四种溶液的物质的量浓度一样大:
A、②③⑤ B、①④⑥ C、②④⑤ D、①③⑤
8、分子式为C5H12O2的饱和二元醇,有多种同分异物体(其中一个碳原子上连接两个羟基的同分异物体是不能稳定存在的,不计在内),其中主链上碳原子数为3的同分异物体数目为m,主链上碳原子数目为4的同分异物体数目为n,下列各组数据中,m、n均正确的是:
A、m=1, n=6 B、m=2, n=6 C、m=1, n=7 D、m=2, n=7
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。
9、三硫化四磷的分子结构研究表明,该分子中无不饱和键,且各原子的最外层都达到了8个电子的结构。在一个三硫化四磷分子中含有的共价键个数是:
A、7个 B、9个 C、19个 D、不能确定
10、以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解。当得到4 mol Fe(OH)3沉淀时,共消耗的水的物质的量为:
A、8 mol B、10 mol C、11 mol D、12 mol
11、下列各溶液中,微粒的物质的量浓度关系正确的是:
A、0.1 mol/L的(NH4)2SO4溶液中:c (SO42– ) > c (NH4+ ) > c (H+)> c (OH–)
B、0.2 mo1/L的Na2CO3溶液中:c (OH–)= c (HCO3–) + c (H+) + 2 c (H2CO3)
C、0.1 mol/L的NH4Cl溶液与0.05 mol/L的NaOH溶液等体积混合:
C (Cl–) > c (Na+ ) > c (NH4+ ) > c (OH–) > c (H+)
D、c (NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液以及NH4C1溶液:
c [(NH4)2SO4] < c [(NH4)2CO3] < c (NH4C1)
12、下列各项操作中,不发生“先沉淀后溶解”现象的是:
① 向饱和Na2CO3溶液中通入过量的CO2;② 向Fe(OH)3胶体中逐滴滴入过量的稀H2SO4;
③ 向AgI胶体中逐滴加入过量的稀盐酸;④ 向石灰水中通入过量的CO2;⑤ 向硅酸钠溶液中逐滴加入过量的盐酸。
A、①②③ B、②③⑤ C、①②③⑤ D、①③⑤
13、为了从新制的氯水中制得高浓度的次氯酸,可向氯水中加入的试剂是:
A、Na2CO3 B、H2SO4 C、CaCO3 D、Ca(OH)2
14、将Na2SO4•10H2O、Na2CO3•10H2O、NaCl、Na2O各10 g分别投入装有100 g水的四只烧杯中,所得溶液质量分数最小的是:
A、Na2SO4•10H2O B、Na2CO3•10H2O C、NaCl D、Na2O
15、将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一气体则有沉淀。则通入的气体可能是: A、CO2 B、NH3 C、NO2 D、CH4
16、现代的防晒霜中含有能吸收紫外线的防晒剂,例如:对氨基苯甲酸丁酯,它能吸收到达皮肤上99%的紫外线,具有十分理想的防晒效果。下列关于对氨基苯甲酸丁酯的说法正确的是:
A、从有机物分类角度看,它属于氨基酸类、酯类、芳香烃类
B、它能与NaOH溶液反应,也能与盐酸反应
C、甲酸丁酯基(-COOC4H9)有3种不同结构
D、它的分子式为C11H15NO2
17、有一铁的氧化物样品,用5 mol/L盐酸100 mL恰好完全溶解,所得溶液还能吸收标况下的氯气1.12 L,Fe2+全部被氧化为Fe3+,则该氧化物的化学式可表示为:
A、Fe2O3 B、Fe3O4 C、Fe4O5 D、Fe2O7
18、有一可逆反应,2A(g) + 3B(g) ![]() xC(g) +4D(g);若将按下列两种配比的物质:
xC(g) +4D(g);若将按下列两种配比的物质:
(1) 0.8 mol A,1.2 mol B,1.2 mol C,2.4 mol D;(2)1.4 mol A,2.1 mol B,0.6 mol C,1.2 mol D
放入一容积不变的密闭容器中,保持温度不变,达平衡后,两种情况C的百分含量相等,则方程式中的x值为:
A、1 B、2 C、3 D、4
第Ⅱ卷(非选择题部分,共78分)
19、KClO3和浓盐酸在一定温度条件下反应会生成黄绿色的易爆物ClO2,其变化可表示为:
![]()
![]()
![]()
![]()
![]()
![]()
![]() KClO3+ HCl(浓)—— KCl+ ClO2↑+ Cl2↑+
KClO3+ HCl(浓)—— KCl+ ClO2↑+ Cl2↑+
⑴ 请完成该化学方程式并配平(未知物化学式和系数填入框内);
⑵ 浓盐酸在反应中显示出来的性质是 (填写序号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
⑶ 产生0.1 molCl2,则转移的电子的物质的量为 mol;
⑷ ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子
数表示)是Cl2的 倍。 (2x4=8分 )
20、实验:(每空2分,共16分,每空只有全对才得分,否则不得分)
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl–、I–、NO3–、CO32-、S2–、SO42–、AlO2–、SO32–、MnO4– , 取该溶液进行以下实验:
(1) 取PH试纸检验,溶液呈强酸性,可以排除 离子的存在。
(2) 取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排
除 离子的存在。
(3) 另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
(4) 取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明 离子存在,又可排除 离子的存在。
(5) 将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是 ;肯定不存在的离子是 ;还不能确定是否存在的离子是 。
21、草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下述实验:① 称取w g 草酸晶体配成100.00 mL水溶液;② 取25.00 mL所配的草酸溶液置于锥形瓶中,加适量稀H2SO4后,用浓度为a mol/L的KMnO4溶液滴定,所发生的反应为:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 === K2SO4 + 10 CO2 + 2 MnSO4 + 8 H2O
反应生成的MnSO4在水溶液中基本无色。试回答下列问题:
(1)实验滴定时,KMnO4溶液应装在 式滴定管中;
(2)在滴定过程中,达到滴定终点的标志是 ;
(3)若滴定过程中,用少量蒸馏水洗锥形瓶内壁,再继续滴定,则所测得的x值 (填“偏大”、“偏小”或“无影响”下同);记录测定结果时,滴定前平视刻度线,滴定到达终点时,又俯视刻度线,将导致滴定结果 ;若在滴定终点后,因操作错误多加1滴KMnO4溶液则应采取何措施 。若滴定过程中,液体飞溅出来,则应采取何措施 。
(4)若滴定过程中,共用去a mol/L KMnO4溶液 V ml,由此可计算出草酸晶体结晶水的x值为 。(1x6+2=8分)
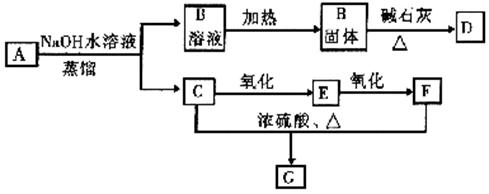
22、下图中每一个方格表示一种反应物或生成物(反应中的水以及部分反应中生成的常温下呈气态的物质均已略去)。已知D是一种盐,焰色反应是浅紫色,且B生成A的反应的另一种气体产物是空气的主要成分之一。
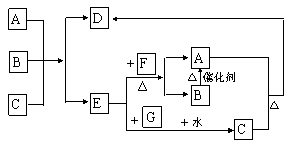
⑴ A是 ,B是 ,G是 (用化学式表示);
|
![]() ⑶ E+F
A+B的离子反应方程式
;
⑶ E+F
A+B的离子反应方程式
;
⑷ A、B、C三种物质反应的物质的量之比为 。(1x3+2x3=9分)
23、已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2– > I– > Br– > Cl– > OH–> 含氧酸根离子> F–。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。(1+1+2+2+1+1=8分)
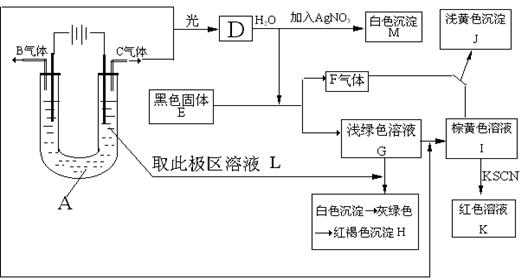
(1)写出A的化学式为 ,E的名称为 ;
(2)I与F作用的离子方程式是 ;
(3)G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
;
(4)用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+
① ;② 。
24、(7分)已知有机化合物A为具有香味的液体,从A出发有下列变化。同时经有关实验证实:1 mol A在完全燃烧后产生8 mol 二氧化碳;D为最简单的芳香烃;F可发生银镜反应。
请回答下列问题:
(1) A、B物质的名称分别是 、 ;E物质的水溶液通常叫做 ;
(2) 写出下列变化过程的化学方程式:
![]() ①C+F G
;
①C+F G
;
![]() ②B D
。
②B D
。
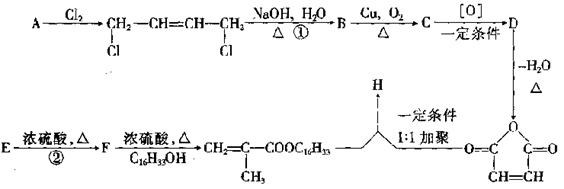
25、降凝剂H可以降低油品的凝固点,它是一种高分子聚合物,其合成路线可以设计如下:
|
请回答下列问题:
(1)指出反应类型:① ,② 。
(2)写出结构简式:D , H 。
(3)写出E→F的化学方程式: 。(2+2+2+2=8分)
26、250C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b.请填写下列空白:
(1) a值可否等于3(填“可”或“否”) ,其理由是 ;
(2) a值可否等于5(填“可”或“否”) ,其理由是 ;
(3) a 的取值范围是 。 (1x4+2=6分)
27、(2+3+3=8分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入90 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
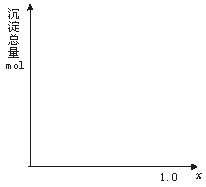
(1) 根据反应的化学方程式计算,当x=0.4 时,溶液中产生的沉淀是什么?物质的量是多少?
(2) 计算沉淀中只有Fe(OH)3的x取值范围,请在图中画出沉淀总量(mol)随x(0→1)变化的曲线。
(3) 若Al3+和Fe3+的物质的量之和为A mol(A为合理取值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x的取值范围和各沉淀的物质的量(用含有A、x的式子表示)。
附加题:
28、在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g) +
2B(g) ![]() 3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
(1) 达到平衡时C在反应混合气体中的物质的量百分含量为 (用含a关系式表示);
(2) 在相同实验条件下,若在同一容器中改为加入2 mol A和6 mol B,达到平衡后,C的物质
的量为 (用含a关系式表示)。此时C在混合气体中的物质的量百分含
量 (填增大、减少或不变);
(3) 在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应
混合气体中的物质的量百分含量不变,还应加入 C mol。
(4) 若在同一容器中,加入n mol A和3n mol B,则平衡时C的物质的量为m mol。若改变实验
条件,可以使C的物质的量在m~2m间变化,那么n、m的取值范围是
(用含字母n、m的关系式表示)。
(5) 若上述可逆反应一开始就从逆向建立平衡,达到平衡后,再将C物质的量加倍,则C的分
解率 (填“增大”、“减小”或“不变”)。
29、用废铁屑与稀硫酸溶液反应,可制得FeSO4。在10℃和50℃时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6 g,常温下,从溶液中析出的晶体是FeSO4·7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 ;
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 ;
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 ;
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 50℃时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(50℃时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在80℃下将溶液蒸发至体积为70.0 ml,再冷却至10℃时,所得到的FeSO4 ·7H2O的质量,你认为 (填编号),并简述所选之理由。答: .
A.前面提供的数据已经足够
B.还需要提供 10℃时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 80℃时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6) 根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从10℃ 50.0 ml溶液中结晶析出的FeSO4·7H2O的质量。(本大题计算结果保留3位有效数字)。
第一学期 高三化学科 期终考试题 答题卷
班级 姓名 学号 成绩
一、单项选择题(共4´8=32分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
二、1-2项选择题(共4´10=40分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第II卷(非选择题部分,共78分)
19、⑴ + == + + + ;
⑵ ;⑶ mol;⑷ 倍。 (2x4=8分 )
20、(1) 排除 离子;(2) 排除 离子;
(3) 排除 离子;(4)证明 离子存在,排除 离子;
(5)肯定存在的离子 ;
肯定不存在的离子 ;
还不能确定是否存在的离子 。(2x8=16分,每空只有全对才得分)
21、(1) 式滴定管;(2)标志是 ;
(3) ; ; ; ;
(4) 。 (1x6+2=8分)
22、(1x3+2+2+2=9分) ⑴ A ,B ,G (用化学式表示);
⑵ 化学反应方程式 ;
⑶ 离子反应方程式 ;⑷物质的量之比 。
23、(1) A化学式 ,E名称 ;(2) 离子方程式 ;
(3)化学方程式 ;(4)离子方程式① ;
② 。(1+1+2+2+1+1=8分)
24、(1)名称:A B ;E物质的水溶液通常叫做 ;
(2)化学方程式:① ;
② 。(1x3+2+2=7分)
25、(1+1+2x3=8分) (1) 反应类型:① 反应,② 反应;
(2) 结构简式:D ,H ;
(3) 化学方程式: 。
26、(1) ,理由 ;(2) ,理由 ;
(3) a 的取值范围 。 (1x4+2=6分)
27、(2+3+3=8分)解: