高三化学第一学期期末调研测试试卷
说明:本卷分第I卷和第Ⅱ卷,满分150。考试时间120分钟。
与本卷有关的相对原子质量:H=1 He=4 C=12 N=14 O=16 Na=23
Mg=24 S=32 Cl=35.5 K=39 Ca=40 Fe=56 Cu=64 Ag=108 Ba=137
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.目前,我国许多城市和地区定期公布空气质量报告,在空气质量报告中一般不涉及
A.SO2 B.CO2 C.NO2 D.可吸入颗粒物
2.据最新报道,钬的放射性同位素![]() 可有效地治疗肝癌。该同位素原子核内的中子数与核外电子数之差是
可有效地治疗肝癌。该同位素原子核内的中子数与核外电子数之差是
A.32 B.67 C.99 D.166
3.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与O2的结合能力,服用维生素C可以缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性 B.碱性 C.还原性 D.氧化性
4.1999年英国科学家L. Taom博士合成和分离出了含高能量的N5+离子的化合物N5AsF6。下列有关叙述不正确的是
A.N5+离子中氮氮原子之间以共价键相结合 B.AsF6-离子中As与F之间的化学键为离子键
C.1 mol N5+ 离子共有34×6.02×1023个核外电子 D.在化合物N5AsF6中,氟元素呈―1价
5.在某些火箭发射中常用肼(N2H4)为燃料。0.1 mol N2H4(气态)在O2(气态)中燃烧生成N2(气态)和H2O(气态),放出53.4 kJ的热量,则下列热化学方程式正确的是
A.N2H4(g) + 2O2(g)![]() N2(g) + 2H2O(g); △H=+534 kJ·L-1
N2(g) + 2H2O(g); △H=+534 kJ·L-1
B.N2H4(g) + 2O2(g)![]() N2(g) + 2H2O(g); △H=-53.4 kJ·L-1
N2(g) + 2H2O(g); △H=-53.4 kJ·L-1
C.N2H4(g) + 2O2(g)![]() N2(g) + 2H2O(g); △H=+53.4 kJ·L-1
N2(g) + 2H2O(g); △H=+53.4 kJ·L-1
D.N2H4(g) + 2O2(g)![]() N2(g) + 2H2O(g); △H=-534 kJ·L-1
N2(g) + 2H2O(g); △H=-534 kJ·L-1
6.下列叙述正确的是
A.化合反应一定不是氧化还原反应 B.红磷与白磷互为同素异形体
C.植物吸收氮肥的过程称为生物固氮 D.强电解质溶液的导电性一定比弱电解质溶液强
7.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1
 C.1︰2 D.2︰3
C.1︰2 D.2︰3
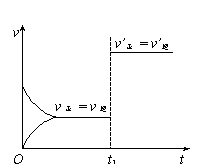
8.对可逆反应:A(g) + B(s) ![]() C(s) + D(g); ΔH>0
C(s) + D(g); ΔH>0
下图所示为正逆反应速率(v)与时间(t)关系的示意图,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤减少C,符合图示的条件是
A.②③ B.①② C.③④ D.④⑤
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列比较正确的是
A.熔沸点高低:NH3<PH3<AsH3<HI B.离子半径大小:Br-<Mg2+<Cl-<F-
C.分散质微粒直径大小:Fe(OH)3胶体>NaCl溶液 D.酸性强弱:H2SO3>CH3COOH>H2CO3>H2SiO3
10.鉴别SO2和CO2,可将它们分别通入
A.盛有澄清石灰水的洗气瓶 B.盛有品红溶液的洗气瓶
C.盛有氯化钡溶液的洗气瓶 D.盛有溴水的洗气瓶
11.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
A.Cl-、Mg2+、SO![]() 、K+ B.NH
、K+ B.NH![]() 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+ D.HCO
、Na+ D.HCO![]() 、K+、NO
、K+、NO![]() 、SO
、SO![]()
12.铅蓄电池效率低、污染大,现在研究用锌电池取代它。其电池反应为:2Zn + O2![]() 2ZnO
2ZnO
其原料为锌、空气和电解质溶液,则下列叙述正确的是
A.锌为负极,空气进入负极反应 B.正极发生氧化反应,负极发生还原反应
C.负极电极反应是:Zn-2e-+2OH-![]() ZnO+H2O D.电池工作时,外部电流由锌极流向另一极
ZnO+H2O D.电池工作时,外部电流由锌极流向另一极
13.下列离子方程式书写正确的是
A.次氯酸钙溶液中通入少量的二氧化碳 Ca2+ + 2ClO-+ H2O + CO2![]() CaCO3↓+ 2HClO
CaCO3↓+ 2HClO
B.金属钾与水反应 K + H2O![]() K+ + OH-+ H2↑
K+ + OH-+ H2↑
C.醋酸与氢氧化钠溶液的反应 H+ + OH-![]() H2O
H2O
D.二氧化锰与浓盐酸共热制氯气 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
14.设N0为阿伏加德罗常数的值,下述错误的是
A.4 g氦气所含原子个数为N0 B.18 g水含有8 N0个电子
C.16 g氧气和16 g臭氧所含的原子数均为N0 D.12 g金属镁变为镁离子时,失去的电子数目为N0
15.在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是
A.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) B.c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C.c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-) D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
16.某盐酸的浓度为12.0 mol·L-1,其密度为1.19 g·cm-3。现有该浓度的盐酸100 m3,则用于吸收HCl形成该盐酸的水的体积是
A.75.2 m3 B.85.5 m3 C.90.8 m3 D.100 m3
17.在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D. 1∶9
18.常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L-1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L时,假设溶液体积不变,下列说法正确的是
A.阴极增重1.4 g B.所得溶液 pH<1
C.阴极增重0.64 g D.所得溶液pH>1
第II卷(非选择题,共78分)
三、(本题包括2小题,共22分)
19.(10分)回答下列问题:
(1)下列仪器中:①普通漏斗 ②天平 ③蒸馏烧瓶 ④容量瓶 ⑤燃烧匙 ⑥滴定管 ⑦分液漏斗,常用于物质分离的是__________(填编号),其中根据物质沸点不同分离物质的仪器是______________(填编号)。
(2)实验室有贮存以下物质的方法:A少量白磷贮存在水中;B碳酸钠溶液贮存在带玻璃塞的玻璃瓶中;C少量金属钠贮存在酒精中;D浓硝酸贮存在棕色的细口玻璃瓶中。其中正确的_______________________(填编号)。
(3)下列实验操作错误的是___________
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡进行比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.用酸滴定碱的操作是:左手摇动锥形瓶,右手控制活塞,两眼注视溶液液面颜色的变化。
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
20.(12分)电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
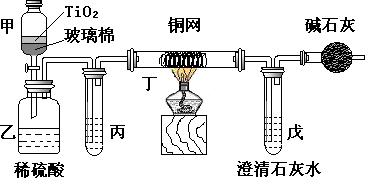
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
(1) 甲中反应的离子方程式为
乙中反应的离子方程式为
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。
丙中加入的除杂试剂是 (填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由____________________________________________________________________________。
四、(本题包括2小题,共18分)
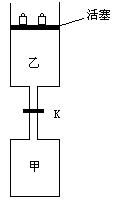 21.(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5
mol B,向乙中充入3 mol A、7 mol
B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
21.(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5
mol B,向乙中充入3 mol A、7 mol
B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
 (3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
(用含V的代数式表示,连通管中气体体积忽略不计。)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
(用含V的代数式表示,连通管中气体体积忽略不计。)
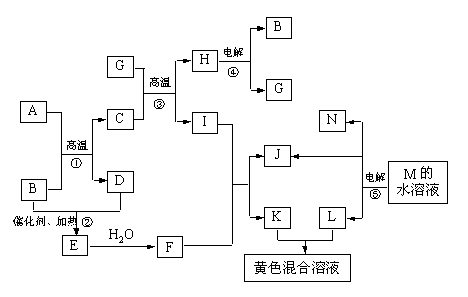
22.(10分)根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、J、L为气体。A是工业生产中重要的矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式:
反应②的化学方程式_________________________________________________
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出下列反应在工业生产所使用设备的名称
反应①所使用设备的名称_________________________________
五、(本题包括2小题,共18分)
23.(10分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙三种化合物,各化合物中原子个数比关系如下表:
| 甲 | 乙 | 丙 | |
| 化合物中各元素原子个数比 | A∶C=1∶1 | D∶E=1∶3 | B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)写出A、B、C、D的元素名称:
A、___________B、___________C、___________D、___________
(2)向甲的水溶液中加入MnO2,反应的化学方程式: 。
(3)乙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(4)向30 mL 1 mol·L-1 KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸 ②0.5 mol·L-1 30%甲溶液 ③1 mL丙,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是______________。
24.(8分)1 183 K以下纯铁晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
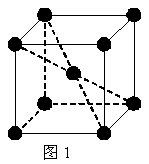
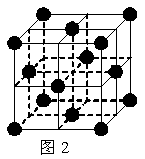
(1)在1 183 K以下的纯铁晶体中,与铁原子等距离且最近的铁原子数为_______个;在1 183 K以上的纯铁晶体中,与铁原子等距离且最近的铁原子数为___________;
(2)纯铁晶体在晶型转变前后,二者基本结构单元的边长之比为(1 183 K以下与1 183 K以上之比)
___________。
(3)转变温度前后两者的密度比(1 183 K以下与1 183 K以上之比)_____________。
六、(本题包括2小题,共20分)
25.(8分)将4.89 g K2SO4、K2CO3、KOH、KCl的固体混合物完全溶于水,在该溶液中加入过量的250 mL 0.10 mol·L-1 Ba(OH)2溶液得白色沉淀A 4.30 g。向过滤所得滤液中加入550 mL 0.10 mol·L-1 HCl溶液,恰好完全中和。再向沉淀A中加入足量的稀硫酸最终得到沉淀B 4.66 g。求原混合物中各物质的质量。
26.(12分) 在200 mL 1 mol·L-1的KHCO3溶液中,加入一定质量单质或化合物X,恰好将其转化为只含K2CO3溶质的溶液。
(1)该过程中一定发生的一步离子反应方程式为________________________________
(2)能实现上述转变的物质X有多种,请在下表中尽可能多地填写符合条件的X的化学式及其质量:(如空格不够可另加)
| 编号 | 1 | 2 | 3 | 4 | 5 | |
| X的化学式 | ||||||
| 加入X的质量/g |
第一学期期末调研测试试卷
高三化学参考答案
说明:1.方程式书写中未配平、化学式错误均不给分。
2.各题其他合理解法均参照评分标准给分。
一、选择题(每小题4分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | A | C | B | D | B | B | A |
二、选择题(每小题4分。若正确答案包括两个选项,只选一个且正确的给2分,选错不给分。)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | CD | BD | D | C | AD | B | BD | A | D | AB |
三、19.(10分)(1)①③⑦ ③(2)AD (3)ABCD
(第(1)(2)小题,每空2分,第(3)小题4分每答对1个给1分)
20.(12分)(1)CN-+ClO-![]() CNO-+Cl-
CNO-+Cl-
2CNO-+2H+ +3ClO-![]() N2↑+2CO2↑+3Cl-+H2O
N2↑+2CO2↑+3Cl-+H2O
(2)a (3)去除Cl2 (4) 82% 偏低,因为在丙中溶解的CO2以及装置中滞留的CO2未与戊中的澄清石灰水反应。
(每空2分)
四、21.(8分)(1)20% (3分)(2)后者大 (2分) (3)0.29V(3分)
22.(10分)(1) FeS2 O2 (每空1分)
(2)
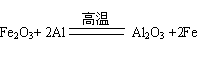
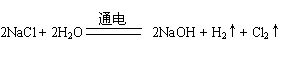 (每空2分)
(每空2分)
(3)沸腾炉 (2分)
五、23.(10分)(1)氢 碳 氧 铝(每空1分)(2)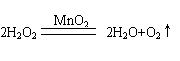 (2分)
(2分)
(3)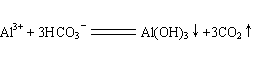 I2的CCl4溶液(每空2分)
I2的CCl4溶液(每空2分)
24.(8分)(1)8 12
(每空2分) (2)![]() (2分) (3)
(2分) (3)![]() (2分)
(2分)
(未化简及化为小数均给全分)
六、
25.(8分)解: BaCO3+H2SO4![]() BaSO4+H2O+CO2↑ 沉淀增重
BaSO4+H2O+CO2↑ 沉淀增重
1 mol 233 g-197 g=36 g
0.01 mol 4.66 g-4.30 g=0.36 g
4.30 g沉淀中:
m(BaCO3)= 0.01 mol×197 g·mol-1 =1.97 g
则4.30 g-m(BaCO3)=4.30 g-1.97 g=2.33 g,n(BaSO4)= 0.01 mol
4.89g 中固体混合物中:
n(K2SO4)= n(BaSO4)= 0.01 mol, 则 m(K2SO4)=0.01 mol×174 g·mol-1 =1.74 g
n(K2CO3)= n(BaCO3)=0.01 mol, 则 m(K2CO3)=0.01 mol×138 g·mol-1 =1.38 g
n(KOH)=0.55 L×0.10 mol·L-1-0.25 L×0.10 mol·L-1×2=0.005 mol ,
则m(KOH)= 0.005 mol×56 g·mol-1 =0.28 g
m(KCl)=4.89 g-m(K2SO4) -m(BaCO3)- m(KOH)
=4.89 g-1.74 g-1.38 g-0.28 g
=1.49 g
答:原混合物中K2SO4、K2CO3、KOH、KCl的质量分别为1.74 g、1.38 g、0.28 g、1.49 g
(每问2分,答案过程各1分.)
26.(12分)(1)HCO3-+OH-![]() CO32-+H2O (2分)
CO32-+H2O (2分)
(2)
| 编号 | 1 | 2 | 3 | 4 | ||
| X的化学式 | K | KH | K2O | K2O2 | KOH | KO2 |
| 加入X的质量/g | 7.8 | 8.0 | 9.4 | 11 | 11.2 | 14.2 |
(每组2分)只要求答对五组