高中学生学科素质训练
新课程高三化学综合测试题(1)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
相关相对原子质量:H 1 C 12 N 14 O 16 Ne 20 S 32 Cl 35.5
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.汽车在行驶过程中排放的尾气是城市污染的主要原因之一。为减少城市的大气污染,在汽
车发动机和排气管之间装配了催化转换器,催化转换器中装有铂(Pt)、铑(Rh)或过渡金属
氧化物等作催化剂。催化转换器必须具备以下性能:即适用的操作温度范围广,耐机械
性冲击。因此,能作为催化剂的载体的材料是 ( )
A.聚四氟乙烯(塑料王) B.石墨
C.Al2O3 D.晶体硅
2.汽油蒸气(以辛烷表示)与空气(设O2占1/5体积)按一定比进入汽车发动机,在电火花作
用下燃烧。下列关于汽车排放的废气说法不正确的是 ( )
A.废气中氮的氧化物含量跟辛烷与空气的体积比无关
B.辛烷(气)与空气的体积比为2:125时,废气中无CO和氮氧化物
C.辛烷(气)与空气的体积比大于2:125时,废气中氮氧化物含量增多
D.辛烷(气)与空气的体积比小于2:125时,废气中CO的含量增多
3.下列电子式书写正确的是 ( )
 |
4.“喷水溶液法”是最近日本科学家研制出的一种使沙漠变绿洲的新技术,它是先在沙漠中喷
洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30~50cm
处形成一个厚0.5cm的隔水层,即能阻止地下的盐分上升,又有拦截、蓄积雨水的作用。
下列对聚丙烯酸酯不正确的说法是 ( )
A.单体的结构式为CH2=CH-COOR B.在一定条件下能发生加成反应
C.在一定条件下能发生水解反应 D.没有固定的溶沸点
5.现有两种高聚物A、B,A能溶于氯仿等有机溶剂,B不溶于任何溶剂,加热不会变软或
熔融,则下列叙述中不正确的是 ( )
A.高聚物A可能具有弹性,而高聚物B一定没有弹性
B.高聚物A一定是线型高分子化合物材料
C.高聚物A一定是体型高分子化合物材料
|
6.高温下硫酸亚铁发生如下反应:2FeSO4 Fe2O3+SO2↑+SO3↑,若将生成的气体通入
氯化钡溶液中,得到的沉淀物是 ( )
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
7.在一定条件下有如下反应:RO3n-+6I-+6H+=R-+3I2+3H2O,则RO3n-中,R元素的化合价
及R原子最外电子数分别为 ( )
A.+5和7 B.+3和1 C.+5和5 D.+1和1
8.下列除去杂质的方法正确的是 ( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | I2 | / | 加热 |
| D | Fe | Si | 硫酸 | 过滤 |
二、选择题(本题包括10小题,每小题4分,共40分;每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一
个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.汽车尾气(含有烃类、CO、NOx、SO2)是城市空气的主要污染源,治理方法之一是在汽
车排气管上加装“催化转化器”,它使CO和NOx反应生成可参与大气生态环境循环的无
毒气体,并使烃类充分燃烧及SO2转化,下列说法错误的是 ( )
A.CO和NOx反应的化学方程式为:2xCO+2NOx=2xCO2+N2
B.上述方法的缺点是由于CO2增多,会大大提高空气的酸度
C.多植树造林,增大绿化面积,可有效控制城市空气各种污染源
D.汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染
10.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液Fe2++2H2O2+4H+=Fe+4H2O
C.用氨水吸收少量二氧化硫 NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
11.设阿伏加德罗常数的符号为NA,下列叙述正确的是 ( )
A.1摩尔D2O所含质子数为12 NA
B.10克氖气所含原子数为NA
C.0.5 摩尔单质铝与足量盐酸反应转移电子数为1.5NA
D.标准状况下,1升辛烷所含分子数为1/22.4 NA
12.生物体中细胞膜内的葡萄糖、细胞膜外的富氧液体及细胞膜构成微型的生物原电池。据
此判断下列说法正确的是 ( )
A.正极的电极反应可能为:O2+4e-+2H2O=4OH-
B.负极的电极反应可能为:O2+4e-=2O2-
C.负极主要反应是C6H12O615.生成CO2或HCO3-
D.正极反应主要为C6H12O615.生成CO2或HCO3-
13.下列各组溶液,不用其它试剂,不比较温度变化,就可以将它们区分开的是 ( )
A.盐酸、氢氧化钠、硝酸钠、硫酸钠
B.盐酸、硝酸银、氢氧化钠、硝酸钠
C.氢氧化钠、硫酸镁、碳酸钠、硫酸氢钠
D.氯化钡、硫酸钠、氯化钙、硝酸钙
14.Al(OH)3和Ga(OH)3均为两性氢氧化物,它们的酸性都比碳酸弱,又知Ga(OH)3的酸性
强于Al(OH)3,若把过量CO2气体通入含AlO2-和GaO2-的混合溶液中,下列说法正确
的是 ( )
A.无任何明显现象
B.生成两种沉淀,后沉淀又逐渐溶解
C.先出现Al(OH)3沉淀,后出现Ga(OH)3沉淀,沉淀不溶解
D.先出现Ga(OH)3沉淀,后出现Al(OH)3沉淀,沉淀不溶解
15.已知相同条件下,乙溶液的pH为x,甲溶液的pH为乙溶液pH的2倍,则甲溶液中![]()
的物质的量浓度是乙溶液中H+物质的量浓度的多少倍 ( )
A.10x B.10-x C. ![]() D.
D.![]()
16.将NaHCO3溶液加水稀释时,下列各量中数值变大的是①c(CO32-)②c(H2CO3)③c(H+)
④c (OH-)⑤c(Na+) ( )
A.只有①②③ B.只有④⑤ C.只有③ D.只有②④
17.目前,人们正在研究开发一种高能电池——钠硫电池。它以熔融的钠、硫为两极,以
 Na+导电的β′-Al2O3陶瓷作固体电解质,反应式如下:
Na+导电的β′-Al2O3陶瓷作固体电解质,反应式如下:
2Na+xS Na2Sx,以下说法正确的是 ( )
A.放电时,Na作正极,S极发生还原反应
B.若用此电池电解AgNO3溶液,当阳极产生标准状况下气体1.12升时,消耗金属钠2.3g
C.充电时,钠极与外电源的正极相连
D.充电时,阳极发生的反应为:Sx2--2e= xS
18.加热N2O5时发生以下2个分解反应N2O5
![]() N2O3+O2 N2O3
N2O3+O2 N2O3 ![]() N2O+O2在
N2O+O2在
1L密闭容器中,加热4 mol N2O5,达到化学平衡时,c(O2)为4.50 mol/L,c (N2O3)为
1.62mol/L,则在该温度下各物质的平衡浓度中,不正确的是 ( )
A.c(N2O5)(平)= 1.44 mol/L B.c(N2O5) (平)= 0.94 mol/L
C.c(N2O)(平)= 0.44 mol/L D.c(N2O) (平)= 1.44 mol/L
第Ⅱ卷(非选择题 共78分)
三.(本题包括2小题,共19分)
19.(8分)回答下列问题:
(1)实验室利用铜丝和浓H2SO4反应的原理,制取少量二氧化硫气体,通常需要哪些
仪器?
(2)将SO2气体通入红棕色的溴水中,可以使溴水褪色。甲同学分析说褪色是由SO2的
还原性造成的;乙同学分析说褪色是SO2的漂白性造成的。请你根据SO2漂白性的
特点设计一个简单的实验,证明甲、乙两同学到底谁的分析正确?
20.(11分)石油资源紧张曾是制约中国发展轿车事业,尤其是制约轿车进入家庭的重要因
素。为此,2001年5月,中国宣布将推广“车用乙醇汽油”。所谓乙醇汽油就是在汽油
里加入适量乙醇混合而成的一种燃料。
(1)下列叙述错误的是 ( )
A.乙醇汽油是一种新型的化合物
B.汽车使用乙醇汽油能减小有害气体的排放
C.工业常用裂化的方法提高汽油的产量
D.用玉米、高梁发酵可以制得乙醇
(2)乙醇燃烧不完全时,有CO生成。用下图装置确证乙醇燃烧产物有CO、CO2和H2O,
应将乙醇燃烧产物依次通过_________________。(按气流从左至右顺序填装置编号)
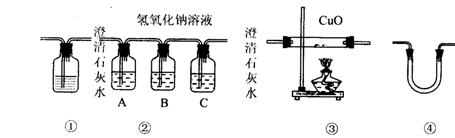
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________ __;
B瓶溶液的作用是____ _______;C瓶溶液的作用是_____________。
(4)装置③的作用是____ _______。装置①中所盛的是________ __ ___溶液,
作用是 。
(5)装置④中所盛的固体药品是____________,可以确证的产物是____________。
(6)尾气应如何处理?_____________________________________________________。
四.(本题包括2小题,共20分)
21.(7分)物质A—H有下图所示转化关系(部分反应物、生成物没有列出)。其中,B的
浓溶液与单质X在加热时才能发生反应①,B的稀溶液与足量X发生反应②,向C溶
液中滴入KSCN溶液呈红色。
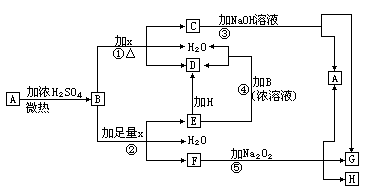 |
试填写下列空白:
(1)晶体A是(化学式)______________________ __。
(2)反应②的离子方程式:________ ______________。
(3)根据图示信息判断,足量B的浓溶液与单质X共热时能否产生E,说明理由(写出
化学方程式回答):_________________________________。
(4)在反应⑤中,若生成物G与H的物质的量之比为4∶1,写出F溶液与Na2O2反应
的化学方程式:______________________________________。
22.(13分)阅读下列材料:过氧化氢(H2O2)又称双氧水,它是一种二元弱酸,比碳酸的
酸性还弱,且易分解。作为一种经典化工产品,工业上早在100多年前便开始生产。随
着社会需求的增长,尤其是生态环境保护的需要,双氧水近年来更受到人们的青睐,并
称其为绿色氧化剂。为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化成
固态的过碳酸钠晶体(其化学式为2Na2CO3•3H2O2),该晶体具有Na2CO3和H2O2的双
重性质。“醇析法”的生产工艺过程如下:
在0℃~5℃下往饱和的Na2CO3溶液中,先加入H2O2和稳定剂(MgCl2和Na2SiO3),
经充分反应后,再加入异丙醇,过滤分离,即得到过碳酸钠晶体。根据上述材料,回答
下列问题:
(1)写出双氧水的结构式_______ __,电离方程式____________________。
(2)双氧水能使酸性高锰酸钾溶液褪色,体现了双氧水的____ _性(填氧化性、
还原性、酸性、碱性,下同);
双氧水能使含酚酞的氢氧化钠溶液褪色,体现了双氧水的_________性。
(3)你认为双氧水被称为绿色氧化剂的主要原因是:_______________________。
(4)已知过氧化钠与干燥的二氧化碳气体不反应,但可以和潮湿的二氧化碳气体发生
反应。试用化学方程式表示过氧化钠与潮湿的二氧化碳气体反应的过程_________
_______________________________________________________________________
_______________________________。
(5)我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,
写出该反应的离子方程式_________________________ ____。
(6)稳定剂能发生反应生成难溶物将过碳酸钠粒子包住,该反应的化学方程式为_____
____________________________ _____。
(7)加入异丙醇的作用是____________________ __________________。
(8)下列物质不会使过碳酸钠失效的是_____ ________。
A.MnO2 B.H2S C.CH3COOH D.NaHCO3
五.(本题包括2小题,共20分)
23.(10分)如图,B为常见金属或非金属单质,有下列转化关系:
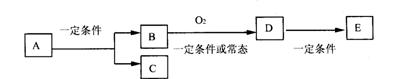
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约
是D物质总质量的25.8%,则A是_________。
②若E是酸酐,且为易挥发的晶体,则A是________;D转化为E的一定条件是________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石
蕊试液变红色。则A是_______;A、B、D、E中易溶于C的物质是_______(填字母)。
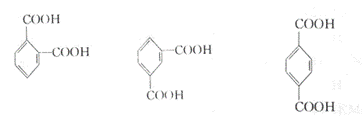
24.(10分)取3.320 g只含羧基,不含其他官能团的固态芳香族羧酸[其表示式
为:(H2O)x(CO2)yCz]置于4.00 L氧气中,经点燃后羧酸完全燃烧,反应后气体体积
变化(增加或减少)0.224 L,将气体通过足量的固体过氧化钠后,体积减少1.792 L(所
有气体均为标准状况下测定)。请回答:
(1)3.320 g该羧酸中碳原子物质的量为 ;
(2)该羧酸中C、H、O的原子数之比为 ;
(3)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式 。
六.(本题包括2小题,共19分)
25.(8分)C12和NO2在室温下可以化合成一种新的气态化合物C,为了测定C的分子组成,
进行以下实验:取总体积为5L的混合气体,测定反应后气体总体积V随着C12在混合
气中所占体积分数为x的变化而发生变化的规律。实验测知当C12所占体积分数为20%
或60%时,反应后的气体总体积均为4L。
(1)写出反应的化学方程式:____ ______________________
(2)讨论当x取不同值时,反应后气体总体积V随x变化的函数关系。
26.(11分)汽车内燃机中,汽油气化后与空气按一定比例混合进入气缸。引擎用电火花引
燃,使气缸内温度迅速升高,气体急剧膨胀,产生压力,推动活塞。排出的尾气对大气
产生污染。为了简化讨论,设汽油的成分为辛烷,假设空气中O2体积占1/5,其余为
N2。试回答下列问题:
(1)设辛烷蒸气与相同条件下的空气体积比为a,要使辛烷完全燃烧,求a的最大值
a′为多少?
(2)当a>a′时,主要的大气污染物是______;当a<a′时,主要的大气污染物是______。
(3)正在推广使用的Pt-Rh-CuO-Cr2O3-Al2O3(氧化铝为载体)是较理想的高效催化剂,制
成的汽车尾气催化转化净化器,能将80%以上有害尾气转化为无毒气体。试推测写
出净化汽车尾气时,以CuO做催化剂为例,催化反应过程中可能的化学方程式和总
反应方程式:a>a′时___________ _______;a<a′时_________ ___________;
总反应______ _______________。
(4)汽油中的抗震剂Pb(C2H5)4不仅造成严重的环境污染,而且会大大降低有害气体的
转化的速度,后一种现象叫做_______ ___。
新课程高三化学综合测试
参考答案
综合一
1.C 2.A 3.C 4.B 5.C 6.D 7.A 8.A 9. BC 10.D 11.C 12.AC 13. BC 14.C 15.B 16.C
17.D 18.AC
19.(8分)(1)试管、铁架台、酒精灯、带导管的单孔橡皮塞。(4分) (2)将褪色后的溶液加热,看能否恢
复到原来的颜色。若恢复原来的颜色,则乙同学的分析正确,若不能恢复原来的颜色,则甲同学的分析
正确。(4分)
20.(11分)(1)该燃料为混合燃料,不但可以节约石油资源和有效减少汽车尾气的污染,还可以促进农业生产,
综上所述应选A。(1分) (2)④②③①(1分) (3)验证CO2存在;除去混合气体中的CO2;证明CO2
已被除尽。(3分) (4)将CO氧化成CO2;澄清石灰水;检验由CO与CuO反应所生成的CO2,从而
确证有CO气体。(3分) (5)无水硫酸铜;H2O(2分) (6)点燃(或收集)(1分)
21.(7分)
(1)NaNO3 (1分)
(2)3Fe+2NO3-+8H+![]() 3Fe2++2NO↑+4H2O
(1分)
3Fe2++2NO↑+4H2O
(1分)
(或:Fe+NO3-+4H+![]() Fe3++NO↑+2H2O
Fe3++NO↑+2H2O
2Fe3++Fe![]() 3Fe2+)
3Fe2+)
(3)由反应④:NO+2HNO3(浓)![]() 3NO2+H2O
(1分)
3NO2+H2O
(1分)
可知在浓HNO3中不能生成NO (1分)
(4)4Fe(NO3)2+4Na2O2+6H2O![]() 4Fe(OH)3↓+O2↑+8NaNO3 (3分)
4Fe(OH)3↓+O2↑+8NaNO3 (3分)
22.(13分)⑴H—O—O—H,(1分)H2O2![]() H++HO2-,(1分)HO2-
H++HO2-,(1分)HO2-![]() H++O22-(1分)
H++O22-(1分)
⑵还原(1分),氧化(1分) ⑶H2O2的还原产物为H2O,反应时不产生污染物(2分)
⑷Na2O2+CO2+H2O=Na2CO3+H2O2(1分),2H2O2![]() 2H2O+O2↑(1分)
2H2O+O2↑(1分)
⑸Cu+H2O2+2H+=Cu2++2H2O(1分) ⑹MgCl2+Na2SiO3=MgSiO3↓+2NaCl(1分)
⑺降低过碳酸钠的溶解度,有利于晶体析出。(1分) ⑻D(1分)
[提示说明]H2O2是新教材上新增加的内容,应强化训练。
23. (10分)[说明] 本题综合了重要的金属、非金属及有机化合物知识,知识跨度大,全面考查考生运用所
学内容分析问题解决问题的能力。 ①根据题意较易判断C为C12,故A为氯化物,B为常见金属或
非金属单质,而且B能够连续两次氧化,所以满足题意的B为金属单质Na,则A为NaCl,D为Na2O,
E为Na2O2。 ②E为易挥发的固体酸酐,可推断E为SO3,则D为SO2,B为S,A为H2S。催化
剂、加热。 ③据题意,E可能为有机化合物中的酸。B为无氧化合物,可能是烃。B经过两次氧化
后形成酸,又据题意知是同系物中相对分子质量最小的物质,故B为CH2=CH2,则A为CH3CH2OH,
D为CH3CHO,E为CH3COOH。A、B、D、E中只有B难溶于水,A、D、E均易溶于水。
24.(10分)
(1)0.160 mol (2)4∶3∶2
⑶
25.(8分) [说明] 本题考查学生应用阿伏加德罗定律确定气态物质化学式的计算以及利用讨论法解题的能
力。当C12占体积分数0.2时,即C12为1L时,反应后气体体积减少1L;当NO2占体积分数0.4时,
即2L时,反应后气体体积也减少1L。根据阿伏加德罗定律可知,C12+2NO2=2NClO2,即A的化学式
为NClO2,至此,不难求出当C12不是或NO2不足时,反应后总体积随C12所占体积分数变化的函数关
系。
(1)A的化学式为NClO2,发生反应的化学方程为 C12+2NO2=2NClO2(2分)
⑵ 当x≤![]() 时,V=(5-5x)L (3分) 当x>
时,V=(5-5x)L (3分) 当x>![]() 时,V=2.5(x+1)L (3分)
时,V=2.5(x+1)L (3分)
26. (11分) (1)辛烷燃烧C8H18+12.5O2![]() 8CO2+9H2O (2分)
8CO2+9H2O (2分)
a=![]() =0.016 即a>0.016 (2分)
=0.016 即a>0.016 (2分)
(2)CO NOx(NO和NO2) (2分)
(3)CO+CuO=CO2+Cu,2NOx+2xCu= xN2+2xCuO 总反应 2xCO+2NOx![]() 2xCO2+xN2 (3分)
2xCO2+xN2 (3分)
(4)催化剂中毒 (2分)