高考化学全真模拟试卷1
试卷命题指导思想:
本试卷是针对第一轮复习成果进行目标检测。命题时一方面力求紧扣“双基”,检查学生经过第一轮复习后对基础知识与基本技能的掌握情况;另一方面又重视“能力”,考查学生分析解决实际问题的能力。命题时注意了知识覆盖面以及各知识块的比例。整卷难度大致控制在0.6左右。希望本测试卷能对第一轮复习能起到良好的查漏被缺作用,同时对第二轮复习能起到一定的指导作用。
第I卷(选择题,共72分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 P 31 Cl 35.5 Na 23 K 39
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.为防“非典”,室内空气可用0.8%的过氧乙酸(C2H4O3)喷雾消毒。过氧乙酸不稳定,有刺激性很强的醋酸气味。则过氧乙酸的结构简式可能是 ( )

2.下列说法确有例证的是:①两种弱酸反应生成两种强酸;②某弱碱通过反应生成某强碱;③两种弱酸盐反应生成两种强酸盐;④有单质参与的反应不一定是氧化还原反应。
A.②④ B.①③ C.①②③ D.①②③④
3.下列合成溴化钾的方法中,最合理的是 ( )
A.KCl![]() KBr B.Br2
KBr B.Br2![]() FeBr3
FeBr3![]() KBr
KBr
C.Br2![]() KBr D.KOH
KBr D.KOH![]() KI
KI![]() KBr
KBr
4.下列点燃氢气的装置中既安全又正确的是(从右端尖嘴处点火,液体均为水)
( )
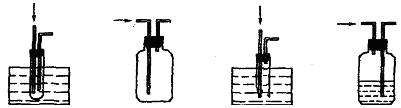
A B C D
5.某含结晶水的无色透明晶体,可能是明矾或草酸晶体,下列有诸位同学设计的鉴别实验方案,其中正确的组合是 ( )
①检验K+ ②检验Al3+ ③用胶体性质检验 ④用石蕊试液检验 ⑤用把加热分解产物通入石灰水中的方法检验 ⑥用碳酸钠溶液检验 ⑦用酸化的高锰酸钾溶液检验 ⑧用蓝黑墨水检验
 A.全部正确 B.其中6个正确
A.全部正确 B.其中6个正确
C.可用NaHCO3溶液鉴别 D. 其中5个正确
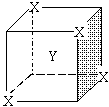
6.某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为 ( )
A. 90° B. 60° C. 120° D. 109°28′
7.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.没有氢键就没有生命
D.H2O是一种非常稳定的化合物,这是由于氢键所致
8.在反应:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4 达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
( )
2Fe(SCN)3+3K2SO4 达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
( )
A.KSCN B.K2SO4 C.NaOH D.FeCl3
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.热化学方程式:S(g)+O2(g)=SO2(g);△H=-297.3kJ/mol,分析下列说法中正确的是 ( )
A.S(g)+O2(g)=SO2(l); △H>297. 3kJ/mol
B.S(g)+O2(g)=SO2(l); △H<297. 3kJ/mol
C.1mol SO2的键能总和大于1mol S和1mol O2键能之和
D.1mol SO2的键能总和小于1mol S和1mol O2键能之和
10.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
( )
A.Cl-、Mg2+、NO3—、K+ B.NH4+、Cl-、Na+、Ba2+
C.SO42—、Cl-、CO32—、Na+ D.HCO3—、K+、NO3—、SO42—
11.下列说法正确的是 ( )
A.124g白磷中含有P-P键的个数为4NA
B.12g石墨中含有C-C键的个数为2NA
C.12g金刚石中含有C-C键的个数为2NA
D.60gSiO2中含有Si-O键的个数为2NA
12.下列反应的离子方程式正确的是 ( )
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S+2I-+H+
D.FeBr2溶液与等摩尔Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
13.已知化合物A (C4Si4H8) 与立方烷(C8H8)的分子结构相似,如下图,则C4Si4H8的二氯代物的同分异构体数目为 ( )
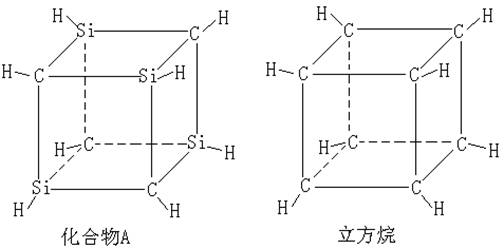 A.3
B.4 C.5 D.6
A.3
B.4 C.5 D.6
14.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于 ( )
A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2
15.将羧酸的碱金属盐电解可生成烃类化合物,例如
|
2CH3COOK+2H2O=====CH3—CH3↑+2CO2↑+H2↑+2KOH
![]()
|
( )
A.CO2气体在阴极放出
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体物质是KOH
D.混合液蒸干后得到的固体物质是KCl
16.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是 ( )
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
17.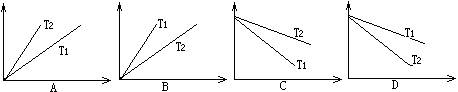 在一容积可调的密闭容器内使乙烯和活性炭接触,一部分乙烯被活性炭吸附,使压强减小,吸附总伴随着热的放出。在一定温度下,单位质量的活性炭中所吸附的乙烯的质量(用纵坐标表示)随压强的改变(用横坐标表示)所应有的关系正确的是(图中T1、T2表示温度,且T1>T2)
( )
在一容积可调的密闭容器内使乙烯和活性炭接触,一部分乙烯被活性炭吸附,使压强减小,吸附总伴随着热的放出。在一定温度下,单位质量的活性炭中所吸附的乙烯的质量(用纵坐标表示)随压强的改变(用横坐标表示)所应有的关系正确的是(图中T1、T2表示温度,且T1>T2)
( )
18.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为 ( )
A.1~2mol之间 B.1~4mol之间 C.2~4mol之间 D.大于4mol
第II卷(非选择题,共78分)
![]() 三、(本题包括2小题,共22分)
三、(本题包括2小题,共22分)
19.(9分)(1)右图是中学化学实验中的一种常用装置,若要在仅盛有少量水的水槽的条件下检查其气密性(不得使用任何导管、橡皮管,且不得拔下橡皮塞等),其操作方法和现象是________________________。
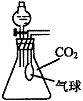 (2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
(2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
①当气球无变化时,锥形瓶中溶质为 ;
②当气球膨胀时,锥形瓶中溶质为 ;
③当气球瘪凹时,锥形瓶中溶质为 。
20.(13分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
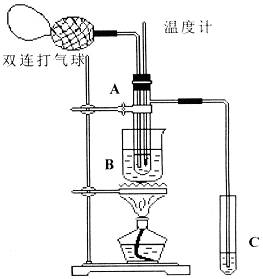
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。
该方案为___________________________________________________________。
四、(本题包括2小题,共18分)
21.(6分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
(1)试写出乙烷气体燃烧的热化学方程式_______________;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是_____________________。
22.(12分)A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,它们之间存在如下图的所示的转化关系。由此推断:
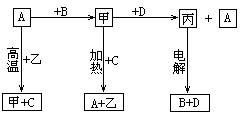
(1)元素A有可变化合价,则A单质的名称_________,甲的化学式为________,乙的电子式为_________。
(2)试判断A和C的还原性强弱(在通常条件下):A________C(填“大于”、“小于”)。
(3)写出甲和D反应的化学方程式_____________________________。
(4) 已知D能与烧碱溶液反应,写出D与烧碱溶液反应的离子方程式__________。
五、(本题包括2小题,共18分)
23.(8分)化合物CO、HCOOH、OHC-COOH分别燃烧时,消耗O2和生成的CO2的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O),也就是说只要分子式符合[(CO)m(H2O)n](m和n为正整数)的各种有机物,它们燃烧时消耗的O2和生成的CO2的体积比总是1︰2。现有一些含C、H、O三种元素的有机物,将它们在足量空气中燃烧,再将所得的混合气体(包括水蒸气)通过Na2O2层(反应完全),发现实际消耗O2的(燃烧消耗O2的体积减去气体通过Na2O2层后生成的体积)与生成CO2的体积之比为1︰4。
(1)在满足已知条件的有机物中,相对分子质量最小的化合物的分子式是 ;
(2)这些有机物满足的通式是 ;
(3)某两个碳原子数目相同的上述有机物,若它们的相对分子质量分别为a和b(a<b),则a和b满足的一般关系式是 。
24.(10分).已知R—CH=CH2+H2O![]() RCHOHCH3。现有含C、H、O的有机物A——F,相互之间的转化关系如下图所示:
RCHOHCH3。现有含C、H、O的有机物A——F,相互之间的转化关系如下图所示:
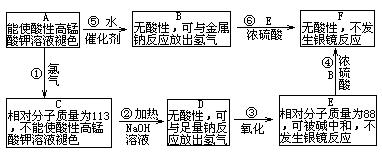
(1)化合物A→F相互转化的关系中属于取代反应的有_______(填反应序号);
(2)化合物A和F的结构简式为:A______,F________。
六、(本题包括2小题,共20分)
25.(8分)10℃时取100g水配制氯化钾的饱和溶液,又取50g水加入35.4g硝酸钠配成溶液,然后将两种溶液混合,发现有晶体析出。试通过计算指出晶体是什么物质? 10℃时几种物质的溶解度(g/100g水)
| NaNO3 | NaCl | KNO3 | KCl |
| 80 | 35.8 | 20.9 | 31 |
26.(12分)在NO2和O2的混合气体中,NO2所占的体积分数为x。用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内剩余VmL气体。
(1)试确定x的取值范围与剩余气体体积V的函数关系:V=f(x)。
(2)若最终剩余10ml气体,则原混合气体中NO2的体积分数是多少?
(3)若原50mL混合气体中含有少量N2(小于1mL),请判断在上述条件下,这些N2的存在对第(2)题的计算结果有无影响。
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.A 2.D 3.B 4.C 5.C 6.D 7.C 8.B
二、(本题包括10小题)
9.AC 10.AD 11. C 12.CD 13.B 14.C 15.D 16.AD 17.A 18.B
三、(本题包括2小题,共22分)
19.(1)将装置倒置使A、B两管都浸入水中,两手紧贴烧瓶外壁,若导管口有气泡出现,把手移开,随后导管A、B中均形成一段水柱,说明装置不漏气。(3分)
(2)①Na2CO3(2分) ②Na2CO3与NaHCO3或NaHCO3 (2分) ③NaOH与Na2CO3(2分)
20.(1)![]() (2分)
(2分)
(2)试管A的反应液中(1分) 略低于试管A的支管口处(1分) 收集含乙酸的馏分(1分)
(3)使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C(3分) 乙二醇或甘油(只写一个)(2分)
(4)方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸。
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成(答案合理均正确)。(3分)
四、(本题包括2小题,共18分)
21.(1)2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2O(l);△H= —3119.6kJ/mol (2分)
4CO2(g)+6H2O(l);△H= —3119.6kJ/mol (2分)
(2)72% (2分)
(3)烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右 (2分)
22.(1)铁(1分) Fe3O4(1分)
![]() (2分) (2)大于(2分)
(2分) (2)大于(2分)
(3)3Fe3O4+8Al![]() 9Fe+4Al2O3 (3分)
9Fe+4Al2O3 (3分)
(4)2Al+2OH—+2H2O=2AlO2—+2H2O (3分)
五、(本题包括2小题,共18分)
23.(1)C2H4O (2分) (2)(C2O)mH2n(2分)
(3)b-a=2k(k为自然数)(4分)
24.(1)②④⑥ (4分)
(2)A:CH3CH=CH2(3分) F:CH3COCOOCH(CH3)2(3分)
六、(本题包括2小题,共20分)
25.(1)原来的硝酸钠溶液是不饱和溶液,混合后溶剂增加,硝酸钠更不饱和;原来氯化钾是饱和溶液,混合后也变为不饱和,因而硝酸钠、氯化钾不会成为晶体析出。
(2分)
(2)混合溶液中的4种离子,也可能结合成硝酸钾、氯化钠成为晶体析出。
NaNO3+ KCl== KNO3+ NaCl
85 74.5 101 58.5
x 31 y z
x=35.4(g) 恰好反应完全
y=42.0(g) (1分)
z=24.3(g) (1分)
(3)已知10℃时氯化钠的溶解度为35.8g,硝酸钾的溶解度为20.9g。150g水中最多溶解NaCl的质量为W,KNO3的质量为m
则100:150=35.8:w w=53.7(g) 53.7>24.3(不会有NaCl晶体析出)(2分)
100:150=20.9:m m=31.4(g)
31.4<42.0,可知析出晶体硝酸钾10.6g。 (2分)
26.混合气体在溶液中发生的反应可能有:①4NO2+O2+2H2O=4HNO3;②3NO2+H2O=2HNO3+NO。 (2分)
(1)若x≤80%,剩余气体可能为0或全部为O2,可认为只发生反应①,则有:V=50-(50x+50x/4)=50-62.5x (2分)
若x>80%,上述反应①和反应②均会发生,则有:
V=![]() {50-[(1-x)×50+(1-x)×50×4]}=
{50-[(1-x)×50+(1-x)×50×4]}=![]() (250x-200)
(2分)
(250x-200)
(2分)
(2)当x≤80%时,有:10=50-62.5x得x=64% (1分)
当x>80%时,有:10=![]() (250x-200)得x=92%
(1分)
(250x-200)得x=92%
(1分)
(3)假设混合气中有1mLN2,在x=64%时,![]() ,仍然是O2过量,故在题设条件下少量N2的存在对计算所得NO2的体积分数(64%)没有影响。
(2分)
,仍然是O2过量,故在题设条件下少量N2的存在对计算所得NO2的体积分数(64%)没有影响。
(2分)
若剩余的10mL气体是NO和N2,则其中只有9mLNO,故发生反应①后剩余NO2的体积应为27mL,反应①中消耗的NO2的体积=![]() 17.6mL。所以混合气体中NO2的实际体积分数=
17.6mL。所以混合气体中NO2的实际体积分数=![]() =89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)
=89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)
| 题号 | 难度 | 命题意图 | 学生的典型错误 |
| 1 | 0.8 | 须关注社会,关注身边的事 | 不能分析清楚过氧键的位置而错选C |
| 2 | 0.6 | 从隐性角度考查氧化还原反应的知识 | 学生储备知识不够(如HClO与H2SO3的反应及相应的盐发生氧化还原反应)而错选A |
| 3 | 0.7 | 结合所学知识分析化工生产的合理性 | 忽略Fe3+与CO32-发生双水解反应而错选D |
| 4 | 0.5 | 考查基本实验操作技能 | |
| 5 | 0.7 | 对新教材草酸性质的考查 | 不了解草酸的性质而错选A、B、D |
| 6 | 0.5 | 空间想像能力的考查 | 对不同结构的正四面体空间构型(如P4、CH4)掌握不透而错选B |
| 7 | 0.4 | 能否正确理解物质结构中的分子间作用力 | 认为氢键是化学键而不是分子间作用力而错选B |
| 8 | 0.5 | 浓度对化学平衡移动的影响 | 没有从离子反应的角度去分析而错选A、C、D |
| 9 | 0.6 | 考查键能与反应热的关系 | 没有掌握键能与反应热的关系而错选 |
| 10 | 0.65 | 考查离子共存问题 | A中由于NO3-离子的存在,在酸性条件下不可能产生H2 |
| 11 | 0.5 | 阿佛加德罗常数的又一种考查方式 | 不了解常见晶体的空间构型而错选 |
| 12 | 0.65 | 离子方程式的书写 | 不熟悉元素化合物的知识而错选 |
| 13 | 0.6 | 同分异构体的书写 | 由于机械类比而错选A |
| 14 | 0.65 | pH的定量计算 | 没有掌握近似计算而错选 |
| 15 | 0.4 | 电化学与有机化学的结合 | 没有考虑卤代烃在碱性条件下水解而错选B、C |
| 16 | 0.65 | 离子浓度的大小比较 | 没有掌握水的离子积常数意义而漏选A |
| 17 | 0.65 | 化学平衡图像分析 | 没有把题给文字翻译成化学方程式而错选 |
| 18 | 0.5 | 过量问题计算 | 不能分析清楚CO2、H2O与Na2O2反应情况而错选 |
| 19 | (1)0.7 | 化学基本实验操作 | 学生的迁移能力不够 |
| (2)0.6 | 通过结论分析条件,考查学生的逆向思维能力 | ||
| 20 | 0.65 | 综合实验 | 实验的设计、评价是一个重点、难点,学生的得分普遍不高 |
| 21 | 0.6 | 考查学生的数据处理能力 | 不能从图表中提炼取有效信息,没有掌握燃烧热的概念 |
| 22 | 0.6 | 无机框图题的考查 | 没有重视常见物质的置换反应而找不到解题的突破口 |
| 23 | 0.7 | 以有机物的推断为载体,对学生收敛与发散思维能力的考查 | 部分学生由于被已知条件迷惑而进入死故同 |
| 24 | 0.65 | 有机物的推断与合成 | 本题得分率为0.448,区分度为0.693,与预期值相符 |
| 25 | 0.6 | 溶解度计算 | 不清楚易溶于水的盐的溶解平衡,故本题得分率不高 |
| 26 | 0.7 | 综合讨论型计算 | (1)(2)问与预期值相符,(3)问零分者众多,全卷分数高的考生本题也得分高 |
备用题
工业生产从海水中提取金属镁的方法是 D
A.![]()
B.![]()
C.![]()
D.![]()
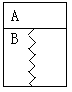 如右图所示,某刚性容器内有一活塞和弹簧,B内为真空,A内已充入2molSO2和1molO2,在一定条件下发生可逆反应2SO2+O2
如右图所示,某刚性容器内有一活塞和弹簧,B内为真空,A内已充入2molSO2和1molO2,在一定条件下发生可逆反应2SO2+O2 ![]() 2SO3;ΔH=-Q(Q>0),此时活塞已保持静止,SO2反应速率为V0。再往A内迅速充入2mol SO2和1molO2,当活塞再次保持静止时,SO2反应速率为V,在此过程中,下列说法正确的是C
2SO3;ΔH=-Q(Q>0),此时活塞已保持静止,SO2反应速率为V0。再往A内迅速充入2mol SO2和1molO2,当活塞再次保持静止时,SO2反应速率为V,在此过程中,下列说法正确的是C
A.活塞先下移,后上移到原静止位置,V>V0
B.活塞先下移,后上移到原静止位置,V=V0
C.活塞先下移,后上移,不到原静止位置,V>V0
D.活塞先下移,后上移,不到原静止位置,V=V0
关于(I)和(II)两个反应的下列说法中正确的是B
(I)2HCl+Na2O2=2NaCl+H2O2 (II)2CO2+2Na218O2=2Na2CO3+O2
①Na2O2是碱性氧化物 ②H2O2呈现弱酸性
③Na2CO3的式量是108 ④SO2也能与Na2O2反应生成Na2SO3
A.①② B. ②③ C. ③④ D.①④
有nmol分子中碳原子数不超过3的有机物,在amolO2中完全燃烧后的产物只有CO2和H2O,已知燃烧前后物质的量不发生改变。则n的最大值为A
A.a B.a/2 C.a/3 D.2a
现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
请利用交换膜技术,根据下图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质名称。A:______,B:_______,C:______,D:______,E:______,F:______,G:_______。膜b为______(填“阳离子交换膜”或“阴离子交换膜”)。
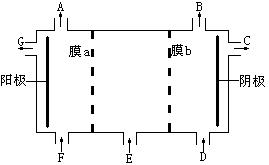
A:O2,B:H2,C:NaOH,D:H2O(可含少量NaOH),E: Na2SO4,F:H2O(可含少量H2SO4),G:H2SO4。膜b为阳离子交换膜。
A、B、C都是含C、H、O、N四种元素的有机化合物。1molA隔绝空气经加热分解后得到1molB和1molCO2,且有机物的质量减少了29.53%,B是天然蛋白质水解的最终产物,经红外光谱分析得知,B分子结构中不含甲基,除-COOH外,还含有一个-OH。C属于硝酸酯类化合物,又是B的同分异构体。回答下列问题:
(1)A的相对分子质量是___________;
(2)B的结构简式是_______________;
(3)C可能的几种结构简式是_______________________________________。
149 (2)HOCH2CH(NH2)COOH (3)CH3CH2CH2ONO2或(CH3)2CHONO2
物质A至F有如下转化关系,反应①、②、③均是在高温下进行的(必要时可使用催化剂)。A是最常见的金属单质,B是最常见的溶剂,E分子与N2分子具有相同的电子数。
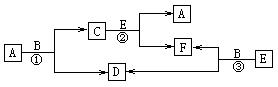
回答下列问题:
(1)上表中反应①的化学方程式是_________________。
(2)上表中反应③的化学方程式是_________________。
(3)写出一个B作还原剂的化学反应方程式___________________________。
(4)写出一个F作氧化剂的化学反应方程式___________________________。
(1)3Fe+4H2O![]() Fe3O4+4H2 (2)CO+H2O
Fe3O4+4H2 (2)CO+H2O![]() CO2+H2
CO2+H2
(3)2F2+2H2O=4HF+O2
(4)C+CO2![]() 2CO或CO2+2Mg
2CO或CO2+2Mg![]() 2MgO+C
2MgO+C
有50mlNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
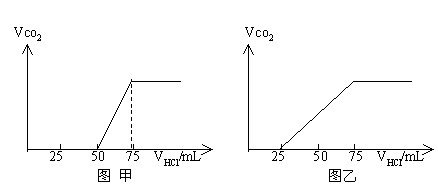
试分析NaOH在吸收CO2气体后,在甲乙两种情况下,所得溶液中存在的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标况)是多少?
答案:NaOH溶液中通入一定量的CO2,有几种情况:一种是CO2不足,反应后的混合物为NaOH、Na2CO3;另一种情况是恰好反应生成![]() ;第三种是
;第三种是![]() 过量,全部将
过量,全部将![]() 转化为
转化为![]() ;第四种为
;第四种为![]() 、
、![]() 的混合物。
的混合物。
分析图象甲:加入盐酸50mL时开始产生![]() ,至反应完毕消耗25mL盐酸,根据反应:
,至反应完毕消耗25mL盐酸,根据反应:
![]() ①
①
![]() ②
②
可知滴加到50mL时开始反应②,根据耗酸量可知![]() 的物质的量。分析图象加入盐酸50mL以前,无气体放出,
的物质的量。分析图象加入盐酸50mL以前,无气体放出,![]() 与盐酸反应转化为
与盐酸反应转化为![]() 应消耗25mL盐酸,则与NaOH反应的盐酸也是25mL,由此得出甲成分只能为
应消耗25mL盐酸,则与NaOH反应的盐酸也是25mL,由此得出甲成分只能为![]() 和
和![]() ,且物质的量之比为1:1,产生
,且物质的量之比为1:1,产生![]() 的体积为0.056L。
的体积为0.056L。
分析图象乙:滴加盐酸25mL时,开始有气体放出,消耗50mL盐酸反应完全,耗酸为未产生气体时的2倍,说明原物质是![]() 和
和![]() 的混合物,由耗酸量可判断出物质的量之比为1:1,产生气体亦可由产生气体耗酸量求得为0.112L。
的混合物,由耗酸量可判断出物质的量之比为1:1,产生气体亦可由产生气体耗酸量求得为0.112L。