高考化学试题5
第Ⅰ卷
一、选择题(本题共20分),每小题2分,只有一个正确选项,答案涂写在答题纸上
1、下列物质中,可用于治疗胃酸过多的是
A 碳酸钠 B 氢氧化钠 C 氧化钠 D 碳酸钡
2、近年来,加“碘”食盐田较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是
A I2 B KIO C NaIO D KIO3
3、![]() 下列电子式书写错误的是
下列电子式书写错误的是
A H O H B N N
![]()
![]() H
H
C [ O H]- D [H N H]+
H
4、钛(Ti)金属常被称为未来钢铁。钛元素的同位素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中,中子数不可能为
中,中子数不可能为
A 30 B 28 C 26 D 24
5、0.05mol某单质与0.8g硫在一定条件下完全反应,该单质可能是
A H2 B O2 C K D Zn
6、 下列反应中,调节反应物用量或浓度不会改变反应产物的是
A 硫化氢在氧气中燃烧 B 铁在硫蒸气中燃烧
C 二氧化硫通入石灰水 D 硫酸中加入锌粉
7、二氧化氮存在下列平衡:2NO2(g)ÛN2O4(g)+Q 在测定NO2的相对分子量时,下列条件中较为适宜的是
A 温度130℃、压强3.03×105Pa B 温度25℃、压强1.01×105Pa
C 温度130℃、压强5.05×104Pa D 温度0℃、压强5.05×104Pa
8、在100g浓度为18mol/L、密度为ρ(g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积为
A 小于100mL B 等于100mL C 大于100mL D 等于100/ρmL
9、在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为
A 1.34mL B 2.240mL C 0.672mL D 0mL
10、以下现象与电化腐蚀无关的是
A 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B 生铁比软铁芯(几乎是纯铁)容易生锈
C 锈质器件附有铜质配件,在接触处易生铁锈
D 银质奖牌久置后表面变暗
二、选择题(本题共30分),每小题3分,只有一个正确选项,答案涂写在答题纸上
11、下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是 ①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液 ③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用洒精中
A ②③①④ B ③②①④ C ③①②④ D ①②③④
12、设阿佛加德罗常数的符号为NA,标准状况下某种O2和N2的混合气体m克含有b个分子,则n克该混合气体在相同状况下所占的(L)体积应是
A 22.4nb/NA B 22.4mb/bNA C 22.4nNA/mb D nbNA/22.4m
13、冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl+O3→ClO+O2 ,ClO+O→Cl+O2下列说法不正确的是
A 反应后将O3转变为O2 B Cl原子是总反应的催化剂
C 氟氯甲烷是总反应的催化剂 D Cl原子反复起分解O3的作用
14、将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得![]() 、
、![]()
![]() ,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO
,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO![]() ),则K+为
),则K+为
A 0.045mol/L B 0.035mol/L C 0.055mol/L D 0.040mol/L
15、反应速度V和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度V可表示为V=K![]() 式中K为常数,m、n值可用下表中数据确定之。
式中K为常数,m、n值可用下表中数据确定之。
|
|
| V(mol/L·s) |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
由此可推得,m、n值正确的是
A m=1、n=1 B
m=![]() 、n=
、n=![]() C m=
C m=![]() 、n=1 D m=1、n=
、n=1 D m=1、n= ![]()
16、下列各组离子在水溶液中能大量共存的是
A Na+ 、HS- 、Cu2+ 、Cl- B HS- 、Na+ 、OH- 、K+
C K+ 、CO![]() 、Br- 、AlO
、Br- 、AlO![]() D H+ 、Cl- 、Na+ 、SO
D H+ 、Cl- 、Na+ 、SO![]()
17、同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3 ②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A ①>② B ①<② C ①=② D 不能确定
18、甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A 5.4g B 3.6g C 2.7g D 1.6g
19、根据下列反应判断有关物质还原性由强到弱的顺序是
20、某强酸溶液,强碱溶液,已知,酸碱溶液混合后,则酸溶液体积(酸)和碱溶液体积(碱)的正确关系为
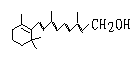 三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分,答案涂写在答题纸上
三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分,答案涂写在答题纸上
21、己知维生素A的结构简式可写为
式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是
A 维生素A的分子式为C20H30O B 维生素A 是一种易溶于水的醇
C 维生素A分子中有异戊二烯的碳链结构 D 1mol维生素A 在催化剂作用下最多可
与7molH2发生加成反应
22、下列离子方程式书写正确的是
A 过量氯气通入溴化亚铁溶液中 3Cl2+2Fe2++4Br-→6Cl-+2Fe3++2Br2
B 过量二氧化碳通入偏铝酸钠溶液中 CO2+2H2O+AlO![]() →Al(OH)3↓+HCO
→Al(OH)3↓+HCO![]()
C 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合 NH![]() +HSO
+HSO![]() +2OH-→SO
+2OH-→SO![]() +NH3↑+2H2O
+NH3↑+2H2O
D 碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO![]() +Ca2++2OH-→CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-→CaCO3↓+2H2O+MgCO3↓
23、![]()
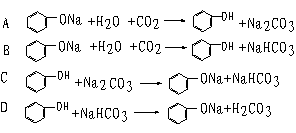 已知酸性强弱顺序为H2CO3> >HCO
已知酸性强弱顺序为H2CO3> >HCO![]() ,下列化学方程式正确的是
,下列化学方程式正确的是
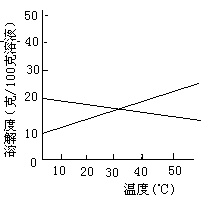 |
24、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl.NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
| 通入气体 | 温度控制 | |
| (A) (B) (C) (D) | CO2 CO2 NH3 NH3 | 30~40℃ 0~10 ℃ 30~40 ℃ 0~10℃ |
25、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为
A Mg B Ca C Sr D Ba
第Ⅱ卷
四、(本题共24分)
26、智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数
NaIO3 + NaHSO3→ NaHSO4+ Na2SO4+ I2+ H2O
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO![]() 离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:
离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:
27、a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a微粒的核外电子排布式
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示) (3)d溶于水的电离方程式
(4)g微粒所构成的晶体类型属 (5)c微粒是 ,f微粒是
(用化学式表示)
28、汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有 (多选扣分)
a 开发氢能源 b 使用电动车 c 植树造林 d 戴上呼吸面具
29、高炉炼铁中发生的基本反应之一如下:FeO(固)+CO(气)≒Fe(固)+CO2(气)-Q ,其平衡常数可表达为 K=![]() ,已知1100℃时,K=0.263 。
,已知1100℃时,K=0.263 。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO和体积比值
平衡常数K值 (本小题空格均备选:增大、减小或不变)
(2)1100℃时测得高炉中[CO2]=0.025mol/L [CO]=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态 (选填是或否),此时,化学反应速度是V正 V逆(选填大于、小于或等于),其原因是
五、(本题共22分)
30、用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-→2NO![]() +H2O②气体液化温度:NO2 21℃ NO -152℃
+H2O②气体液化温度:NO2 21℃ NO -152℃
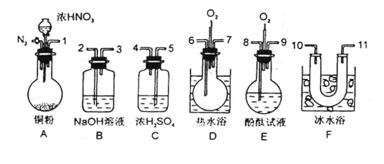 |
试回答:(1)仪器的连接顺序(按左→右连接,填各接口的编号)为
(2)反应前先通入N2目的是 (3)确认气体中含NO的现象是 (4)装置F的作用是
(5)如果O2过量,则装置B中发生反应的化学方程式为:
31、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
 粗盐 H2O NaOH Na2CO3 Cl2 H2
粗盐 H2O NaOH Na2CO3 Cl2 H2
10%NaOH 、16%NaCl溶液
![]()
沉渣 NaCl晶体
50%NaOH溶液
依据上图,完成下列填空:(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH值
(选填:不变、升高或下降) (2)工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为 ,
(3)如果粗盐中SO![]() 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO![]() ,该钡试剂可以是
(选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
,该钡试剂可以是
(选填a、b、c,多选扣分) a Ba(OH)2 b
Ba(NO3)2 C BaCl2
(4)为有效除去Ca2+、Mg2+、SO![]() ,加入试剂的合理顺序为
(选填a,b,c多选扣分)
,加入试剂的合理顺序为
(选填a,b,c多选扣分)
a 先加NaOH,后加Na2CO3,再加钡试剂 b 先加NaOH,后加钡试剂,再加Na2CO3
c 先加钡试剂,后加NaOH,再加Na2CO3 (5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl (6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
六、(本题共18分)
32、化学式为C8H10O的化合物A 具有如下性质:①A+Na→慢慢产生气泡 ②A+RCOOH![]() 有香味的产物 ③A
有香味的产物 ③A![]() 苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成主要的“白色污染”源之一)。
试回答:(1)根据上述信息,对该化合物的结构可作出的判断是 (多选扣分) a苯环上直接连有羟基 b肯定有醇羟基 c苯环侧链未端有皿基 d肯定是芳香烃
(2)化合物A的结构简式 ,(3)A和金属钠反应的化学方程式
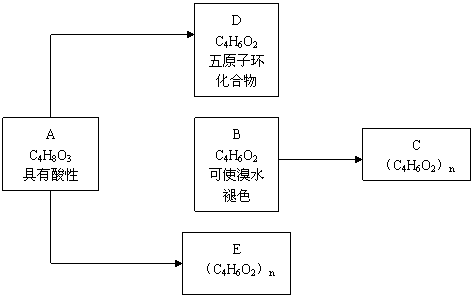
33、化合物C和E都是医用功能高分子材料,且有相同的元素百分组成,均可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。
 |
浓H2SO4
一定条件下
![]() 浓H2SO4
浓H2SO4
一定条件下
试写出:化学方程式A→D ,
B→C ,反应类型A→B ,B→C A→E ,A的结构简式的同分异构体(同类别且有支链)的结构简式: 及
七、(本题共16分)
34、近年来。工业上用Mg(NO3)2替代浓H2SO4作为制取浓HNO3的脱水剂(以下数据均为质量百分比浓度)。65%HNO3(质量为M1)中加72%Mg(NO3)2溶液(质量为M2)后蒸馏。分别得到97.5%HNO3和60%Mg(NO3)2溶液(不含HNO3)。(1)若蒸馏过程中HNO3、Mg(NO3)2、H2O均无损耗,求蒸馏前的投料比M1/M2的值。(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有M1+M2×5.0%的H2O流失。则投料时,比值M1/M2应该 (选填增大、减小或不变)。
35、石油及其分馏产物在供氧不足时燃烧,常常产生CO,这也是常见的大气污染物之一。将某气态烃在5倍体积的纯氧中燃烧,产物通过足量Na2O2并在电火花连续作用下充分反应,生成的气体体积缩小到燃烧后产物体积的3/8(气体体积都在100℃以上,1.01×105Pa时测定)
(1)试写出通式为CXHY的某烃在供氧不足时燃烧的化学方程式 (CO2的系数设定为m)
(2)当m=2时,求该烃的分子式。
(3)若1摩某气态烃在供氧不足时燃烧,产物在足量Na2O2的电火花连续作用下产生3摩氧气,且固体Na2O2增重范围为90克≤△W≤118克,求烃可能的分子式和燃烧产物CO与CO2的物质的量之比,将结果填入下表
| 烃的分子式 | nco/nCO2 |
1998年上海高考化学试卷答案
第Ⅰ卷
一、1.B 2.D 3.B 4.A 5.C 6.B 7.C 8.A 9.D 10.D 二、11.B 12.A 13.C 14.B 15.D 16.C17.C 18.A 19.A 20.B 三、21.A C 22.A B 23.B C 24.D 25.B C 10e
![]() 第Ⅱ卷
第Ⅱ卷
四、26 (1)2 5-3 2 1 1(说明:错一个即不给分) 电子转移方向、总数NaIO3 NaHSO3
(2)开始阶段,由于HSO![]() 被氧化生成H+和SO
被氧化生成H+和SO![]() ,酸性增强,反应速度增大
,酸性增强,反应速度增大
27、(1)1s22S22p6 (2)NaOH>Mg(OH)2
`(3)NH3+H2O≒NH3·H2O≒NH![]() +OH- (4)分子晶体
+OH- (4)分子晶体
28、(1)2CO+2NO![]() 2CO2+N2 (2)SO2转化为SO3,产生硫酸酸雾 (3)a b
2CO2+N2 (2)SO2转化为SO3,产生硫酸酸雾 (3)a b
29、(1)增大 增大 (2)否 大于 此时[CO2]/[CO]<0.263,因温度不变,K值不变。为增大[CO2]/[CO]比值,需V正>V逆
五、
30、(1)1 5 4 10 11 6 7 2 (10和11可颠倒)[说明:错一个即不给分] (2)驱赶装置中空气,防止反应产生的NO被氧化 (3)通入O2后装置(D)中有红棕色气体生成
(4)分离NO和NO2(或使NO2液化)[说明:其它合理回答都给分] (5)4NO2+O2+4NaOH→4NaNO3+2H2O
31、(1)2Cl--2e→Cl2 升高 (2)Ca2++CO![]() →CaCO3↓ Mg2++2OH-→Mg(OH)2↓ (3) a c
→CaCO3↓ Mg2++2OH-→Mg(OH)2↓ (3) a c
(4)b c (5)
蒸发 过滤 (6) NaCl+H2O![]() H2↑+Cl2↑+2NaOH
H2↑+Cl2↑+2NaOH
 六、
六、
32、(1)b c (2)
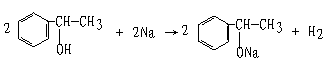 (3)
(3)
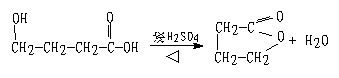 33、A→D
33、A→D
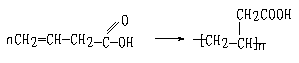 B→C
B→C
A→B 消去反应 B→C 加聚反应 A→E缩聚反应
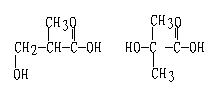 E的结构简式:[-O(CH2)3CO-]n A的同分异构:
E的结构简式:[-O(CH2)3CO-]n A的同分异构:
七、
34、(1)M1+M2=![]() (说明:其它合理解法也给分)
(说明:其它合理解法也给分)![]() (2)增大
(2)增大
35、(1)CXHY + (X/2+Y/4+m/2)O2→O2+Y/2H2O+ X-m)CO2
(2)m=2时,该烃为C4H8 (3)C3H8 1/2 C4H6 1/3