高考化学试题8
第Ⅰ卷
可能用到的数据
原子量:H1 N14 O16 Na23

1.1992年,我国取得的重大科技成果之一是发现了三种元素的新的同
![]()
(A)80 (B)128 (C)208 (D)288
2.下列元素的单质中,最易跟氢气反应生成氢化物的是
(A)硼 (B)氮 (C)氟 (D)碳
3.暂时硬水煮沸后的水垢主要是
(A)Ca(HCO3)2 (B)Ca(OH)2
(C)MgCO3 (D)Mg(OH)2和CaCO3
4.下列各组指定原子序数的元素,不能形成AB2型化合物的是
(A)6和8 (B)16和8
(C)12和9 (D)11和6
5.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
(A)SO2和SiO2 (B)CO2和H2O
(C)NaCl和HCl (D)CCl4KCl
![]()
选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分.选两个且都正确的给3分.但只要选错一个,该小题就为0分.)

7.25毫升pH=10的氢氧化钾溶液跟 50毫升pH=10的氢氧化钡溶液混和,混和液的pH值是
(A)9.7 (B)10 (C)10.3 (D)10.7

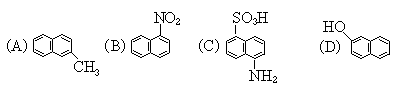
9.下列反应中,有黑色物质生成的是
(A)蔗糖和稀硫酸共热
(B)镁在二氧化碳中燃烧
(C)三氯化铁溶液和氢氧化钾溶液混和
(D)硫粉和铁粉共热
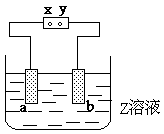
10.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b
极板处有无色无臭气体放出,符合这一情况的是

11.摩尔浓度相等的下列溶液,pH值由大到小的顺序是
(A)Na2CO3 NaHCO3 NaCl NH4Cl
(B)Na2CO3 NaHCO3 NH4Cl NaCl
(C)Na2CO3 NaCl NH4Cl NaHCO3
(D)Na2CO3 NH4Cl NaHCO3 NaCl
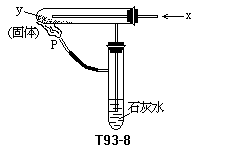
12.按右图装置持续通入x气体,并在管口p处点燃,实验结果使澄清的石灰水变混浊.则x、y可以是
(A)H2和NaHCO3 (B)CO和Na2CO3
(C)CO和CuO (D)H2和Fe2O3
根据以下叙述,回答第13至15题
某化工厂按如下步骤进行生产:(1)以煤为燃料煅烧石灰石;(2)用饱和碳酸钠溶液充分吸收步骤(1)中产生的二氧化碳;(3)使步骤(1)中产生的氧化钙跟水反应;(4)消石灰跟碳酸钠反应.
13.该厂生产过程中涉及的物质有:①石灰石,②纯碱,③小苏打,④烧碱,⑤二氧化碳,⑥消石灰.下列叙述正确的是
(A)起始原料是①② (B)起始原料是②⑥
(C)最终产品是④⑤ (D)最终产品是③④
14.该厂生产过程的优点可能有:①排放的气体对大气无污染;②生产过程中的部分产品可作为起始原料使用;③无高温作业,其中正确的是
(A)只有① (B)只有②
(C)①和③ (D)②和③
![]()
(A)分解反应 (B)化合反应
(C)置换反应 (D)复分解反应
![]()
合题意.)
16.NA代表阿佛加德罗常数,下列说法正确的是
(A)2.3克钠由原子变为离子时,失去的电子数为0.1NA
(B)18克重水(D2O)所含的电子数为10NA
(C)28克氮气所含的原子数为NA
(D)在20℃,1.01×105帕时,11.2升氧气所含的原子数为NA
![]()
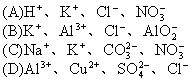
18.能正确表示下列反应的离子方程式是
(A)铁跟盐酸反应:2Fe+6H+=2Fe3++3H2↑
![]()
(C)碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
![]()
19.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.反应中生成的氧化产物和还原产物的物质的量之比是
(A)1:3 (B)2:3 (C)1:1 (D)4:3
20.在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,则AH的电离度是
![]()
21.下列各组溶液,不用其它试剂,就可以将它们区别开的是
(A)盐酸 氢氧化钠 碳酸钠 硫酸钠
(B)盐酸 硝酸铵 氢氧化钠 硝酸钠
(C)氢氧化钠 硫酸镁 碳酸钠 硫酸氢钠
(D)氯化钡 硫酸钠 氯化钙 硝酸钙
22.分子量为M的某物质在室温下的溶解度为S克/100克水,此时测得饱和溶液的密度为d克/厘米3.则该饱和溶液的摩尔浓度是
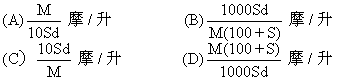
23.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:(1)a、c均能与稀硫酸反应放出气体;(2)b与d的硝酸盐反应,置换出单质d;(3)c与强碱反应放出气体;(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为
(A)Fe Cu Al Ag Mg
(B)Al Cu Mg Ag Fe
(C)Mg Cu Al Ag Fe
(D)Mg Ag Al Cu Fe
24.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已反应的Fe3+和未反应的Fe3+的物质的量之比是
(A)2:3 (B)3:2 (C)1:2 (D)1:1
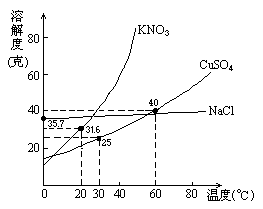
25.下图是几种盐的溶解度曲线.下列说法正确的是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠
26.在一个固定体积的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:
4X(气)+3Y(气) ![]() 2Q(气)+nR(气)
2Q(气)+nR(气)
达到平衡后,容器内温度不变,混和气体的压强比原来增加5%,X的浓度
![]()
(A)3 (B)4 (C)5 (D)6
第Ⅱ卷
可能用到的数据
原子量:H1 C12 N14 O16 Na23
Al27 S32 Cl35.5 Ca40 Br80 Ag108
四、(本题包括2小题,共12分)
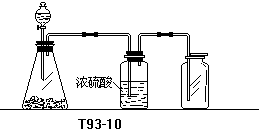
27.(3分)下页左图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是 (填正确选项的标号).
(A)铜屑和浓硝酸
(B)二氧化锰和浓盐酸
(C)电石和水
(D)碳酸钙和稀盐酸
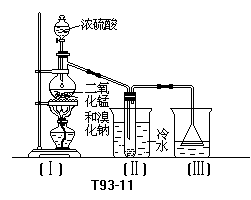
28.(9分)根据右上图实验,填空和回答问题:
(1)烧瓶中所发生的主要反应的化学方程式是 ,装置(Ⅱ)的烧杯中冷水所起的作用是 ,装置(Ⅲ)的烧杯中液体的作用是 .
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为 .
(3)装置(Ⅲ)的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因.
五、(本题包括4小题,共18分)
29.(4分)已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠.现以硫化亚铁为主要原料,按下图制取硫代硫酸钠.图中的A、B、C和D是硫单质或硫的化合物,其它不含硫的反应产物已被略去,各步反应可以添加必要的试剂.
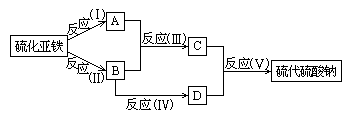
请填写下列空白:
(1)反应(Ⅰ)的化学方程式是: .
(2)物质B的分子式是: .
(3)物质D的分子式是: .
30.(3分)甲、乙两瓶氨水的浓度为1摩/升和0.1摩/升,则甲、乙两瓶氨水中[OH-]之比 (填大于、等于或小于)10.请说明理由.
31.(5分)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大.你的选择是: (填正确选项的标号).试用化学方程式和简要文字表述其理由.
32.(6分)常温下A和B两种气体组成混和气体(A的分子量大于B的分子量),经分析混和气体中只含有氮和氢两种元素,而且,不论A和B以何种
![]()
为 ,其理由是 .若上述混和气体中氮和氢的质量比为7:1,则在混和气体中A和B的物质的量之比为 ;A在混和气体中的体积百分数为 %.
六、(本题包括3小题,共18分)
33.(4分)工程塑料ABS树脂(结构简式如下),合成时用了三种单体.
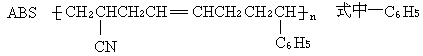
是苯基,这三种单体的结构简式分别是:CH2=CHCN、 、 .
34.(6分)液晶是一类新型材料.MBBA是一种研究得较多的液晶化合物.它可以看作是由醛A和胺B去水缩合的产物.
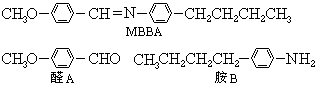
(1)对位上有-C4H9的苯胺可能有4个异构体,它们是:
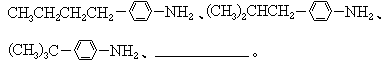
(2)醛A的异构体甚多.其中属于酯类化合物,而且结构式中有苯环结构的异构体就有6个,它们是:
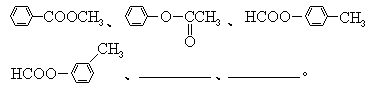
35.(8分)烯键碳原子上连接的羟基中的氢原子,容易自动迁移到烯键的另一个碳原子上,形成较为稳定的羰基化合物:
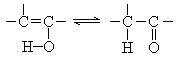
有机分子内、有机分子间常可脱去水分子.下列反应图式中,就有6步可以看作是脱水反应.所有的反应条件和其它无机物都已略去.请从图中情景推断化合物A、B、E、G的结构简式.
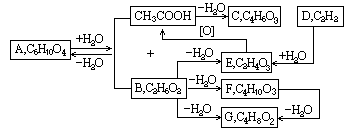
A是 ,B是 ,E是 ,G(有6角环)是 .
七、(本题包括2小题,共18分)
36.(8分)将70克过氧化钠和氧化钠的混和物跟98克水充分反应后,所得氢氧化钠溶液的质量百分比浓度为50%.试分别写出过氧化钠和氧化钠跟水反应的化学方程式,并计算原混和物中过氧化钠和氧化钠的质量各为多少克.
37.(10分)硫酸银的溶解度较小,25℃时,每100克水仅溶解0.836克.
(1)25℃时,在烧杯中放入6.24克硫酸银固体,加200克水,经充分溶解后,所得饱和溶液的体积为200毫升.计算溶液中Ag+的摩尔浓度.
(2)若在上述烧杯中加入50毫升0.0268摩/升BaCl2溶液,充分搅拌,溶液中Ag+的摩尔浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268摩/升BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200摩/升?
试题答案及评分标准
(湖南、云南、海南、北京等省市用题)
一、(本题包括5小题,每小题2分,共10分)
1.B 2.C 3.D 4.D 5.B
二、(本题包括10小题,每小题3分,共30分)
6.D 7.B 8.B、C 9.B、D 10.A
11.A 12.A、C 13.A、D 14.B 15.C
三、(本题包括11小题,每小题4分,共44分)
16.A 17.B 18.C 19.A 20.C
21.C 22.B 23.C 24.A 25.D
26.D
四、(本题包括2小题,共12分)
27.(3分)A、D(只答1个,答对给1分,只答2个,答对给3分,其他答法不给分) (3分)
28.(9分)
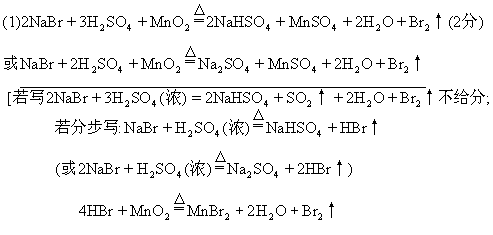
这两步反应全对给2分,对1个给1分.]
冷凝 (1分)
吸收未冷凝的气体 (1分)
(2)溴蒸气会腐蚀橡皮塞和橡皮管 (2分)
(3)答:当气体被吸收时,液体上升到漏斗中.由于漏斗的容积较大,导至烧杯中液面明显下降,使漏斗口脱离液面,漏斗中的液体又流回烧杯内,从而防止了倒吸. (3分)
评分要点:①漏斗容积较大(1分),②烧杯中液面下降,使漏斗口脱离液面(或使液面低于漏斗口)(2分).未答出要点含意的不给分.
五、(本题包括4小题,共18分)
29.(4分)
(1)FeS+2HCl=FeCl2+H2S↑或FeS+H2SO4=FeSO4+H2S↑(用离子方程式表示也同样给分) (2分)
(2)SO2 (1分)
(3)Na2SO3 (1分)
30.(3分)小于 (1分)
答:甲瓶氨水的浓度是乙瓶氨水浓度的10倍,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10. 2分)
31.(5分)C
![]()
(只写后一方程式也算对) (1分)

![]()
32.(6分)
ANH3,BN2(用中文写物质名称也同样给分.每空1分) (2分)

4:1,80%(每空1分)(2分)
六、(本题包括3小题,共18分)
33.(4分)
CH2=CHCH=CH2,CH2=CHC6H5 (每空2分,共4分)
34.(6分)
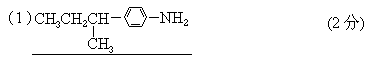
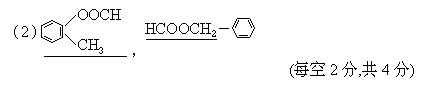
35.(8分)
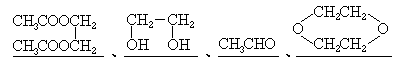
(每空2分,共8分)
七、(本题包括2小题,共18分)
36.(8分)
解:2Na2O2+2H2O=4NaOH+O2↑ (1分)
Na2O+H2O=2NaOH (1分)
[解法一]设混和物中含x摩Na2O2和y摩Na2O
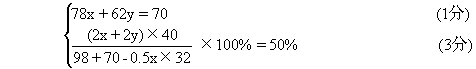
解得:x=0.50 Na2O2质量=0.5×78=39(克) (1分)
y=0.50 Na2O质量=0.5×62=31(克) (1分)
[解法二]设混和物中Na2O2质量为x克,Na2O质量为(70-x)克
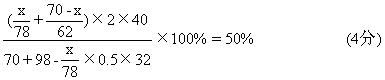
解得:x=39 Na2O2质量为39克 (1分)
70-x=31 Na2O质量为31克 (1分)
[解法三]设混和物中Na2O2质量为x克,Na2O质量为(70-x)克
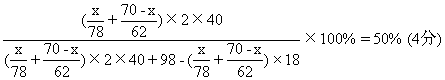
解得:x=39 Na2O2质量为39克 (1分)
70-x=31 Na2O质量为31克 (1分)
37.(10分)解:

(2)∵Ag2SO4固体过量,该溶液仍为Ag2SO4饱和溶液.
∴[Ag+]=0.0536(摩/升) (3分)
[说明]只要答出[Ag+]=0.0536(摩/升),未说明原因,同样给分.
[解题思路]Ag2SO4饱和溶液的浓度与BaCl2溶液的浓度相等,但体积比为4:1,因而参加反应的Ag2SO4的质量仅为原溶液中Ag2SO4质量的1/4.根据原加入的水和Ag2SO4固体的质量以及Ag2SO4的溶解度,可判断,即使BaCl2反应后,尚有多余的Ag2SO4固体.因而最后溶液仍为Ag2SO4饱和溶液,[Ag+]不变.(以上内容不要求考生在卷面上回答.)
(3)设加入的BaCl2溶液的体积为V(升)

V=0.489(升) (1分)