高三第三次月考化学试题
说明:本试卷分为第I卷和第II卷,将第I卷的答案填写在第II卷答题表中。
可能用到的原子量:H:1 C:12 N:14 O:16 S:32 Fe:56 Ag:108
第I卷
一、选择题(每小题有一个或二个正确答案,每小题3分)
1.美国科学家发现C60是一种新的分子,它具有空心的类似足球的结构,被称为“分子足球”。最近日本科学家确认世界上还存在着另一种“分子足球N60”,它与C60的结构相似,并且在高温或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。对于N60,下列说法中正确的是
A.N60是由共价键构成的空心圆球面结构,所以它是一种原子晶体
B.N60和14N都是氮的同位素 C.N60没有同素异形体
D.N60的发现开辟了能源世界新天地,将来会成为最好的火箭燃料
2.下列说法中不正确的是
①质子数相同的微粒一定属于同种元素②同位素的性质几乎完全相同③质子数相同,电子数也相同的微粒,不可能是一种分子和一种离子④电子数相同的微粒不一定是同一种元素⑤一种元素只能有一种质量数⑥某种元素的相对原子质量取整数,就是其质量数
A、①②④⑤ B、①②⑤⑥ C、②③⑤⑥ D、③④⑤⑥
3.下列叙述中正确的是:
A.CO2水溶液的导电性较差,故CO2属于弱电解质 B.BaSO4难溶于水,属于非电解质
C.强电解质比弱电解质的水溶液导电能力强
D.向较浓的醋酸溶液中逐滴加入浓氨水,电导实验显示混合溶液的导电能力开始有一个由弱到强的变化过程
4.为了除去酸性AlCl3溶液的Cu2+,下列实验步骤顺序和试剂都正确的是:
①通入CO2气体②加盐酸③加过量NaOH溶液④加入AlCl3溶液⑤过滤
A. ③⑤①⑤② B.③⑤② C. ③⑤①② D. ③⑤④②
5.下列关于碱金属的某些性质的排序中,正确的是:
A.原子半径:Li<Na<K<Rb<Cs B.密度: Li<Na<K<Rb<Cs
C.熔、沸点: Li<Na<K<Rb<Cs D.还原性: Li>Na>K>Rb>Cs
6.W g下列各组物质在足量的O2中充分燃烧,其燃烧产物立即与过量的固体充分反应,固体增重也为W g,符合此要求的是:①H2②CO③H2、CO混合气④CH3COOH⑤C6H12O6
A. ①② B. ④⑤ C. ①②③ D. ①②③④⑤
7.将3.48gFe3O4完全溶于100mLH2SO4中,然后加入K2Cr2O7溶液25mL,恰好使Fe2+全部氧化为Fe3+,Cr2O7 2-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度为(单位:mol·L-1)
A、0.3 B、0.2 C、0.1 D、0.05
8.含有6.02x1023个氯化氢分子的是: ①22400mlHCl②200ml5mol/L盐酸③0.5molH2与0.5molCl2的混合气体在光照下充分反应④58.5克NaCl和58.5克浓H2SO4共热至600。C充分反应
A.①② B. ③④ C.①③④ D. ①②③④
9.下列各反应的离子方程式不正确的是
A.向100mL0.1mol·L-的NaOH溶液中通入0.224L(标准状况)CO2:OH‑+CO2=HCO3-
B.向饱和偏铝酸钠溶液中通入过量CO2气体:2AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
C.将过氧化钠投入重水中:2Na2O2+2D2O=4Na++O2↑+4OD-
D.氯化亚铁溶液久置于空气中变质:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+
10.一定温度和压强下,a体积XY2气体和b气体化合生成Z气体,若a:b=2:1,则Z为:
A.X3Y B.XY3 C.X2Y4 D.X2Y6
11.已知Al2(SO4)3和AlCl3溶液中Al3+、SO42-、Cl-物质的量浓度都是1mol/L,则Al2(SO4)3和AlCl3的物质的量浓度关系是:
A.c[Al2(SO4)3]﹥c[AlCl3] B. c[Al2(SO4)3]﹤c[AlCl3]
C.相等且等于1/3mol/L D.相等且等于1mol/L
12.关于氯气和SO2性质的叙述正确的是( )
A.在相同条件下,Cl2 比SO2更易溶于水
B.常温下等体积的Cl2和SO2混合气体通入BaCl2溶液时无明显现象
C.Cl2和SO2分别通入H2S溶液中都可变浑浊
D.等体积的Cl2和SO2分别通入石蕊试液中,溶液的紫色立即褪去
13.NA为阿伏加德罗常数,下列叙述正确的是
A.标况下,1L苯完全燃烧后,生成CO2的分子数为6×NA/22.4
B.1molCH3+含有8NA个质子
C.标况下,22.4L以任意比混合的CO2与CO气体中含碳原子数为NA
D.1molNa2O2与水完全反应,反应中转移的电子数为2NA
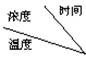
14.右图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4·10H2O)在温度为T3时开始分解为
无水硫酸钠。现有142克T2时的饱和硫酸钠溶液,当温度降为T1或升为T4时析出晶体的质量相等。则温度为T4时Na2SO4的溶解度为:
A.32.8g B.40g C.40.8g D.41g
15.在一密闭容器中,盛aL Cl2和H2的混合气体,用电火花引燃,恢复原来的状态,发现混合气体仍为aL,用足量的NaOH吸收引燃后的气体,结果气体被完全吸收,由上可知原混合气体中Cl2和H2的体积比一定( )
A.=1:1 B.≥1:1 C.≤1:1 D.为任意比
16.
化学试题
第I卷答题表:(共42分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 |
第II卷:(共58分)
15、(2分)3BrF3+5H2O=HBrO3+Br2+9HF+O2↑中,若有6molH2O发生氧化还原反应,则BrF3被水还原的物质的量为 mol。
16、(9分)(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式: ;在以上中性溶液中,继续滴加Ba(OH)2溶液,写出此步反应的离子方程式: 。
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,写出反应的离子方程式: ;在以上溶液中,继续滴加NaHSO4溶液,写出此反应的离子方程式: 。
(3)向Ba(OH)2溶液中,逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀,其反应的离子方程式为: ;在上述溶液中,继续滴加明矾溶液,请写出此反应的离子方程式: 。
17、(6分)A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2,其水溶液呈弱酸性。请回答:
(1)元素符号:A B C D
(2)写出化学方程式:C2和X(过量)反应:
(3)B4A3D2的化学式为: ,其水溶液呈酸性的离子方程式
是:
(4)液态X能电离(可根据B2A电离推知),其阴离子的电子式为: 。
18、某无色溶液,其中可能存在Na+,Ag+,Ba2+,Al3+,AlO2-,S2-,CO32-,SO32-,SO42-;取该溶液进行有关实验,实验结果如下图所示:
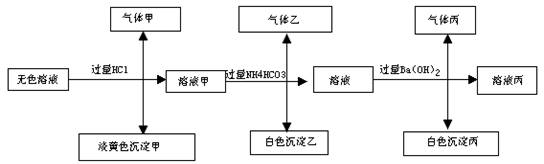
请回答下列问题:
(1)、生成沉淀甲的离子方程式:
(2)、由溶液甲生成沉淀乙的离子方程式:
(3)、沉淀丙可能是: ,如何鉴别其化学成份
(4)、综上信息,该溶液中肯定存在的离子有: 。
19、(6分)在一定温度下,可逆反应2A===B+D达到化学平衡时,反应物与产物的平
|
|
有关,与浓度,压强,催化剂等条件无关。该反应在四种不同条件下进行,B、D的起始浓度为零。反应物的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 |
| 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800OC | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800OC | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800OC | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820OC | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上表完成下列填充:
(1)在实验1,反应在10至20分钟时间内平均反应速率为 mol/(L·min).
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1 (填“>”,“<”,“=”),且C3的浓度为
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热,或放热”),理由是 。
三、实验题:
20、(7分)实验室配制500mL 0.2mol/L 的FeSO4溶液,实验操作有如下步骤:
①在天平上称出27.8g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解.
②把制得的溶液小心地注入500mL 容量瓶中。③继续向容量瓶中加蒸馏水至液面距刻度2—3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞塞紧,充分摇匀。请填写下列空白:
(1)操作步骤和正确顺序(填序号) 。
(2)本实验用到的基本仪器有: 。
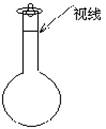
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响? (填“偏高,偏低,或不变”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 ,加蒸馏水时不慎超过了刻度,会
(5)若实验过程中出现如下情况应如何外理?加蒸馏水时不慎超过了刻度,应
,向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应 。
21、(8分)已知水是由H、O元素组成的,用H2还原CuO的实验可证明水中H、O两元素的质量比。具体方法是从CuO的失氧和无水CaCl2吸收水分后的增重计算得出结论。可供选用的仪器如下:
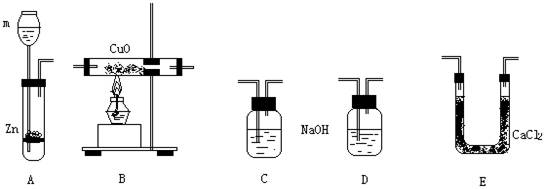
(1)m中盛放的试剂是 。装置D中盛放的试剂是 。C、D的作用分别是: 。
(2)为了准确测出水中H、O两元素质量比,实验装置的连接顺序是:
(3)若用a表示反应前B+CuO质量,b表示反应后B+CuO质量,c表示反应前E+CaCl2质量,d表示反应后E+CaCl2质量,则用数学表达式表示H2O中H、O两元素的质量比为: 。
(4)若通入的H2过量而CuO不足,对此实验结果的影响是 (H、O元素质量比值偏大,偏小,无影响)。
四、计算题:(9分)
22、硫酸银溶解度较小,25oC时,每100g水仅溶解0.836g硫酸银。
(1) 25oC时,在烧杯中放入6.24g硫酸银固体,加入200g水,经充分溶解后,所得饱和溶液的体积为200mL。计算溶液中Ag+的物质的量浓度是多少?
(2) 若在上述烧杯中加入50mL 0.0268 mol/L BaCl2溶液,充分搅拌,溶液中Ag+的物质的量浓度是多少?
(3)在(1)题烧杯中需加入多少升0.0268 mol/L BaCl2溶液,才能使原溶液中Ag+浓度降低至0.0200 mol/L?