普通高等学校招生全国统一考试化学(模拟)
命题说明 :命题按照化学高考考试说明的要求,注重基础,突出考查学科的能力和素质。把思维过程的考查放在重要位置,密切联系社会生产实际(尤其新科技),考查学生信息迁移、学以致用的应用能力。同时突出化学学科特点,加重了对实验考查,不给考生进入试题设置很大难度,但步步深入时仍有一定难度,各题要有较好的区分度。
第Ⅰ卷(选择题 共72分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、下列说法正确的是
A.在化学反应中某元素由化合态变为游离态,该元素一定被还原了
B.失电子难的原子获得电子的能力一定强
C.电子层结构相同的各种离子,它的半径随核电荷数的增加而减小
D.最外层电子数较少的金属元素,一定比最外层电子数较它多的金属元素活泼性强
2、下列溶液,一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液 C.pH=14-pOH 的溶液 D.pH=pOH 的溶液
3、某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是
A.NO B.O3 C.CO D.氯氟烃
4、以石墨作电极,电解氯化铜溶液,若电解时转移的电子数是3.01×1023,则此时在阴极析出铜的质量是
A.8g B.16g C.32g D.64g
5、为了除去苯中混有的少量苯酚,下列的实验正确的是
A.在分液漏斗中,加入足量1mol·L-1NaOH溶液,充分振荡后,分液分离
B.在分液漏斗中,加入足量1mol·L-1FeCl3,充分振荡后,分液分离
C.在烧杯中,加入足量浓溴水,充分搅拌后,过滤分离
D.在烧杯中,加入足量冷水,充分搅拌后,过滤分离
6、自来水生产时,用适量的氯气来杀菌消毒。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水出售。为辨别真伪,可用下列一种化学试剂来鉴别,该试剂是
A.酚酞试液 B.氯化钡试液 C.氢氧化钠试液 D.硝酸银试液
7、膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之。它的分子是三角锥形。以下关于PH3的叙述正确的是
A PH3是非极性分子 B PH3分子中有未成键的电子对
C PH3是一个强氧化剂 D PH3分子中的P-H键是非极性键
8、合成氨中,把1体积N2和3体积H2混和进入合成塔进行反应.若塔里排出的混和气体里NH3占12%,则N2占
A.12% B.22% C.33.3% D.66.7%
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9、下列有机物中既能发生加成反应、又有发生取代、氧化、酯化、消去反应的是

10、设下列每组三种溶液均含有等物质的量的溶质,现将各组溶液充分混和,不会产生沉淀的是
A.AgNO3 稀HNO3
NaBr
B.AlCl3 NaOH Ba(OH)2
C.NaAlO2 Ba(OH)2 HCl
D.CaCl2 NaHCO3
NaOH
11、烯烃、一氧化碳和氢气在催化剂的作用下生成醛的反应,称为羰基合成,也叫烯烃的醛化反应.由乙烯制丙醛的反应为:
CH2=CH2
+CO+H2![]() CH3CH2CHO
CH3CH2CHO
由分子式为C4H8 的烯烃进行醛化反应,得到醛的同分异构体可能有
A.2种 B.3种 C.4种 D.5种
12、根据下列指定实验现象所作的结论一定正确的是
A.无色试液![]() 出现银镜 结论:试液中含有醛类物质
出现银镜 结论:试液中含有醛类物质
B.无色试液![]() 试液变红 结论:试液显碱性
试液变红 结论:试液显碱性
C.无色试液![]() 产生白色沉淀 结论:试液中含Ca(OH)2
产生白色沉淀 结论:试液中含Ca(OH)2
D.无色试液![]() 焰色为黄色 结论:试液是钠盐溶液
焰色为黄色 结论:试液是钠盐溶液
13、溴水中存在着如下的平衡:
![]()
若要使溴水的颜色变浅,可采取的措施是
A.加压 B.加入NaF晶体 C.通入HF气体 D.通入SO2气体
14、下列事实能用同一原理解释的是
A.二氧化氮和溴蒸气分别遇湿润的淀粉碘化钾试纸变蓝
B.二氧化硫、氯气都会使品红溶液褪色
C.萘片、碘片、氯化铵晶体分别置于大试管内加热,试管底部物质会逐渐消失
D.福尔马林、葡萄糖溶液与新制氢氧化铜悬浊液共热,都会有砖红色沉淀产生
15、向含有0.5摩硫酸铁、0.5摩硫酸铜的混和溶液中加入下列何种物质,可使溶液中[Fe2+]=[Cu2+](不考虑水解)
A.14克铁粉 B.32克铜粉 C.125克胆矾 D.0.5摩硫酸亚铁
16、60毫升由CO2和NO组成的混和气体,通入足量的Na2O2,余气通入足量水,此时无气体剩余,则原混和气体中CO2和NO的体积分别是
A.各30毫升 B.CO240毫升,NO20毫升
C.CO224毫升,NO36毫升 D.CO236毫升,NO24毫升
17.草酸(H2C2O4)溶液与酸性KMnO4溶液反应,在两溶液混和时看不到明显现象,但过一段时间后,混和溶液突然迅速褪色,此反应的化学方程式为:2KMnO4+3H2SO4+5H2C2O4 =K2SO4+2MnSO4+10CO2+8H2O,据你的分析,突然褪色的原因可能是
A.溶液已混和均匀了 B.反应中溶液酸性减弱
C.生成微量的Mn2+起催化作用
D.增大了外界的压强
18、由IIIA族元 素A和VI族元素B组成的阴离子结构如下图,所带电荷数x、y、z依次为
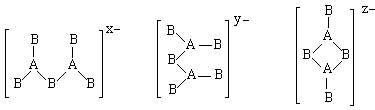
A.2 3 4 B.2 3 2 C.5 6 4 D.4 3 2
第II卷(非选择题,共78分)
三、(本题包括2小题)
19、在四只编了号但无品名标签的试剂瓶中,分别盛有盐酸、氯化钡溶液、磷酸钠溶液和硫酸钠溶液,此外,唯一的试剂是硝酸银溶液,进行如下三个实验:
(a)向溶液I中加入溶液II,再在所得的混和溶液中加入溶液III,没有出现任何变化
(b)将溶液I加入溶液III中,没有出现任何变化
(c)将溶液IV与硝酸银溶液混和,也未发现任何变化
试回答:
(1)盐酸是
,硫酸钠是
(2)先将II与II混和,再加入I ,叙述现象
写出有关的离子方程式:
20、在如图所示的三个容积相同的三个容器①、②、③进行如下的反应: ![]()
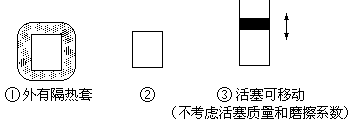
(1)若起始温度相同,分别向三个容器中充入3摩A和1摩B,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号)
(2)若维持温度不变,起始时②中投入3摩A、1摩B; ③中投入3摩A、1摩B和2摩C,则达到平衡时,两容器中B的转化率② ③(填<、>或=)
(3)若维持②③容器内温度和压强相等,起始时在②中投入3摩A和1摩B,在③中投入a摩A和b摩B及c摩C,欲使达平衡时两容器内C的百分含量相等,则两容器中起始投料量必须满足(用含a、b、c的关系式表达):
四、(本题包括2小题)
21、某有机物的式量是58,根据下列条件,回答下列问题:
(1)若该有机物只有碳、氢两种元素组成,则可能的结构简式是:
(2)若为含氧衍生物,且分子中有-CH3,则可能的结构简式为:
(3)若分子中无-CH3,又无-OH,但能发生银镜反应,则结构简式为
(4)分子中有-OH,无碳碳双键,也无碳碳叁键,则它的名称是:
22、下面是三种有机物的结构式和名称(数字为碳原子编号):
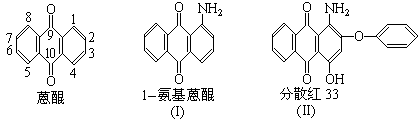
用化合物(I)为起始原料,经过3步主要反应可以得到化合物(II):
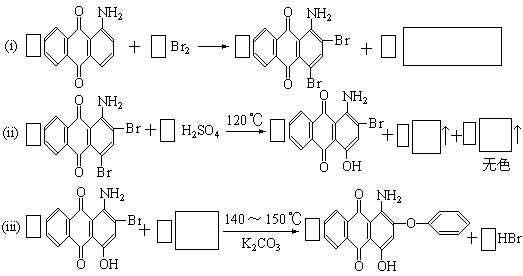
(1) 请在以上三个化学方程式的方框内分别填入有关的化学式和化学式的化学计量数(即“系数”)
(2)从第(ii)步反应的化学原理图看,它既发生了取代反应又发生了氧化-还原反应,其中氧化剂是 ,配平后的化学方程式中共转移了 摩电子
(3)请将反应式(iii)箭头下面的K2CO3改写在化学方程式的左端,重新另写出它的化学方程式,并配平之。
五、(本题包括2小题)
23、A、B、C、D、E、F、G七种常见物质,它们满足下图的转化关系:
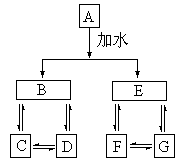
①A、B、C、D、E、F、G都不是氧化物
②D、G是钠盐
③A、B、C、D含同一种元素
④A、E、F、G含同一种元素,且F为单质,E在常温下为气体
请回答:
(1)写出A、F的化学式:A
、F
(2)写出下列反应的离子方程式:
①D®C
②C+D®B
24、溶液A可能含有等物质量浓度的Cl-、AlO2-、S2-、SiO32-、SO32-、CO32-、SO42-、PO43-离子中的几种。现进行以下实验:
(1)取5 毫升A溶液,往其中通入足量的二氧化碳,得到白色沉淀B,B可完全溶于盐酸
(2)另取5毫升A溶液,往其中加入盐酸,生成气体C,将C通入硫酸铜溶液中,有黑色沉淀D产生
根据上述实验,回答以下问题:
①溶液A中肯定存在 离子
②溶液A中肯定不存在 离子,其理由是
六、(本题包括2小题,共20分)
25、某工厂排出的废水,经测定含有0.012摩/升的游离溴和0.002摩/升的H+。现采用亚硫酸钠除去其中的溴,有关反应的化学方程式是:
Na2SO3+Br2+H2O
== Na2SO4+2HBr。现要处理这种废水5升,问需要加入0.05摩/升的亚硫酸钠多少升才能将Br2全部除去?经亚硫酸钠处理后的废水中H+的物质的量浓度是多少?
26、难溶化合物的饱和溶液存在着溶解平衡,例如:
![]()
离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.01摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答下列问题:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少?
CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5摩/升时,则认为可以达到有效分离)
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.C 2.D 3.B 4.B 5.A 6.D 7.B 8.B
二、(本题包括10小题)
9.C 10.C 11.C 12.B 13.BD 14.AD 15.BD 16.D 17.C 18.D
三、(本题包括2小题)
19、I号 IV 先出现白色沉淀,后沉淀溶解
3Ba2++2PO43- == Ba3(PO4)2¯ Ba3(PO4)2+4H+ == 3Ba2++2H2PO4-
20、③②①
< ![]() =3
=3
21、CH3CH2CH2CH3和(CH3)2CHCH3 CH3CH2CHO和(CH3)2CO
OHCCHO 环丙醇
22、
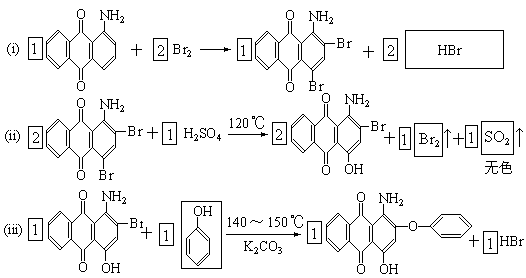
H2SO4 2
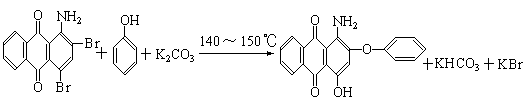
23、 A是Al2S3
24、 AlO2- S2- SO32- SiO32-
25、 先求得5升废水中含有的H+的量为0.01摩、Br2的量为0.06摩,根据题中给出的反应式找出如下的反应关系式:
Br2 ~ Na2SO3 ~ 2H+
1摩 1摩 2摩
0.06摩 0.06摩
0.12摩
0.05V=0.06,解得:V=1.2升(亚硫酸钠溶液的体积)
反应后的溶液体积=1.2+5=6.2升
反应后溶液中H+的总量=0.12+0.01=0.13摩
反应后溶液中的[H+]=![]() =0.021摩/升
=0.021摩/升
26 AgCl饱和所需Ag+浓度[Ag+]1=![]() =1.8×10-7摩/升
=1.8×10-7摩/升
Ag2CrO4饱和所需Ag+浓度[Ag+]2=![]() =4.36×10-5摩/升
=4.36×10-5摩/升
[Ag+]1<[Ag+]2,Cl-先沉淀。
Ag2CrO4开始沉淀时[Cl-]=![]() =4.13×10-6<10-5,所以能有效地分离。
=4.13×10-6<10-5,所以能有效地分离。