《化学平衡》单元测试题
本试卷共五道大题,满分 110 分,时量 60 分钟。
可能用到的相对原子质量: H 1 O 16 S 32 N 14
一、选择题(每小题只有一个正确答案,每小题6分,共48分)。
1、在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)(mol·L-1·s-1)表示且v(A)、v(B)、v(C)之间有以下关系:v(B)=3v(A),3v(C)=2v(B)。则此反应可表示为 ( )
A.2A+3B![]() 2CB.A+3B
2CB.A+3B![]() 2C
2C
C.3A+B![]() 2CD.A+B
2CD.A+B![]() C
C
[解析]
反应速率快慢的比较,需要将所给的量化成同一单位比较。若用不同物质表示的反应速率,则可用它们的化学计量数进行转化比较。如:对于反应:mA+nB![]() pC+qD,VA∶VB∶VC∶VD=m∶n∶p∶q。
pC+qD,VA∶VB∶VC∶VD=m∶n∶p∶q。
[答案] B
2、在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达平衡的是 ( )
C(g)+D(g)已达平衡的是 ( )
A.混合气体的压强 B.混合气体的密度
C.C、D的物质的量的比值 D.气体的总物质的量
[解析]
题给反应是一个反应前后气体体积不变的反应,故不管平衡是否移动,混合气体的压强与气体的总物质的量均不变;而平衡生成C、D的物质的量相等,故比值不变。
[答案] B
3、有一处于平衡状态的反应:X(s)+3Y(g)![]() 2Z(g),ΔH<0。为了使平衡向生成Z
的方向移动,应选择的条件是
2Z(g),ΔH<0。为了使平衡向生成Z
的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z
A.①③⑤ B.②③⑤C.②③⑥ D.②④⑥
[解析]
正反应是一个气体体积缩小的放热反应,对于这样一个可逆反应,用化学平衡的原理及有关知识容易得出使平衡向生成Z 的方向移动,应选择的条件是:低温、高压、分离出Z。
[答案] C
4、在密闭容器中进行如下反应:N2+3H2![]() 2NH3+Q,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
( )
2NH3+Q,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
( )
(1)平衡不发生移动 (2)平衡沿着正反应方向移动
(3)平衡沿着逆反应方向移动 (4)NH3的质量分数增加
(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
[解析]
将平衡体系中各物质的浓度都增加到原来的2倍,相当于增大压强1倍。
 [答案] D
[答案] D
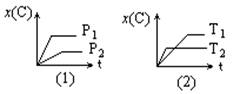
5、右图表示可逆反应mA(g) + nB(g) ![]() pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
( )
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
( )
A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
[解析]
分析图(1),P1比P2先达平衡,说明P1>P2,压强增大,生成物C的物质的量分数增大,说明正反应是气体体积缩小的反应;再分析图(2),T2比T1先达平衡,说明T2> T1,温度降低,生成物C的物质的量分数增大,说明正反应是放热反应。
[答案] D
![]() 6、在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为( )
6、在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为( )
A.2:1 B.1:1 C.2:3 D.3:2
[解析]
若反应物的初始量为化学计量数比,则两反应物的转化率相同。若某一反应物的转化率降低,则意味着另一反应物的量将减少。若某一反应物的量减少n分之一,则另一反应物的转化率将减少n分之一。现已知X与Y的初始量为1∶2时,则两者的转化率皆为50%,其二分之一为25%,故应为1∶1。
[答案] B
7、工业制取硫酸是一种连续生产过程。今测知进入接触室时混合的气体(396K、8KPa主要成分为SO2、O2、N2)的流量为1.0m3·s-1,从接触室导出气体(792K、8KPa )的流量为1.8m3·s-1。与此有关的下列说法中正确的是 ( )
A.单位时间内进入接触室的气体与从接触室导出的气体的物质的量之比为10∶9
B.导出气体中SO3所占的体积分数为9/2
C.此反应中SO2的转化率一定为20%
D.SO2催化氧化反应是吸热反应
[解析]
时间取1s,反应前体积为1.0m3,反应后气体在396K时体积为0.9m3
2SO2 (g)+O2(g) ![]() 2SO3(g) ∆V
2SO3(g) ∆V
2 2 1
0.2 0.2 1-0.9
[答案] A
8、在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1
mol H2和2 mol
Br2达到平衡后,生成了a
mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x
mol、y mol、z
mol(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是
(
)
2HBr(g),已知加入1
mol H2和2 mol
Br2达到平衡后,生成了a
mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x
mol、y mol、z
mol(均不为0)且保持平衡时,各组分含量都不变。以下推断中一定正确的是
(
)
①x,y,z应满足的关系为:4x+z=2y
②达到平衡时HBr的物质的量为![]() a mol
a mol
③达到平衡时HBr的物质的量为a mol
④x、y、z应满足的关系为x+y=z
A.①② B.②③ C.③④ D.①②③
[解析]
题目要求:平衡时各组分含量都不变。应是等效平衡。本题的特点:反应前后气体的物质的量不变,如对体系加压(或减压),或者按比例加大(或减小)各反应物物质的量,平衡不会发生移动,各物质的质量分数保持不变(浓度要发生改变),即本题中加入各物质如果完全转化为Br2和H2,只要满足Br2和H2的物质的量比为2∶1就与原平衡相同。
[答案] A
二、填空题(本题共4道小题,共47分)
9(11分)在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) 浓度(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.20 | C1 | 0.10 | C3 | A | B |
| c(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:
(1)该反应的化学方程式为 ;达到平衡时四氧化二氮的转化率为 %,表中C2 C3 A (填“<”、“>”=
(2)20s时,四氧化二氮的浓度C1= mol·L-1,在s~20s内四氧化二氮的平均反应速率为 。
(3)若在相同情况下是初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
[答案](1)N2O4![]() 2NO2
(1分) 55% (2分) >(1分) =(1分)
2NO2
(1分) 55% (2分) >(1分) =(1分)
(2)0.14(2分) 3.00×10-3 mol·(L·s)-1(2分)(不写单位不给分)
(3)0.40(2分)
10 (9分) 常温、常压下,A、B、C、D均为气态。A与B可发生可逆反应:A+B![]() C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下:
C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下:
| 温度 T/ ℃ | 压强 p/ Pa | C平衡浓度 c/(mol·L-1) |
| 25 | 1×105 | 1.0 |
| 25 | 2×105 | 1.8 |
| 25 | 4×105 | 3.2 |
| 25 | 5×105 | 6.0 |
(1) 可逆反应中,化学计量数n的取值范围为 ,理由是
。
(2) 在5×105 Pa时,D的状态为 。
[答案] (1) n>1(3分);压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强平衡向左移动,该反应是气体体积增大的反应,故n>1(3分) (2) 液态或固态(3分)
11(12分)对可逆反应aA(g)+bB(g)![]() cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:![]() =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)+Q。在850℃时,K=1。
CO2(g)+H2(g)+Q。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
[解析]
(1)从题给信息知:正反应是放热反应,升温,平衡向逆反应方向移动,CO2和H2的浓度将减少,而CO和H2O(g) 的浓度将增大,故K值减少;
(2)将1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2代入式中,得x=3.0mol<5.0mol,平衡向逆反应方向移动。若要使上述反应开始时向正反应方向进行,则x应满足的条件是:x<3.0mol。
(3)其他物质的投料不变,增加H2的量,平衡向逆反应方向移动,但H2的转化率将减少。
[答案] (1)小于(3分) (2)①逆反应(3分) ②x<3.0(3分)(3)小于(3分)
12(15分)在一定温度下,把4体积SO2和2体积O2通入一个有活塞的体积可变的容器中,活塞一端与大气相通(如图所示)。容器内发生下列反应:2SO2 (g)+O2(g) ![]() 2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。
2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。
![]()
(1) 保持上述温度不变,设a、b、c分别代表初始加入的SO2、O2和SO3气体的体积,如果反应过程达到平衡时,混合气体中各物质的含量仍与上述平衡相同,那么:
① 若a=1.5,c=2.5,则b= 。在此情况下,反应起始时正反应速率将 (填“大于”、“小于”或“等于”)逆反应速率。
② 若欲使起始时逆反应速率大于正反应速率,则c的取值范围为 。
(2) 在反应容器中,若起始时a、b、c值均与(1)相同,但需控制平衡时混合气体为4.5 体积,则可采取的措施是 ,原理是
。
[解析]
(1)①反应物间为系数比关系,故b=0.75。此时总物质的量为1.5+0.75+2.5=4.75<5,要使之达到5,则逆反应速率应大于正反应速率,应填:小于。
② 由 2SO2 (g)+O2(g) ![]() 2SO3(g)
2SO3(g)
![]()
|
1.5 0.75 1.5 故可得c的最大值为4。
欲使起始时逆反应速率大于正反应速率,设c的最小值为w
2SO2 (g) + O2(g) ![]() 2SO3(g)
2SO3(g)
起始 1.5 0.75 w
变化 2x x 2x
平衡 1.5+2x 0.75+x w-2x
平衡时混合气体总体积:1.5+2x+0.75+x+w-2x=2.25+x+w
![]()
![]() 2.25+x+w=5 x=2.75-w
2.25+x+w=5 x=2.75-w
w-2x>0
x<![]()
代x<![]() 于另一式中,可得3w>5.5,w>1.833,故可得:1.833<c≤4。
于另一式中,可得3w>5.5,w>1.833,故可得:1.833<c≤4。
(2) 降低容器内温度;降低温度使平衡向放热反应方向移动,从而使气体体积减小。
[答案] (1)①b=0.75(2分)小于(3分) ②1.833<c≤4 (5分)
(2) 降低容器内温度(2分);降低温度使平衡向放热反应方向移动,从而使气体体积减小(3分)。
三、计算题(15分)
13(15分)现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在
400℃时废气以5m3·h-1的速率通过五氧化二钒催化剂层与20L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。
利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是 ,简述不采用2∶1的理由是 。
(2)通过计算,说明为什么废气以5m3·h-1的速率与20 L·h-1速率的氨气混合?
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵多少吨?消耗氨气多少吨?
[答案] (1)1∶50 根据勒夏特列原理,通入过量而廉价的氧气,可提高SO2的转化率
(2)废气中每小时排出的SO2的体积为:1000L·m-3×5m3×0.2%=10L,每小时氨与废气中SO2混合的体积比为2∶1,恰好可全部转化为(NH4)2SO4。
(3)SO2 ~ 2NH3 ~ (NH4)2SO4
![]() mol
mol
![]() mol
mol
![]() mol
mol
故可得(NH4)2SO4:![]() mol×132 g·mol-1×10-6t·g-1=3.54 t
mol×132 g·mol-1×10-6t·g-1=3.54 t
消耗氨气:![]() mol×2×17
g·mol-1×10-6
t·g-1=0.91
t
mol×2×17
g·mol-1×10-6
t·g-1=0.91
t