高 三 化 学(第19周)
【《卤素》综合练习】
一、选择题(每小题有1~2个正确答案)
1、下列微粒氧化性由强到弱的顺序是( )
A、Ca、Sr、Ba B、Ag+、Cu2+、Zn2+
C、Cl2、Br2、I2 D、HClO4、HClO3、HClO
2、将0.01mol Cl2通入含0.03mol Br-和0.03mol I-的混合液中,再加CCl4振荡,则CCl4层的颜色是( )
A、紫色 B、橙红色 C、棕色 D、紫黑色
3、在体积为VL的干燥烧瓶中,用排空气法充入HCl气体后,测得瓶中气体对O2的相对密度为1.082,此气体进行喷泉实验,喷泉停止后,进入烧瓶的体积是( )
A、0.25VL B、0.5VL C、0.75VL D、VL
4、下列各组物质能用淀粉碘化钾试液鉴别的是( )
A、NO2和Br2(g) B、盐酸和稀H2SO4
C、Cl2和H2S D、AgNO3溶液和NaBr溶液
5、下列物质中一定含有离子的是( )
A、晶体氯 B、铝粉 C、液态氯化氢 D、次氯酸钙
6、利用盐酸具有氧化性的反应是( )
A、与 NH3反应制NH4Cl B、除去铜粉中的铁粉
C、与MnO2反应制Cl2 D、除去钢铁表面的铁锈
7、浓度为0.5moL·L-1的盐酸VL,欲使其浓度增大一倍,下列采取的方法正确的是( )
A、加入0.125VL 5moL·L-1的盐酸
B、通入标准状况下的HCl气体11.2L
C、溶液加热浓缩至0.5VL
D、加入10moL·L-1的盐酸0.1VL,再将溶液稀释至1.5VL.
8、要除去溴中少量的Cl2,可向溴中加入( )
A、适量KBr B、通入溴蒸气 C、适量KI D、适量AgNO3溶液
9、使体积相同的NaCl、MgCl2、AlCl3溶液中的Cl-完全转变为AgCl,若消耗AgNO3体积相同,则NaCl、MgCl2、AlCl3三种溶液物质的量浓度之比( )
A、6:3:2 B、3:2:1 C、1:2:3 D、1:1:1
10、某溶液中的Cl-、Br-、I-的物质的量之比为2:3:4,要使溶液中Cl-、Br-、I-物质的量之比为4:3:2则通入Cl2的物质的量是原溶液中I-的量的( )
![]() A、
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
11、a、b、c、d、e是含有一种相同元素的5种物质,可发生如下转化:其中a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物。则a不可能是( )
A、Cl2 B、N2 C、S D、C
12、下列物质最易被氧化的是( )
A、NaBr B、S C、I2 D、Na2S
13、下列说法正确的是( )
A、阳离子只有氧化性,阴离子只有还原性
B、阴极发生还原反应,正极亦发生还原反应
C、Cl2与碱溶液的反应,实质是Cl2与水的反应
D、从氯水中分离出HClO,可加入CaCO3蒸馏
14、实验室制备下列各组气体,所用气体发生装置可能相同的是( )
A、H2、HCl、CO2 B、Cl2、HCl、CO
C、NH3、CH4、C2H2 D、SO2、C2H4、Cl2
15、下列关于HCl性质的叙述正确的是( )
A、氯化氢能使湿润的蓝色石蕊试纸变为红色是因为HCl分子中含有H+
B、氯化氢易溶液于苯、CCl4等非极性溶剂
C、氯化氢通入氨气的苯溶液中有白色沉淀生成
D、氯化氢极易溶于水,常温常压1体积水可溶解700体积HCl
16、G、Q、X、Y、Z均为氯的含氧化合物,现不了解其化学式,只知其一定条件下具有如下的转换关系(未配平):(1)![]() (2)
(2)![]() 电解
电解![]()
(3)![]() (4)
(4)![]()
这五种化合物氯的化合价由低到高的顺序是( )
A、Q、G、Z、Y、X B、G、Y、Q、Z、X
C、G、Y、Z、Q、X D、Z、X、G、Y、Q
17、将Cl2制成漂白粉的主要目的是( )
A、增强漂白和消毒作用 B、使它转化为较易溶于水的物质
C、使它转化为较稳定的物质,便于保存和运输
D、增加氯的百分含量,有利于漂白、消毒
18、因发生化学反应而使溴水褪色的( )
![]() ①SO2 ②NaOH ③苯 ④ ⑤Na2SO3
①SO2 ②NaOH ③苯 ④ ⑤Na2SO3
A、除②③ B、全部 C、除③ D、除①③⑤
19、某学生用自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
A、AgNO3 B、Na2SO3 C、FeCl2 D、AlCl3
20、Cl2通入石灰乳得漂白粉,其主成分为![]() ,现有一种漂白粉的有效氯(过量盐酸和漂白粉作用生成的Cl2的质量和漂白粉的质量之比)为35%。若漂白粉的组成与上述化学式相等,则式中n值为( )
,现有一种漂白粉的有效氯(过量盐酸和漂白粉作用生成的Cl2的质量和漂白粉的质量之比)为35%。若漂白粉的组成与上述化学式相等,则式中n值为( )
A、6.5 B、8.5 C、8 D、10
21、能说明M的非金属性比N强的事实是( )
A、M的气态氢化物比N的气态氢化物稳定
B、HxM的酸性比HyN的酸性强
C、单质M的熔沸点比单质N的溶沸点高
D、M能将N从它的盐溶液中置换出来
22、在50g含有1.70gAgNO3和1.85g硝酸钯[Pd(NO3)2]的溶液中,加入足量的NaI溶液,充分反应后得沉淀5.245g,由此得出的正确结论是( )
A、Ag+只有一部分参加反应 B、Pd2+只有一部分沉淀
C、PdI2难溶于水 D、NaI和Pd(NO3)2混合无沉淀生成
23、将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为:
A、3:2:1 B、1:2:3 C、1:3:2 D、3:1:1
24、在一种PH=1的溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液( )
A、含NO3-、Fe3+,无I-,可能有Cl- B、含I-,不含NO3-、Fe3+,可能有Cl-
C、含I-、Fe3+、Cl-,肯定不含NO3- D、含I-、NO3-,肯定不含Fe3+
25、氟气是氧化性最强的非金属单质,加热条件下,等物质的量的氟气和烧碱完全反应,生成NaF,H2O和另一种气体。该气体可能是( )
A、H2 B、HF C、O2 D、OF2
二、填空
1、今有Cl2、Fe、盐酸、Fe(NO3)2溶液,漂白粉固体作反应物,发生氧化—还原反应。请按下列要求写出反应的离子方程式
(1)一种单质氧化一种阳离子 _________________________
(2)一种单质还原一种阳离子 _________________________
(3)一种阴离子氧化一种阳离子 _______________________
(4)一种阴离子氧化一种阴离子 _________________________________
2、有两种无机盐A和B,式量都为120,为了确定A和B,将它们溶于水制成溶液,并进行如下实验:(1)将两种溶液混合并加热,有刺激性气味气体产生;(2)在两种溶液中分别加入BaCl2溶液,A无沉淀生成,B有白色沉淀析出;(3)两种溶液分别加入Ba(OH)2溶液,均有白色沉淀析出,则A是 ____ B是 ____,实验(1)的离子方程式 _____________实验(3)的离子方程式是 ______________________________________
3、今有两种无机钠盐,其水溶液的PH值均大于7,久置后这两种溶液的PH值均接近7,它们分别是 _______和 _________.
4、某钾盐晶体A,加入无色油状液体B,加热产生红棕色蒸气C,将C溶于水,得到橙色的C溶液。将C溶液分成两等份:一份加入一种D溶液,另一份通入具有漂白性气体E,两份溶液均变为无色透明溶液。D的晶体遇到B时,又有E生成,E通入苛性钠溶液可得到D。试写出各物质的化学式:
A _____ B _____ C _____ D _____ E ______
5、(1)配平![]() ——
——![]()
(2)已知有3.21gFe(OH)3参加反应,其转移了![]() 个电子,则n= _______
个电子,则n= _______
![]() 中铁的化合价为 ________
中铁的化合价为 ________
(3)根据(1)、(2)推则![]() 能和下列哪些物质反应 _________
能和下列哪些物质反应 _________
A、Cl2 B、SO2 C、H2S D、O2
6、在KBr和KI的混合液中通入过量的Cl2,除了水分子外,溶液中主要有 ______分子,若把溶液蒸干得到固体主要含有 _______,固体灼烧后还剩下 ____________。
7、海水中溴常以NaBr形式存在,经分析海水中含溴0.07%,则海水中含NaBr的质量百分含量为 _________。从海水中提取溴的方法之一是:
(1)通入Cl2至浓缩的溴化物溶液,然后用空气把生成的溴吹出。
(2)用Na2CO3溶液吸收溴(其中有![]() 的溴的物质的量转化为Br-),同时放出CO2。
的溴的物质的量转化为Br-),同时放出CO2。
(3)向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。
(4)得到的溴中可能夹杂少量的Cl2,再加入FeBr2除去
第一步反应的离子方程式 ____________________________________
第二步反应的化学方程式 ______________________________________
第三步反应中氧化剂的化学式是 ___________________
8、合成盐酸中要求合成气中HCl含量大于97%(体积),质检员应怎样分析合成气含量才能最简最快?
____________________________
9、A、B、C、D为四种单质,常温时A、B为固体,C、D为气体,E、F、G、H、I为五种化合物,A与B反应产物E不溶于水,C与D反应产物F为气体且极易溶于水得无色溶液,B与C反应产物为H溶于水得黄色溶液,其反应转化关系如图所示
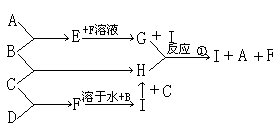 |
(1)根据上述反应及转化关系,判断A、B、C、D四种单质(填化学式)
A _______ B ________ C ________ D ________
(2)反应①的离子方程式 _____________
10、Cl2与Ca(OH)2作用制漂白粉,其有效氯是指漂白粉与盐酸作用能产生的氯占样品质量的百分数。一般漂白粉的有酸氯含量在35%左右,这是因为消石灰在氯化时总不能完全彻底。因此《化学词典》1040页(89年版)写出表示漂白粉成分的化学式是![]() 根据这个化学式得出了:“漂白粉是一种特殊组成的不同于一般混合物的混合物”的结论,但是最近又有人对此提出了异议,建议用
根据这个化学式得出了:“漂白粉是一种特殊组成的不同于一般混合物的混合物”的结论,但是最近又有人对此提出了异议,建议用![]() 表示其组成更确切些。
表示其组成更确切些。
(1)清石灰在氯化时总不能完全彻底的原因是________________________
(2)得出“漂白粉是一种有特殊组成不同于一般混合物”这一结论的理由是__________
__________________________________
(3)认为化学式“Ca(ClO)2·CaCl2·xCa(OH)2·yH2O”更能准确表示漂白粉组成的理由是_______________________________________________
三、完成并配平下列化学方程式
1、KClO3固体和草酸固体加热至60℃能产生ClO2(沸点9.9℃),在所得固体中仍能测出含有C2O42-______________________________
2、海水中存在一种细菌,摄取海水中Fe2+CO2,转化为Fe2O3,并有甲醛生成______________________________________
3、CuSO4溶液遇到黄铁矿就会生成辉铜矿(Cu2S)、FeSO4、H2SO4,在有些矿区常见到的具有强腐蚀性,强酸性的“黑水”
_____________________________________________________________________
4、黄铁矿石与焦炭充分混合(FeS2与C的质量比为5:2)在有限量的空气中缓慢燃烧,结果得到硫黄(副产物是两种氧化物)写出此燃烧的化学方程式。
5、某铜矿石中铜的化合物是Cu2S,只要鼓入足够的空气充分燃烧,Cu2S可以全部转换成Cu2O和SO2。实际冶铜时,操作者控制了温度和空气用量,只将![]() 的Cu2S转换成Cu2O,不另外使用不原剂,在燃烧炉中就得到了粗铜,写出制取粗铜的两步反应化学方程式。
的Cu2S转换成Cu2O,不另外使用不原剂,在燃烧炉中就得到了粗铜,写出制取粗铜的两步反应化学方程式。
四、计算
1、把卤素互化物![]() 为1,3,5,7,且
为1,3,5,7,且![]() 原子量小于X) 5.20g溶于水,再通入过量的SO2,当向生成的溶液中加入过量的Ba(NO3)2溶液时,则生成10.5g沉淀,除去沉淀后,将所得滤液再用过量的AgNO3溶液处理,可生成沉淀15.0g。试推断:
原子量小于X) 5.20g溶于水,再通入过量的SO2,当向生成的溶液中加入过量的Ba(NO3)2溶液时,则生成10.5g沉淀,除去沉淀后,将所得滤液再用过量的AgNO3溶液处理,可生成沉淀15.0g。试推断:
(1)依题意在原化合物中不含有什么卤素?
(2)通过计算回答卤素互化物的组成。
2、3.96gX2YZ4盐溶于水,滴加过量稀H2SO4后,再加入2.24g还原铁粉,恰好完全反应,生成Fe2+。向反应后的溶液中加入适量的KOH溶液至刚好将Fe2+沉淀完全,过滤,将沉淀充分加热后得到红色Fe2O3粉末4.8g。将滤液在一定条件下蒸发可得一种纯净的不含结晶水的含氧酸盐(不是复盐)13.92g。试通过计算确定X2YZ4的化学式。
3、以等物质的量混合的两种价态相同的无水金属卤化物(卤素相同)29.6g溶于水后可以结晶出这两种卤化物的六水合物共51.2g,将这两种水合物的混合物强热灼烧变为相同价态的(即金属价态不变)氧化物的混合物13.1g,若将原混合物溶液中加入过量NaOH溶液后,得到的沉淀滤出洗净,高温灼烧后称量为8.0g。请推出这两种金属卤化物各是什么物质?它们在混合物里各占百分之几?(质量百分比)
【《卤素》综合练习答案】
一、选择题
1、BC 2、A 3、C 4、CD 5、BD 6、B 7、D
8、A 9、A 10、C 11、A 12、D 13、D 14、AB
15、C 16、B 17、C 18、C 19、D 20、B 21、AD
22、C 23、A 24、B 25、D
二、1、(1)![]() (2)
(2)![]()
(3)![]()
(4)![]()
2、![]() 、
、![]()
![]()
![]()
![]()
3、![]() 和
和![]()
4、![]() 、浓
、浓![]() 、
、![]() 、
、![]() 或
或![]() 、
、![]()
5、(1)2、 5-n、 2n、 2、 5-n、 3+n
(2)n=2、 +6价
(3)B、C
6、Cl2、Br2、I2、HClO; KCl、I2; KCl
7、0.09%
![]() ,
,
![]() ,
,![]()
8、喷泉实验
9、S、Fe、Cl2、H2,![]()
10、(1)由于使用的是石灰乳,产生的漂白粉覆盖在消石灰上。
(2)Ca(ClO)2与CaCl2物质的量比一定是1:1,Ca(OH)2与水的含量则无固定组成。
(3)由于漂白粉的生产过程中,氯化程度不同,Ca(OH)2与水的物质的量不一定是1:1。
三、1、![]()
O
![]() 2、
2、![]() H—C—H+8H+
H—C—H+8H+
3、![]()
4、![]()
5、![]()
![]()
四、计算
1、(1)肯定不含氟元素 (2)BrCl或ICl3
2、K2FeO4 3、AlCl3和FeCl3 各占45.1%和54.9%