高三化学总复习试题(7)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共150分,考试时间120分钟。
可能用到的原子量:H 1 C 12 O 16 Na 23 S 32 Mn 55 Cu 64 Ag 108
第I卷(选择题共60分)
一、选择题(本题包括20小题,每小题3分,共60分,每小题只有一个选项符合题意。)
1.下列物质中可用于室内环境消毒的是( )
(A) 氯气 (B)福尔马林 (C)石炭酸 (D)绿矾
2.下列各组晶体中,化学键类型完全相同,晶体类型也完全相同的是( )
(A) SO2、SiO2 (B) NaCl 、HCl (C) CO2、H2O (D) NaOH、KCl
3.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
(A) NO2 (B) PCl 3 (C) CCl 4 (D)CS2
4.下列化学式及结构式中,从成键情况看来不合理的是( )
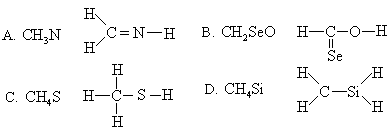
5.下列物质的溶液在空气中放置,开始一段时间内溶液pH值下降的是(不考虑溶液挥发)( )
⑴H2S ⑵浓H2SO4 ⑶Na2SO4 ⑷Ca(OH)2 ⑸氯水 ⑹Na2SO3
(A) ⑴⑵⑷ (B) ⑵⑸⑹ (C) ⑴⑵⑷⑸ (D) ⑵⑷⑸⑹
6.已知下列物质的名称分别是:
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
试综合上述命名规律, 分析思考后回答: K2CS3应命名为
(A)三硫代碳酸钾 (B)多硫碳酸钾 (C)过硫碳酸钾 (D)超硫碳酸钾
7,在理论上不能用于设计原电池的化学反应是( )
(A) HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l);△H<0
(B) 4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3(s);△H<0
|
![]() (D) 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l)
;△H<0
(D) 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l)
;△H<0
8,根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是( )
①HS-;②CO32-;③H2PO4-;④NH3;⑤H2S;⑥CH3COOH⑦OH-;⑧H2O;⑨NO2-
(A) ①⑤ (B) ③⑥ (C) ①②⑨ (D) ①③⑧
9.“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是( AC)
(A) CaOCl2 (B) (NH4)2Fe(SO4)2 (C) KCl·MgCl2·H2O (D)K3[Fe(CN)6]
10.下列反应的离子方程式正确的是( )
(A)
硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3AlO![]() +6H2O=4Al(OH)3↓
+6H2O=4Al(OH)3↓
(B) 将金属钠加入水中 Na+2H2O=Na++2OH-+H2↑
(C) 硫化钠水解 S2-+2H2O=H2S↑+2OH-
(D) 向碳酸氢镁溶液中加入过量烧碱液溶液
Mg2++2HCO![]() +2OH-=MgCO3↓+2H2O+CO
+2OH-=MgCO3↓+2H2O+CO![]()
11.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
(A) 滴加石蕊试液显红色的溶液 Fe3+ 、NH4+ 、Cl- 、SCN-
(B) pH值为1的溶液 Cu2+、Na+ 、Mg2+、NO3-
(C) 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
(D) 所含溶质为Al2(SO4)3的溶液 K+ 、CO32-、NO3-、Al3+
12.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
(A) 由2H和18O所组成的水11g,其中所含的中子数为5NA
(B) 标准状况下,1L庚烷完全燃烧后,所生成气态产物的分子数为7/22.4NA
(C) 46gNO2和46gN2O4中所含原子数均为3 NA
(D) SiO2晶体中,1mol硅原子与2NA个氧原子形成2NA个共价键
13.下列几种情况下,前一量的数值是后一量的数值的三倍的是( )
(A) K3PO4溶液中c(K+)与c(PO43-)
(B) 乙炔分子中C≡C键能与乙烷分子中C—C键能
(C) 银与稀硝酸反应时,参加反应的银的物质的量与被还原的硝酸的物质的量
(D) Al(g)→Al3+(g)所需能量与Na(g)→Na+(g)所需能量
14.物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成型的生物原电池,下列有关判断正确的是( )
(A)正极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
(B)负极的电极反应可能是 O2+ 4e-+ 2H2O→4OH-
(C)细胞膜内溶液pH比细胞膜外pH溶液高
 (D)正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
(D)正极的反应主要是C6H12O6(葡萄糖)生成CO2或HCO3-
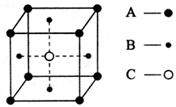
15.某物质的晶体中含有A、B、C三种元素,其排列
方式如图所示(其中前后两面面心中的B元素的
原子未能画出)。晶体中A、B、C的原子个数比
为 ( )
(A) 1∶3∶1 (B) 2∶3∶1
(C) 2∶2∶1 (D) 1∶3∶3
16.根据化学方程式:S(s)+O2(g) SO2(g);△H==-297.23kJ·mol-1,分析下列说法正确的是( )
(A)S(g)+O2(g) SO2(g);△H=-297.23kJ·mol-1
(B)S(g)+O2(g) S(g)+O2(g);△H>-297.23kJ·mol-1
(C)SO2(g) S(g)+O2(g);△H<+297.23kJ·mol-1
(D)SO2(g) S(s)+O2(g);△H>+297.23kJ·mol-1
17.现有两种不含结晶水的盐,它们在20℃和60℃时的溶解度分别是:
|
| 20℃ | 60℃ |
| A的溶解度 | 35.7g | 46.4g |
| B的溶解度 | 31.6g | 110g |
下列说法中,正确的是( )
(A)两种盐在某一温度下具有相同的溶解度
(B)若把110gB的饱和溶液从60℃降到20℃,析出的B是78.4g
(C)在20℃时,A、B都可以配成25%的不饱和溶液
(D)若要使A、B混合物分离,可采用重结晶法
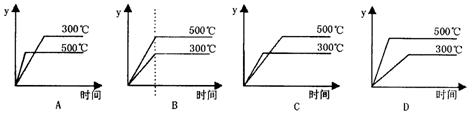
18.![]() 对于热化学方程式:SO3(g) SO2(g)
+
对于热化学方程式:SO3(g) SO2(g)
+![]() O2(g);△H=+98.3kJ/mol的描述有如下四个图象,其中正确的是(y表示SO2的含量)( )
O2(g);△H=+98.3kJ/mol的描述有如下四个图象,其中正确的是(y表示SO2的含量)( )
|
19.将0.1mol/L 的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,则溶液中有关微粒的浓度关系正确的是( )
(A)c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
(B)c(CH3COO-)>c(Cl-) >c(CH3COOH) >c(H+)
(C)c(CH3COO-)=c(Cl-)>c(H+)>c(CH3COOH)
(D)c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-)
20.14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
(A)9.6g (B)6.4g (C)3.2g (D)1.6g
第II卷(非选择题 共90分)
二、填空题(本题包括4小题,共32分)
21.(5分)两种元素的核外电子层数之比与最外层电子数之比相等,则在周期表的前18号元素中,满足上述关系的元素组合有(不一定填满):
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 元素符号 | H、Be |
22.(8分)为研究第VIII族元素的性质递变规律,现取两只试管,在试管①中盛Fe(OH)3,在试管②中盛Co(OH)3,向两支试管中各加入浓盐酸,并在试管口放湿润的KI淀粉试纸,结果发现试管①中沉淀溶解,试管口试纸不变色;试管②中沉淀溶解,且试管口试纸变蓝色。根据上述实验,可推知:Fe3+的氧化性比Co3+的氧化性强弱为____________,有关反应的离子方程式为:
________________________________________________________________,
________________________________________________________________,
________________________________________________________________。
23.(10分)(1)已知白磷是由P4分子形成的分子晶体,每个P4分子是正四面体结构。分子中的四个磷原子位于正 四面体的四个顶点。则P4分子中共有_____个P—P键。
(2)白磷在空气中充分燃烧后生成结构如图所示的分子。图中圆圈表示原子、实线表示化学键。试回答:
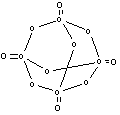 ① 请从图中找出磷原子,并在图上将其涂黑。
① 请从图中找出磷原子,并在图上将其涂黑。
② 形成化合物的化学式为 ________________。
③ 分子内的磷原子排列成______________形。
④ 每个磷原子处于______________中心。
⑤ 在用实线表示的化学键中,两原子间单线表示
的是_________键(填写非极性键或极性键)。
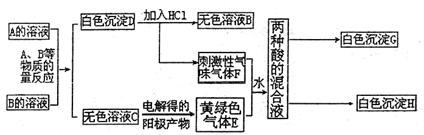
24.(9分)A、B两种盐均为无色晶体,其中A的焰色反应呈紫色(透过蓝色钴玻璃),A的水溶液pH值大于7。下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于硝酸的白色沉淀,气体E、F均可使品红溶液褪色。
|
(1)写出A、B两种物质的化学式A B
(2)写出E、F两物质反应的离子方程式 。
(3)请写出将少量气体E通入过量的FeBr2溶液时发生的离子反应方程式(要求用双线桥法
表示出电子转移的方向和数目)__________________________________________________。
(4)请写出物质C的电子式 。
(5)请写出电解C的无色溶液的化学方程式______________________________________。
三、实验题(本题包括2小题,共22分)
25.(8分)有两瓶失去标签的白色固体,一瓶是Na2SO4,一瓶是NH4Cl。请你设计四种实验方案加以鉴别,简要写出操作过程、实验现象和结论。
| 方案 | 操作过程(简要叙述) | 现象和结论 |
| (1) | ||
| (2) | ||
| (3) | ||
| (4) |
26.(14分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
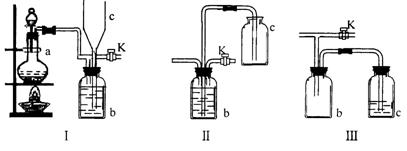
试回答:
(1) 若用[Ⅰ]制取氯气,b瓶中加入的液体一般为___________________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时,如若发现c中液面不明显上
升,你分析可能的原因是________________________,检查的简单方法是____________________________________________________________________________。
(2) 装置[Ⅰ]中b能防止多余气体逸散的原因是:________________________________________________________________________________________________。
(3) 欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”)____理由是________________________________。
[Ⅲ]是否可行(填“是”或“否”)____理由是_________________________________。
四、有机化学题(本题包括3小题,共25分)
27.(5分)(1)下列结构图中,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,(示例:F2 ![]() )
)
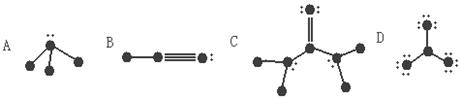
根据各图表示的结构特点,写出该分子的化学式:
A:__________ B:___________ C:___________ D:_____________
(2)在分子的结构式中,由一个原子提供成键电子对而形成的共价键用→表示,例如:
硫酸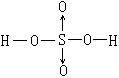 ,硝基甲烷
,硝基甲烷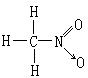 ,写出三硝酸甘油酯的结构式:
,写出三硝酸甘油酯的结构式:
________________________________________。
28.(6分)萝卜中具有较多的胡萝卜素,它是人体的主要营养之一。α—胡萝卜素的结构为:
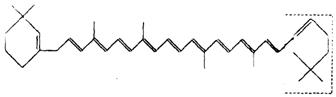
(1)写出α—胡萝卜素的分子式__________________。
(2) l mol胡萝卜素最多能与________mol Br2反应。
(3)β—胡萝卜素与α—胡萝卜素互为同分异构体,且只是虚线框内部分不同,但碳的骨架相同,写出β—胡萝卜素方框内所有可能的结构简式:
___________________________________________________________________。
![]() 29.(6分)玉米蕊在稀硫酸中蒸煮,可以得到木糖CH2OH(CHOH)3CHO,此糖在浓H2SO4作用下转化为糠醛 CH -CH,用此糠醛与苯酚发生缩聚反应,可合成糠醛树脂,写出下述
29.(6分)玉米蕊在稀硫酸中蒸煮,可以得到木糖CH2OH(CHOH)3CHO,此糖在浓H2SO4作用下转化为糠醛 CH -CH,用此糠醛与苯酚发生缩聚反应,可合成糠醛树脂,写出下述
化学方程式:
(1)木糖在浓H2SO4作用下受热生成糠醛的方程式:
__________________________________________________________________________。
(2)木糖与新制Cu(OH)2悬浊液反应的化学方程式:
__________________________________________________________________________。
(3)合成糠醛树脂的化学方程式_________________________________________________。
![]() 30.(8分)已知:①R-Br R-OH(R表示烃基)
30.(8分)已知:①R-Br R-OH(R表示烃基)
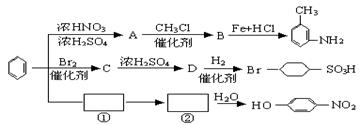 ②苯环上原有的取代基对新导人的取代基进入苯环的位置有显著影响,以下是用苯做原料制备一系列化合物的转化关系图(见图)。
②苯环上原有的取代基对新导人的取代基进入苯环的位置有显著影响,以下是用苯做原料制备一系列化合物的转化关系图(见图)。
(1) 写出A转化B的化学方程式:_______________________________。
![]() (2) 图中 →①→②省略了反应条件,请写出①、②物质的结构简式:
(2) 图中 →①→②省略了反应条件,请写出①、②物质的结构简式:
①______________________;②________________________。
(3) 指出下列转化过程的反应类型。
![]() A B_____________;B E_____________;D G_____________。
A B_____________;B E_____________;D G_____________。
(4)B分子苯环上的任意两个氢原子被溴原子取代后,得到的二溴代物有___种同分异构体。
五、计算题(本题包括2小题,共11分)
31.(5分)滴定度是指每毫升标准液相当于被测物质的质量,通常是用T(m1/m2)表示,如T(H2SO4/NaOH)=0.040g·mL-1表示每毫升标准H2SO4溶液恰好中和0.040gNaOH.
(1)若要使某标准盐酸对氧化钙的滴定度为T(HCl/CaO)= 0.0056g·mL-1,则该盐酸物质的量浓度是多少?
(2)上述盐酸对NaOH的滴定度是多少?
32.(6分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
![]() A(g)+2B(g) 3C(g)
A(g)+2B(g) 3C(g)
已知加入1molA和3molB且达到平衡后,生成了a mol C。
(1)达到平衡时C在反应混合气中的体积分数是 (用含字线a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C_____mol。(不要求写计算过程)
高三化学总复习试题(7)参考答案
一、选择题(共60分)
| 01-05 | C | C | A | D | D |
| 06-10 | A | A | D | A | A |
| 11-15 | B | C | C | A | A |
| 16-20 | A | A | D | B | C |
二、填空题(共32分)
21.(每空1分,共5分)
| He、C | H、Al | He、S | Be、Al | C、S |
![]() 22.(8分)Fe3+的氧化性比Co3+弱
22.(8分)Fe3+的氧化性比Co3+弱
Fe(OH)3+ 3H+==Fe3+ + 3H2O;2 Co(OH)3 +6 H++2Cl-===2 Co3++Cl2 +6 H2O
Cl2 + 2I-== I2 + 2Cl-
23.(10分)(1)6个
(2) ①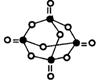
② P4010 ③ 正四面体 ④ 由氧原子排列成的正四面体 ⑤极性
24.(9分)(1)K2SO3 BaCl2 (2) SO2+Cl2+2H2O==4H++SO42-+2Cl-
![]()
![]() (3) Cl2 +2 Fe2+== 2Cl-+2Fe3+ (4)
(3) Cl2 +2 Fe2+== 2Cl-+2Fe3+ (4)
(5) 2KCl+2 H2O ===2KOH+H2 +Cl2
三、实验题(共16分)
25.(8分)(1)用洁净的铂丝蘸取固体样品在火焰上灼烧;火焰呈黄色,原样品为Na2SO4
(2)分别取少量固体放入试管中加热;固体逐渐减少而消失的样品为NH4Cl
(3)分别取少量固体放入试管中加蒸馏水溶解,用pH试纸测试;溶液pH小于7的样品为NH4Cl
(4)分别取少量固体放入试管,加适量水溶解后,滴加BaCl2溶液;产生白色沉淀的样品为Na2SO4 (每空1分)(其他合理答案也给分)
26.(14分)(1) 饱和食盐水;装置漏气;用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (涂肥皂水等合理方法均可)
(2) 关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。
(3) 是,原理与装置I同
否,c瓶因密闭,体积不能改变,压强增大时有危险
四、有机化学题
27.(5分)(1)NH3 HCN CO(NH2)2 (2)
28.(共6分)(1) C33H54 (2)11
29.(6分)(1)
(2)
(3)
30.(8分)(1)
(2)
(3)取代反应 还原反应 加成反应 (4)6
五、计算题
31.(5分)(1)CaO+2HCl=CaCl2+H2O (2)NaOH+HCl=NaCl+H2O
56g 2mol 40g 1mol
0.0056g xmol Yg 2×10—4mol
x=0.0002mol Y=0.008g
![]() T(HCl/NaOH)
=0.008g·mL-1
T(HCl/NaOH)
=0.008g·mL-1
32.(6分)(1)![]() ×100%(或25a%)(2分) (2)2a 不变(各1分) (3)6(2分)
×100%(或25a%)(2分) (2)2a 不变(各1分) (3)6(2分)