高三教学化学情况调查
命题单位:无锡市教育研究中心
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至10页,共150分。考试时间90分钟。
第Ⅰ卷(选择题 共742分)
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
K 39 Rb 85 Cs 133 Ba 137
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.2003年“神州五号”飞船实现了载人航天,标志着我国航天技术达到了世界先进水平,飞船应用了许多尖端的合成材料。下列物质中,不属于合成材料的是
A.人造丝 B.有机玻璃 C.硅橡胶 D.黏合剂
2.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是
A.它是由两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
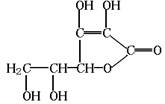 3.维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是
3.维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是
A.维生素C的化学式为C6H8O6
B.维生素C可作食品添加剂
C.维生素C可发生水解反应
D.维生素C不能发生氧化反应
4.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)= CO(g)+H2(g);△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(l)+8H2O (l);△H>0
C.CaC2(s)+2H2O(l)→Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)→ CO2(g)+2 H2O (l);△H<0
5.下列操作正确的是
A.把pH试纸浸入溶液中测定溶液的pH
B.称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
C.苯酚沾在皮肤上立即用酒精擦洗
D.用水清洗做过碘升华实验的试管
6.为计算方便,有人将98%的浓硫酸表示成下列形式,其中合理的是
A.SO3·9 /10H2O B.H2SO4·1/9H2O C.H2SO4·SO3 D.H2SO4·H2O
7.下列叙述正确的是( )
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间通过氢键作用有规则排列成的分子晶体
D.液态氯化钠和铜导线的导电原理是相同的
8.化合物甲是由氟元素和氧元素形成的一种不稳定的物质,10mL甲气体可分解成15mL
O2和10mLF2(气体都在同温同压下测定)。下列关于化合物甲的说法正确的是
![]() A.该化合物的分子式为O2F3
B.其电子式可表示为
A.该化合物的分子式为O2F3
B.其电子式可表示为
C.甲具有很强的氧化性 D.甲中氧元素的化合价为-2价
二、选择题(本题包括10小题,每小题5分,共50分,每小题只有一个或两个选择符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个该小题就为0分。)
9.下列除去杂质的方法正确的是
A.除去甲烷中的乙烯:通过盛有溴的四氯化碳溶液的洗气瓶
B.除去甲苯中的苯酚:加入足量的溴水再过滤
C.除去乙醇中少量的水和氯化钠:加生石灰再加热蒸馏
D. 除去氨气中的水蒸气:通过装有五氧化二磷的U型管
10.下列各组离子在溶液中既可以大量共存,且加入氨水后不产生沉淀的是
A.K+ Ba2+ Cl- SO42- B.H+ NH4+ Al3+ SO42-
C.Na+ AlO2- NO3- OH- D. H+ Cl- CH3COO- NO3-
11.能正确表示下列化学反应的离子方程式是
A.氯化铝溶液中加足量碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+3CO2↑
B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
C.过氧化钠和水反应:Na2O2+H2O=2Na++2OH-+O2↑
D.苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32-
12.下列有关蛋白质的叙述正确的是
A.通过盐析作用析出的蛋白质再难溶于水
B.蛋白质溶液不能发生丁达尔现象
C.蛋白质溶液中的蛋白质能透过半透膜
D.天然蛋白质水解的最后产物都是α— 氨基酸
13.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
A.1:3 B.4:3 C.2:1 D.3:1
14.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.1mol金刚石晶体中含碳碳键数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,22.4LSO3中含有的氧原子数为0.3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
15.在一个固定容积的密闭容器中充入2molNO2,一定温度下建立如下平衡:
2NO2![]() N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol
N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol
N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是
A.x>y B.x<y C.x=y D.不能确定
16.不用其他试剂无法鉴别的一组溶液是
A.硝酸银溶液和稀氨水 B.硫酸钠溶液和氯化钠溶液
C.碳酸钠溶液和稀盐酸 D.氯化铁溶液和氯化铜溶液
17.常温时0.1mol·L-1HA溶液的pH>1,0.1mol·L-1BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是
A. c(H+)< c(OH-)< c(A-)< c(B+)
B. c(OH-)< c(H+)< c(B+) < c(A-)
C. c(H+)+ c(B+)= c(A-)+ c(OH-)
D. c(A-)= c(B+)> c(H+)= c(OH-)
18.有机物甲发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是
A.HOCH2CH2OH B.HOCH2CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3
第II卷(非选择题共78分)
三、(共21分)
19.(1)实验室利用下图装置检验浓硫酸和木炭粉在加热条件下反应所得全部产物。
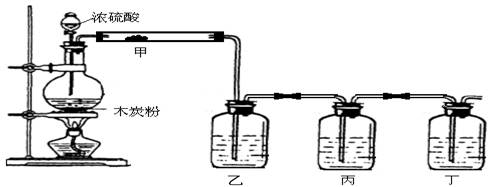
请回答:
①装置甲中应加的试剂是_________________;
②装置乙、丙和丁中所加试剂分别是___________(填下列选项的字母序号);
A.澄清石灰水、品红溶液、高锰酸钾酸性溶液
B.品红溶液、高锰酸钾酸性溶液、澄清石灰水
C.高锰酸钾酸性溶液、品红溶液、澄清石灰水
D.澄清石灰水、高锰酸钾酸性溶液、品红溶液
③实验时为了确保丁所验证的结论正确,丙中应观察到的现象是__________________。
(2)某校化学兴趣小组为测定混合物组成的质量比,实验过程中所加试剂和操作步骤如下表所示:
| 实验 序号 | 混合物A | 加入适量水得到 | 加入试剂B |
| 蒸发滤液得到晶体D | 称量 |
| Ⅰ | BaCl2 NaCl | 溶液 | 过量CO2 | D | A、D | |
| Ⅱ | CaCl2 NaCl | 溶液 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | A、C |
| Ⅲ | Na2SO4 MgSO4 | 溶液 |
试回答下列问题:
①实验Ⅰ中D的成分是_____________,通过称量后_______(填“能”或“不能”)计算得到A中各组分的质量比。
②实验Ⅱ填写的内容中一定错误的是___________,其原因是______________________。
③对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内。
四、(本题包括2小题,共22分)
20.(10分)(1)铅从单质到化合物都有着广泛的应用,如制造焊锡、铅蓄电池、化工耐酸设备以及X射线的防护材料等。铅的氧化物主要有三种:PbO、PbO2和Pb3O4。请回答下列问题:
①铅位于元素周期表中第_______周期第______族;
②PbO2是一种两性氧化物,试写出PbO2和NaOH浓溶液反应的离子方程式:
___________________________________________________________________;
③铅蓄电池是目前使用最普及的一种蓄电池。它是以Pb、PbO2为电极、以H2SO4溶液为电解液。由于硫酸浓度较大,实际参加反应的是HSO4-,而不是SO42-。铅蓄电池放电时负极反应和电池总反应分别为:
负极反应式 Pb+ HSO4--2e-=PbSO4+H+
电池总反应式 Pb+PbO2+2 H2SO4=2 PbSO4+2H2O
则铅蓄电池放电时正极反应式为:______________________________________。
(2)在真空密闭容器中加入一定量的PH4I固体,在一定温度下发生反应:
PH4I(s)
![]() PH3(g) +HI(g),4PH3(g)
PH3(g) +HI(g),4PH3(g)
![]() P4(g) +6H2(g),
P4(g) +6H2(g),
2HI(g) ![]() H2(g) +I2(g)
H2(g) +I2(g)
平衡后,增大压强,容器内n (PH4I)______(填“增加”、“减少”或“不变”,下同),n (I2)______。
21.(12分)物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
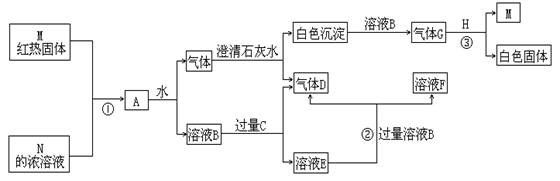
试回答:
(1)写出C、D和H的化学式:
C:_____________;D_______________;H______________。
(2)写出反应①②③的化学方程式:
①____________________________________________________________。
②____________________________________________________________。
③____________________________________________________________。
五、(本题包括2小题,共18分)
22.(6分)实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为____________。若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中
![]()
插入基团“ ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:
__________________________________、____________________________________、
__________________________________、____________________________________。
23.(12分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
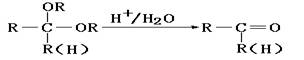
已知:
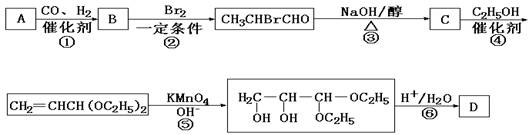
请回答下列问题:
(1)写出下列物质的结构简式:
A:__________;B:____________;C:_____________;D:___________。
(2)指出反应②的反应类型______________________。
(3)写出反应③的化学方程式___________________________________________。
(4)反应④的目的是___________________________________________________。
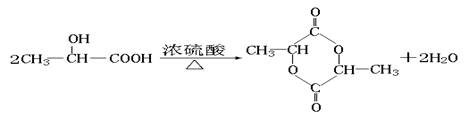
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D’生成E和F的化学方程式:
D’→E:___________________________________________________________。
D’→F:___________________________________________________________。
 六、(共15分)
六、(共15分)
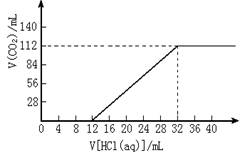
24.今有碱金属的两种碳酸盐组成的混合物
6.14g,加水溶解后,取所得溶液的十分
之一,向其中缓慢滴加一定浓度的盐酸,
并同时记录放出CO2的体积(标准状况)
和消耗盐酸的体积,得到右图所示的曲线
。试计算:
(1)混合物中碳元素的质量分数。
(2)所滴加盐酸的物质的量浓度。
(3)确定这两种碱金属碳酸盐的化学式。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | A | C | D | D | C | B | C | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | C | A | D | B | AD | A | B | AC | CD |
19、(1)①无水硫酸铜 ②BC ③溶液不褪色或未完全褪色
(2)①BaCl2、NaCl 不能
②晶体D 加入的试剂B是过量的
③过量NaOH溶液(试剂B) Mg(OH)2 (固体C)
NaOH、Na2SO4 (晶体D) A、C (称量)
[其它合理答案也可以]
20、(1)①六 ⅣA
②PbO2+2OH-=PbO32-+H2O
③PbO2+3H++HSO4-+2e-=PbSO4+2H2O
(2)增加 减少
21、(1)C:Fe ;D:NO ;H:Mg 。
(2)①C+4HNO3=CO2↑+4NO2↑+2H2O[条件:△]
②3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O
③CO2+Mg=MgO+C[条件:点燃]
22、C7H8
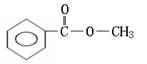
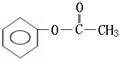
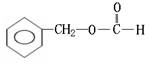
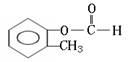 (邻、间、对)
(邻、间、对)
[以上六种任选四种]
23、(1)A:CH2=CH2 B:CH3CH2CHO
C:CH2=CHCHO D:CH2(OH)CH(OH)CHO
(2)取代
(3)CH3CHBrCHO+NaOH→CH2=CHCHO+NaBr+H2O[条件:醇/△]
(4)保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化
(5)
D’→E:CH3CH(OH)COOH→CH2=CHCOOH+H2O[条件:浓硫酸 /△]
D’→F:
24、(1)9.77%
(2)0.25mol/L
(3)K2CO3、KHCO3