高三考前化学练习二
(化学信息题)
1.纳米是长度单位(1nm=10-9m),物质的颗粒达到纳米级时,具有特殊性质。例如,将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜与铜片的比较,正确的是 ( )
A. “纳米铜”比铜片的金属性强 B.“纳米铜”比铜片更易失电子
C.“纳米铜”与铜片的还原性相同 D.“纳米铜”比铜片的氧化性强
2.最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价健结合。下列关于这种物质的叙述中正确的是 ( )
A.是混合物 B.是化合物 C.不含极性键 D.含有离子键
3.2001年11月17日易网报道,意大利科学家使用普通氧分子和带正电子的氧离子 作用,制造出新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构,有关O4的说法如下:
①O4与O2、O3都是氧的同素异形体
②合成O4的反应可看作核聚变反应
③O4分子存在极性共价键
④O4能量密度比普通氧分子高,将来可用作更强力的火箭推进的氧化剂
其中叙述不正确的是 ( )
A.①② B.②③ C.②④ D.③④
![]() 4.在“绿色化学工艺”,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。在用CH3C CH合成CH2=C(CH3)COOCH3的过程中,符合“绿色化学工艺”的,还需要的其它反应物有 ( )
4.在“绿色化学工艺”,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。在用CH3C CH合成CH2=C(CH3)COOCH3的过程中,符合“绿色化学工艺”的,还需要的其它反应物有 ( )
A.CO和CH3OH B.CO2和H2O C.H2和CO2 D.CH3OH和H2
5.1999年1月,俄美科学家联全小组宜布合成出114号元素的一种同位素,该同位素原子的质量数为298。由实验预测它有良好的力学、光学、电学性质,并将它命名为“类铅”。下列叙述不正确的是 ( )
A.该元素属于第IVA族
B.该元素性属于第七周期
C.电解硝酸铜与硝酸“类铅”的混合溶液首先析出“类铅”
D.该同位素原子含184个中子和114个电子
6.1999年1月以来,比利时等西欧国家相继发生了严重的二恶英污染事件。二恶英是二苯基-1,4-二氧六环及其衍生物的总称,其中2,3,7,8-二恶英(即TCDD,结构如右图所示)比较常见,且具有最强的毒性。下列有关TCDD的说法正确的是( )
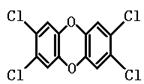 A.TCDD的化学式为C12H8O2Cl4
A.TCDD的化学式为C12H8O2Cl4
B.TCDD是一种平面状的三环芳香族化合物
C.TCDD是一种非极性分子,难溶于水
D.TCDD在自然界很不稳定,受热即可分解
7.三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是 ( )
A.NF3是离子化合物 B.NF3的还原性比NH3强
C.NF3的氧化性比F2强 D.NF3中的N呈+3价
8.吸入人体内的O2有2%转化为活性氧(如
![]() ),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3(Se为VIA族元素)消除活性氧。下列说法中不正确的是( )
),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3(Se为VIA族元素)消除活性氧。下列说法中不正确的是( )
A.Na2SeO3溶液的pH>7 B.消除活性氧时,Na2SeO3是还原剂
C.H2SeO4的酸性比H2SO4强 D.H2Se的稳定性比HBr弱
9.健康人血液的pH总是维持在7.35~7.45之间,这是由于 ( )
A.人体内含有大量水分
B.血液中NaCl的含量保持恒定不变
C.人体排出的酸性物质与碱性物质部分溶解在血液中
D.血液中HCO3-和H2CO3只允许在一定的比例范围
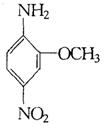
10.2—氨基—5—硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、
|
色基B相同,且氨基(—NH2)与硝基(—NO2)直接连苯
环上并呈对位时的同分异构体数目(包括红色基B)可能为 ( )
A.2种 B.4种
C.6种 D.10种
11.用特殊的方法把固体物质加工到纳米级(1nm=1×10-9m)的超细粉末粒子,由这些超细粉末粒子制得的材料叫纳米材料。某分散系中分散质的微粒直径为20nm,那么该分散系不可能 ( )
A.产生丁达尔现象 B.通过半透膜
C.通过滤纸 D.加入电解质后发生凝聚
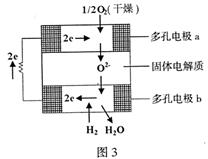
12.固体氧化物燃料电池是由美国西屋(West-inghouse)公司研制开发的。它以固体氧化锆
|
允许氧离子(O2-)在其间通过。该电池的工作
原理如图3所示,其中多孔电极a、b均不参与
电极反应。下列判断正确的是( )
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e=4OH-
![]() D.该电池的总反应方程式为2H2+O2
2H2O
D.该电池的总反应方程式为2H2+O2
2H2O
13.亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+离子转化为Fe3+离子,生成高铁血红蛋白而丧失与氧气结合的能力,误食亚硝酸钠中毒,可服维生素C缓解。下列叙述中表现亚硝酸钠和维生素C的性质正确的是 ( )
A.还原性和氧化性 B.氧化性和还原性
C.氧化性和酸性 D.还原性和碱性
14. 美国的一位农民偶然发现他的—头小母牛食用腐败草料后,在受外伤时血液不会凝固,伤口流血不止。威斯康星大学的化学家由此得到启发,从腐败草料中提取出结构简式为
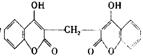 的双香豆素。关于双香豆素的下列推论中错误的是( )
的双香豆素。关于双香豆素的下列推论中错误的是( )
A. 有望将它发展制得一种抗凝血药
B. 它略具芳香味,可用来配制致命性出血型的杀鼠药
C. 能发生水解反应、加成反应和氧化反应
D. 所有的碳原子不可能都在同一乎面内
15. 单质钛的机械强度高,抗腐蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有
①FeTiO3+3H2SO4====Ti(SO4)2+FeSO4+3H2O
②Ti(SO4)2+3H2O====H2TiO3↓+2H2SO4
③H2TiO3![]() TiO2+H2O ④TlO2+2C+2Cl2
TiO2+H2O ④TlO2+2C+2Cl2![]() TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg====2MgCl2+Ti
下列叙述错误的是 ( )
A. 反应①是非氧化还原反应 B. 反应②是水解反应
C. 反应④中TiO2是氧化剂 D. 反应⑤表现了金属镁还原性比金属钛强
16.2002年度国家科学技术奖的颁奖大会,于2003年2月28日在人民大会堂隆重
举行,连续四年空缺的国家自然科学一等奖由中科院上海有机化学研究所获得。他们
完成的有机分子簇集和自由基化学研究项目,荣获2002年度国家自然科学
唯一个一等奖。
(1)上海有机化学研究所在我国氟化学理论研究和氟产品以及核化学工业方面等作出过重大贡献,如F46,就是用四氟乙烯与全氟丙稀共聚得到的。写出这两种单体按物质的量之比为1:1聚合所得高分子化合物的结构简式
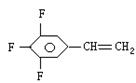
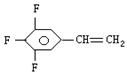
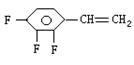
(2)已知三氟苯乙烯(三个氟均连在苯环上)的分子式为C8H5F3,则它的异构体除
|
外,还有 种,试写出其中任意两种的结构简式
。
(3)有机反应中很多是自由基反应,最简单的自由基是碳烯(小变),它可以由重氮甲烷(CH2N2)受热或光照时分解得到,同时有氮气生成
①碳烯的电子式为 ,重氮甲烷的结构式为 。
②碳烯很容易以它的一对未成对电子与不饱和烯、炔发生加成,生成三元环状化合物,它与丙烯反应后所得产物的结构简式为 。
③碳烯还可以插入C—H之间,使碳链加长。它插入丙烷分子C—H之间,碳链增长形成C4H10,该化合物结构简式为 。
④重氮甲烷的CCl4溶液用紫外光照射时发生反应,生成一种相对分子质量为210的有机物和N2,写出该反应的化学方程式(有机物用结构简式表示):
。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| C | B | B | A | C | BC | D | C | D | D | B | D | B | D | C |
|
|
(2)5;
|
|
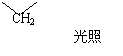 |
![]() ③CCl4+4CH2N
C(CH2Cl)4+4N2↑
③CCl4+4CH2N
C(CH2Cl)4+4N2↑