高三理科摸底测试化学卷
命卷人:高忠林
本试卷满分100分,考试时间100分钟,不得使用计算器。
可能用到的相对原子质量:H—1、C—12、N—14、O—16、Na—23、Al—27、S—32、
Cl—35.5、K—39、Cu—64
一.选择题:(仅一个正确选项,共20题,每小题2分共40分)
1. 人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
![]()
2. 我国三峡工程竣工后将提供清洁、廉价的可再生能源,因此三峡工程建成后,将有利于①减少CO2排放量;②鱼类的洄游;③减少洪水对中下游地区的危害;④减少碳氢化合物的排放;⑤文物的保护;⑥节约不可再生能源的消耗
A.①②③④ B.①③④⑤ C.①②⑤⑥ D.①③④⑥
3. 市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性;②使用时加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是
A.Cl2 B.SO2 C.NaClO D.KMnO4
4. 下列叙述中正确的是
A. 某物质含有一种元素,则该物质一定是纯净物
B. 金刚石和石墨之间的转变,碳原子间的结构发生变化
C. 不同的物质的相对分子量一定不同
D.相同原子组成的分子一定相同
5. 航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
2 NH4ClO4
![]() N2↑+ 4 H2O↑ + Cl2 ↑+ 2 O2 ↑+ Q(Q>0)
N2↑+ 4 H2O↑ + Cl2 ↑+ 2 O2 ↑+ Q(Q>0)
下列对此反应的叙述中错误的是
A. 上述反应属于分解反应
B. 上述反应瞬间产生大量高温气体推动航天飞机飞行
C. 反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
6.
可逆反应 2SO2 + O2 ![]() 2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)[mol·(L·min)-1]表示,逆反应速率分别用v`(SO2)、v`(O2)、v`(SO3)[mol·(L·min)-1]表示,当反应达到化学平衡时,正确的关系是
2SO3,正反应速率分别用v(SO2)、v(O2)、v(SO3)[mol·(L·min)-1]表示,逆反应速率分别用v`(SO2)、v`(O2)、v`(SO3)[mol·(L·min)-1]表示,当反应达到化学平衡时,正确的关系是
A.v`(O2)= v`(SO3) B.v(SO3)= 1/2 v`(O2)
C.v`(O2)=1/2 v`(SO2) D.v(SO2)=v(O2)=v(SO3)
7. 从下列现象可以判断某一元酸是强酸的是
A.加热该酸至沸腾也不分解 B.该酸可以使石灰石溶解放出CO2
C.该酸可以把Al(OH)3沉淀溶解 D.该酸浓度为0.1mol·L-1时的PH为1
8. 下列反应的离子方程式正确的是
A. 浓盐酸和二氧化锰加热制氯气
MnO2
+ 2 Cl- + 4 H+ ![]() Mn2+
+ Cl2↑+ 2 H2O
Mn2+
+ Cl2↑+ 2 H2O
B. 在BaCl2溶液中通入适量SO2气体:
Ba2+ + SO2 + H2O == BaSO3 ↓ + 2 H+
C.Fe和稀HNO3反应:Fe + 2 H+ == Fe2+ + H2↑
D.在苯酚钠溶液中通入少量的CO2气体:
![]()
9. 几种短周期元素,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子数的3倍;C元素原子次外层电子数等于其原子核外电子总数的一半;D的阳离子与B的阴离子电子层结构相同,它们的原子序数由大到小的排列顺序有:①A>D>C>B②D>B>A>C③C>D>B>A④B>A>C>D其中正确的是
A.只有② B.①② C.②③ D.③④
10.关节炎病原因是在关节滑液中形成尿酸钠晶体
HUr + H2O ![]() Ur- +
H3O+ ① Ur-(aq)+ Na+(aq)
Ur- +
H3O+ ① Ur-(aq)+ Na+(aq)![]() NaUr(s) ②
NaUr(s) ②
尿酸 尿酸根离子
第一次关节炎发作大都在寒冷季节脚趾和手指的关节处,对反应②的下列叙述正确的是
A.是吸热反应 B.温度升高,平衡向正方向移动
C.温度降低,平衡向正方向移动 D.以上全不对
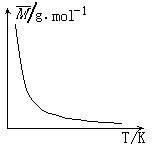 11.可逆反应2X +Y
11.可逆反应2X +Y ![]() 2Z(g)+Q,气体的
2Z(g)+Q,气体的
平均摩尔质量(![]() )随温度变化如图所示,
)随温度变化如图所示,
则下列说法正确的是
A.X和Y可能都是固体
B.若Y为固体,X一定是气体
C.X和Y一定都是气体
D.X和Y不可能都是气体
12.某种一元酸(HA)溶液中,加入一定量的一种强碱(MOH)溶液后恰好完全反应,则下列有关反应后溶液的判断中,一定正确的是
A.c(A-)≤c(M+) B.c(A-)≥c(M+)
C.若MA不水解,则c(OH-)<c(H+) D.若MA会水解,则c(OH-)≥c(H+)
13.有一种红棕色液体ICl,其性质与卤素相似,ICl跟Zn、H2O反应的化学方程式如下:2 ICl + 2 Zn == ZnCl2 + ZnI2 ICl + H2O == HCl + HIO
下列叙述正确的是
A. ZnCl2是氧化产物,又是还原产物
B. ZnI2是氧化产物,又是还原产物
C. ICl跟水反应,ICl是氧化剂,H2O是还原剂
D. ICl跟水反应,是自身氧化还原反应
14.1966年,范克(Fwnk·J·E)等人提出用H2O和H2SO4为原料进行热化学循环制氢法:2 H2O(l)+SO2(g)+ I2(s)![]() H2SO4(aq)+ 2HI(g)
H2SO4(aq)+ 2HI(g)
![]() H2SO4(aq)
H2SO4(aq)![]() H2O(l)+SO2(g)+ O2(g);2HI(g)
H2O(l)+SO2(g)+ O2(g);2HI(g)![]() H2(g)+ I2(g)
H2(g)+ I2(g)
从理论上讲,该循环中,1mol原料H2O能制得氢气
A.0.25mol B.0.5mol C.1 mol D.2 mol
15.氢氧燃料电池是一种高性能电池,总反应为2 H2 + O2 == 2 H2O,电解质溶液为KOH溶液,下列有关该电池的叙述中不正确的是
A.H2为负极,O2为正极 B.工作时电解质溶液的PH不断增大
C.负极反应:2H2-4e- +4OH-=4H2O D.正极反应:O2 + 4e- +2 H2O=4OH-
16.下列说法中正确的是
A. 核外电子排布完全相同的两种粒子,其化学性质一定相同
B. 难失电子的原子,一定具有强氧化性
C. 离子化合物和共价化合物中都可能含有非极性键
D.含有阴离子的物质中不一定含有阳离子
17.下列说法正确的是(NA表示阿伏加得罗常数)
A.1 mol 氧气含有氧原子数为NA
B.标准状况下,1升甲烷完全燃烧后,所生成气态产物的分子数为![]()
C.常温常压下,活泼金属从盐酸中置换出22. 4L H2,发生转移的电子数为2NA
 D.常温常压下,1mol氦气含有的核外电子数为4 NA
D.常温常压下,1mol氦气含有的核外电子数为4 NA
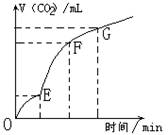
18.用纯净的CaCO3与稀HCl反应制CO2,
实验过程记录如图所示。下列分析正确的是
A. OE段表示反应速率最快
B. EF段表示反应速率最快,收集的CO2最多
C. FG段表示收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
19.某课外活动小组做了一个有趣的实验:将2g铝粉和3g碘粉小心混合均匀,分为质量相等的3份,分别进行如下实验,现将实验记录列表如下。
| 第一组 | 加入0.5g水 | 很快产生火花 |
| 第二组 | 加入1g胆矾 | 约需30s产生火花 |
| 第三组 | 加入1g无水硫酸铜 | 1min时仍没有产生火花 |
根据上述实验事实作出的推断错误的是
A. 水能增大铝和碘反应的速率
B. 第一组实验中铝和碘发生了化合反应生成了Al I3
C. 第一组和第二组实验中还能观察到紫色的烟
D.第三组实验中铝和硫酸铜发生了置换反应
20.将20 mL 0.4 mol·L-1硝酸铵溶液跟50mL 0.1 mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A.[NO3-]>[OH-]>[NH4+]>[Ba2+] B.[NO3-]>[Ba2+]>[OH-]>[NH4+]
C.[Ba2+]>[NO3-]>[OH-]>[NH4+] D.[NO3-]>[Ba2+]>[NH4+]>[OH-]
二.填空题:(共6小题,共49分)
21.(6分)用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时,红色突然消失,试用文字简要说明产生上述现象的两种可能原因。
①
②
简述怎样用实验证明红色褪去的原因是①还是②?
22.(11分)以铝屑、稀硫酸、氢氧化钠溶液为原料制备1 mol Al(OH)3的实验方案设计填表。
| 实验方案(简述过程) | 消耗H+ /mol | 消耗OH- /mol |
| 1. | ||
| 2. | ||
| 3. |
对以上三种实验方案设计做简单评价:
。
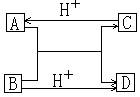 23.(8分)已知A、B、C、D四种不同粒子。他们
23.(8分)已知A、B、C、D四种不同粒子。他们
之间存在如图关系:
⑴如果A、B、C、D均为10电子的粒子,则A
的结构式为 ;D的电子式为 。
⑵如果A为一种金属阳离子,且A、B、D均为
10电子粒子,C为30电子粒子。试写出:
A和B在溶液中反应生成C和D的离子方程式 ;
C与H+反应生成A的离子方程式 。
24.(10分)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得。
⑴根据性质,推测氮化硅陶瓷的用途是 (填序号)
A.制气轮机叶片 B.制有色玻璃 C.制永久性模具 D.制造柴油机
⑵写出N的原子结构示意图: ,根据元素周期律知识,写出氮化硅的化学式: 。
⑶氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式: ;
⑷现用四氯化硅和氮气、氢气在加强热的条件下发生反应,可得较高纯度的氮化硅,反应的化学方程式: 。
25.(6分)在某温度下,把2 mol A和3 mol B充入2 L的密闭容器中发生反映:
a A(g)+ B(g)![]() C(g)+ D(g),5 min后达到平衡时,C的浓度为0.6 mol·L-1
C(g)+ D(g),5 min后达到平衡时,C的浓度为0.6 mol·L-1
⑴用B的浓度变化来表示的该反应速率v(B)= ;
⑵若在温度不变的条件下,将反应容器扩大为4 L,A在平衡混合物中的含量保持不变。则a= ;
⑶若在升高温度的条件下,也将反应容器扩大为4 L,C的浓度变为0.35 mol·L-1,则该正反应是 (“放热”、“吸热”)的。
26.(8分)在0.05 mol·L-1 Na3PO4溶液中,有
⑴物料守恒:[Na+] = ;
⑵电荷守恒:[Na+] + [H+] = [OH-] + [PO43-]+ [HPO42-]+ [H2PO4 -]
⑶推测:[OH-] = [H+] + [H3PO4 ] + [HPO42-] + [H2PO4 -]
(试中[ ] 表示微粒的平衡物质的量浓度)
如果⑶式五项中有两项可以忽略不计,它们是 和 。
三.计算题:(共2小题,共11分)
27.(4分)在40 mL 0.10 mol·L-1 BaCl2 溶液中,加入过量0.10 mol·L-1 H2SO4 溶液,使沉淀完全。将反应后的混合物过滤,取滤液一半,在滤液中加入25 mL 0.20 mol·L-1NaOH溶液至恰好呈中性,计算过量H2SO4溶液的体积。
28.(7分)NaHCO3和KHCO3的混合物9.20g和100mL 盐酸反应。
⑴若NaHCO3和KHCO3的物质的量相同,
①试分析,欲求标准状况下生成CO2的体积时,还需什么数据(用a、b等表示,要注明)。答: ;
②求标准状况下生成CO2的体积:
| 所需数据的取值范围 | 生成CO2的体积(标准状况) |
| 盐酸不足时: | |
| 盐酸过量时: |
⑵ 若NaHCO3和KHCO3不是等物质的量混合,则9.20g固体与足量盐酸完全反应时,在标准状况下生成CO2的体积大于 L;小于 L。(要有必要的说明及计算过程)
高三理科摸底测试化学卷答卷页
命卷人:高忠林
本试卷满分100分,考试时间100分钟,不得使用计算器。
可能用到的相对原子质量:H—1、C—12、N—14、O—16、Na—23、Al—27、S—32、
Cl—35.5、K—39、Cu—64
一.选择题:(仅一个正确选项,共20题,每小题2分共40分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选项 | B | D | C | B | D | C | D | A | C | C |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 选项 | B | A | B | C | B | C | B | B | D | B |
二.填空题:(共6小题,共49分)
21.(6分)
① 氯气在水中产生HClO,HClO有漂白性,是酚酞褪色 ;
② 氯气溶于水产生酸,中和NaOH,从而使溶液碱性降低,酚酞褪色 ;
简述怎样用实验证明红色褪去的原因是①还是②?
取褪色后溶液滴加NaOH溶液,如恢复红色,则为②,反之①正确 。
22.(11分)
| 实验方案(简述过程) | 消耗H+ /mol | 消耗OH- /mol | ||
| 1.Al→Al2(SO4)3→Al(OH)3 | 3 | 3 | ||
| 2.Al→NaAlO2→Al(OH)3 | 1 | 1 | ||
| 3. | Al →Al2(SO4)3 | →Al(OH)3 | 3/4 | 3/4 |
| Al → NaAlO2 | ||||
对以上三种实验方案设计做简单评价:
![]() 方法3最好,产生等量 Al(OH)3 原料最省 。
方法3最好,产生等量 Al(OH)3 原料最省 。
![]() 23.(8分)
23.(8分)
⑴ A结构式为 ;D的电子式为 。
⑵A和B在溶液中反应生成C和D的离子方程式
Al + 4 OH- == AlO2- + 2 H2O ;
C与H+反应生成A的离子方程式 AlO2- + 4 H+ == Al 3+ + 2 H2O 。
 24.(10分)
24.(10分)
⑴ A、C、D ⑵ , Si3N4 。
⑶ Si3N4 + 12 HF == 3 SiF4↑+ 4 NH3↑ ;
⑷ 3 SiCl4 + 2 N2 + 6 H2 == Si3N4 + 12 HCl 。
25.(6分)
⑴ v(B)= 0.12mol·L-1·min-1 ;⑵ a= 1 ;⑶ 吸热 。
26.(8分)
⑴ [Na+] = 3{ [PO43-] + [HPO42-] + [H2PO4 -] + [H3PO4 ] };
⑵ [Na+] + [H+] = 1 [OH-] + 3 [PO43-]+ 2 [HPO42-]+ 1 [H2PO4 -]
⑶ [OH-] = 1 [H+] + 3 [H3PO4 ] + 1 [HPO42-] + 2 [H2PO4 -]
可以忽略 [H+] 和 [H3PO4 ] 。
三.计算题:(共2小题,共11分)
27.(4分) 50 mL
28.(7分 )
⑴ ① 答: 盐酸的物质的量浓度a mol·L-1 ;
②
| 所需数据的取值范围 | 生成CO2的体积(标准状况) |
| 盐酸不足时:a ≤ 1 mol·L-1 | 2.24 a L |
| 盐酸过量时:a > 1 mol·L-1 | 2.24 L |
⑵ 2.06 L ; 2.45 L 。