高三年级第2学期综合测试化学卷
本试卷分第Ⅰ卷和第Ⅱ卷两部分。满分150分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 S—35.5 Cu—64 Br—79
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、氧气和臭氧都是由氧原子组成,氧气是生命活动中不可缺少的物质之一,而臭氧是一种有刺激性气味的气体,浓度较高时会对人体健康造成危害,如使脑干受损、干扰体温调节及严重影响视力等。氧气和臭氧应属于( )
A.同系物 B.同素异形体 C.同位素 D. 同分异构体
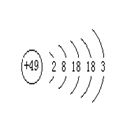 2、张清莲是我国著名的化学家。1991年,他准确测得In
2、张清莲是我国著名的化学家。1991年,他准确测得In
的原子量为114.818,被国际原子量委员会采用为新的标准值。
这是原子量表中首次采用我国测定的原子量值。已知In的原子结
构如图所示,则下列关于In的说法不正确的是( )
A、In为长周期元素 B、In为过渡元素
C、In易导电导热 D、In在反应中容易失电子
3、一般认为:原子在相互作用形成化合物时,需要通过电子转移(得
失或共用)形成最外层8电子稳定结构(H 除外)。但是,也有许多化合物例外,即最外层电子不足或超过8个电子。下面所列的化合物中,各原子无法满足最外层8电子的是( )
A、PCl3 B、NaCl C、NO D、CCl4
4、已知,往0.1mol/L的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是( )
A、往溶液中滴入稀硫酸 B、往溶液中加入NH4Cl
C、把溶液加热至沸腾 D、往溶液中加入NaOH
5、X、Y、Z是三种单质。已知:Y能够把Z从其化合物的水溶液中置换出来,而Z又能在一定条件下把X从其化合物的水溶液中置换出来。由此可推知下列说法可能正确的是( )
①单质的氧化性:Y>Z>X ②单质的还原性:Y>Z>X
③对应离子的氧化性:X>Z>Y ④对应离子的还原性:X>Z>Y
A、只有② B、只有②③ C、只有①④ D、①②③④
6、下列事实不能用电化学原理解释的是( )
A、 常温条件下,在空气中铝不容易被腐蚀
B、 镀锌铁片比镀锡铁片更耐腐蚀
C、 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜
D、 远洋海轮的尾部装上一定数量的锌板
7、合成氨(![]() )工业中,常采用500℃的温度条件。有下列关于选用该条件的叙述:①加快反应速率;②使平衡向产物方向移动;③提高原料转化率;④使催化剂的活性达到最佳状态。其原因可能是下列中的( )
)工业中,常采用500℃的温度条件。有下列关于选用该条件的叙述:①加快反应速率;②使平衡向产物方向移动;③提高原料转化率;④使催化剂的活性达到最佳状态。其原因可能是下列中的( )
A、④ B、①④ C、②③ D、①②③④
8、下列实验:①淀粉水解、②纤维素水解、③乙酸乙酯制取、④由乙醇制取乙烯、⑤用苯和硝酸制取硝基苯。实验中用到浓硫酸的是( )
A、只有③④ B、只有③④⑤
C、只有②③④⑤ D、①②③④⑤
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
9、将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量的CH3COONa晶体时,都会引起( )
A、溶液的pH 值增加 B、溶液中的c(H+)增大
C、溶液的导电能力减弱 D、溶液中的c(OH-)减小
10、在含2 mol H2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是( )
①放出的气体中除SO2外还有H2
②只放出SO2气体其物质的量为1 mol
③反应结束时转移的电子的物质的总量为4 mol
A、① B、② C、②③ D、①②
11、下列离子方程式正确的是( )
A、等物质的量的硫酸氢钠溶液跟氢氧化钡溶液混合:
H++SO![]() +Ba2++OH-====BaSO4↓+H2O
+Ba2++OH-====BaSO4↓+H2O
B、将标准状况下112 mL氯气通入10 mL浓度为1 mol·L-1的溴化亚铁溶液中:
2Fe2++4Br-+3Cl2====2Fe3++6Cl-+2Br2
C、用NaOH吸收少量H2S:
OH-+H2S====HS-+H2O
D、向碳酸氢镁溶液中加入过量的澄清石灰水:
Mg2++2HCO![]() +Ca2++2OH-====MgCO3↓+CaCO3↓+2H2O
+Ca2++2OH-====MgCO3↓+CaCO3↓+2H2O
12、某有机物M的化学式为C5H10,该有机物与足量的H2反应时,得到2-甲基丁烷。则有机物M的可能结构应该有( )
A、1种 B、2种 C、3种 D、4种
13、下列事实不能证明某一元酸HX属于强酸的是( )
A、0.1mol/L的HX溶液的pH=1
B、1L0.1mol/L的HX与1L0.1mol/LNaOH恰好中和
C、NaX溶液中C(Na+)=C(X—)
D、1mol/L的HX稀释103倍,pH变化3个单位
|
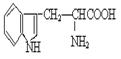
A、 该有机物的化学式为C11H12N2O2
B、 该有机物能够与强酸和强碱反应
C、 一定条件下既可发生加成和酯化反应
D、一定条件下会发生加聚反应生成蛋白质
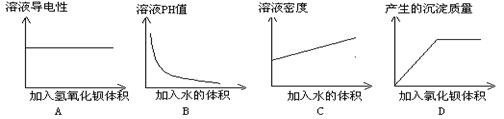
15、某同学在一定量的稀硫酸溶液中加入一定量的其他溶液,并测定有关的实验数值数值。实验后,将有关实验数据绘制成如下图象,其中正确的是( )
|
16、一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是( )
A、负极反应为14H2O+7O2+28e-====28OH-
B、放电一段时间后,负极周围的pH升高
C、每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D、放电过程中KOH的物质的量浓度不变
17、在一恒定的容器中充入2 mol A和1
mol B发生反应:2A(g)+B(g) ![]() x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6
mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为(
)
x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6
mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为(
)
A、只能为2 B、只能为3
C、可能是2,也可能是3 D、无法确定
18、对于xA(g)+yB(g) ![]() zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
A、x+y>z+w,正反应是放热反应
B、x+y>z+w,正反应是吸热反应
C、x+y<z+w,逆反应是放热反应
D、x+y<z+w,逆反应是吸热反应
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共20分)
19、指出下列操作对实验结果的影响。
(1)欲配制0.1 mol·L-1 CuSO4溶液100 mL,取2.5 g胆矾在烧杯中溶解,然后倒入容量瓶定容在100 mL,则浓度偏______________。
(2)用80% H2SO4加等体积水配40% H2SO4,则浓度偏_______________。
用80%酒精加等体积水配40%酒精,则浓度偏_______________。
20、最近报纸上经常刊载有关建筑工人误食亚硝酸钠(由于亚硝酸钠很象氯化钠而误作食盐)中毒的事件,某课外兴趣小组决定开展研究,寻求可行的方法,鉴别某样品是亚硝酸钠还是氯化钠,以解决这一问题。该小组查阅了大量的资料,对亚硝酸钠的性质做如下归纳:
亚硝酸钠,化学式为NaNO2,是亚硝酸(HNO2,一种弱酸)的钠盐。白色粉末,易溶解在水中,有毒,容易潮解。由于亚硝酸钠中的氮元素处于中间价态,既有氧化性(在酸性条件下会氧化KI,得到碘单质),又有还原性(在酸性条件下,会被KMnO4氧化)。大量用于防锈、印染等……
甲设计方案如下:取少量固体,配成溶液。往溶液中滴加少量酸性KMnO4溶液,观察溶液是否褪色。如果褪去,说明该样品为亚硝酸钠。反应表达式为:
___MnO4-+___NO2-+___H+=___Mn2++___NO3-+___H2O
(1)配平上述离子方程式;
(2)根据上述信息,还可以设计其他一些实验方案。试写出你所设计的方案(注:能写几种写几种;用品自行选择;简要写出实验操作、现象和结论。)
(3)甲认为他的方案还可测定样品中亚硝酸钠的含量。过程如下:Ⅰ、称一定量样品,溶于水置于锥形瓶中;Ⅱ、取酸性KMnO4溶液(过量)倒入锥形瓶中,振荡;Ⅲ、用草酸钠溶液滴定过量的KMnO4;Ⅳ、重复上述操作。
①若每次实验时用到0.10mol/L酸性KMnO4溶液25.00mL,为减小实验误差,从中学的角度看,量取该溶液时宜采用的仪器是______________________。
②各次实验数据如下:
| 实验次序 | 样品质量(g) | 滴定管中的草酸钠溶液(浓度为0.25mol/L) | |
| 滴定前滴定管读数(mL) | 滴定后滴定管读数(mL) | ||
| 1 | 5.0 | 1.02 | 10.02 |
| 2 | 5.0 | 1.56 | 10.60 |
| 3 | 5.0 | 1.26 | 10.24 |
已知:2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O。试计算样品中NaNO2的质量分数(必须列出计算过程;假设该样品只含有NaNO3和NaNO2)。
四、(本题包括2小题,共20分)
21、A 、B、C、D是分布在三个短周期内除希有气体以外的四种元素,它们的原子序数依次递增。且已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B原子的核外电子数。回答下列问题(必须用对应的元素及其化合物的化学式回答下列问题,如果试题涉及有机物,请写出有机物的结构简式。)
1) 画出元素C的原子结构示意图:___________________________;
2) 由元素D组成的单质,与某一D原子最近的D原子有_________个;
3) BC2的化合物的熔点比DC2______(填“高”或“低”),其原因是_____
_________________________________________________________;
4) 元素A、B形成的化合物有多种。试写出所有的A、B原子在同一平面
的两种化合物_____________________;
5)D与A能形成原子个数比为1:4的化合物。该物质还原性很强,通入盛硝酸银溶液的试管中,会产生银镜,同时生成一种D的氧化物(不溶于水)和硝酸。该反应方程式为____________________________________________。
22、将a mol A(g),d mol D(g)置于体积可变的密闭容器中加热至一定温度,发生如下反应:
2A(g) ![]() 2B(g)+C(g),2D(g)+C(g)
2B(g)+C(g),2D(g)+C(g) ![]() 2E(g)
2E(g)
t min时建立平衡,平衡时测得B的物质的量为m mol,C的物质的量为n mol,试回答:
(1)平衡时,D的物质的量为 mol(用含d、m、n的代数式表示)
(2)平衡时若温度压强与反应前相同,则反应前和平衡时气体的密度之比为(用含a、d、m、n的代数式表示)
五、(本题包括2小题,共18分)
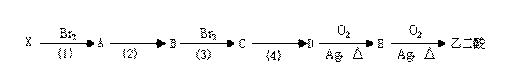
23、现有下列物质之间的转化关系图:
|
已知:在上述转化过程中均未引入有机反应物(X除外),而且A的相对分子质量比X大79,而C的相对分子质量又比A大79。试回答下列问题:
(1)B的结构简式为_________________
(2)D和乙二酸在浓硫酸、加热条件下会形成六元环状化合物,试写出反应的化学方程式:___________________________________________________
(3)指出物质转化图中反应(1)、(2)、(3)、(4)依次所属的反应类型:__________________________________________________________________
24、D(分子式为C7H9NO2)涂在手术后的伤口上,发生加聚反应,数秒钟后生成E而固化,起到缝合伤口的作用。D可以由一系列反应合成。
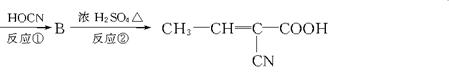
A(CH3—CH==CH—COOH)
![]()

(1)B的结构简式为 。
(2)写出反应类型:反应① ;反应② ;反应③ 。
(3)反应③的化学方程式 。
六、(本题包括2小题,共20分)
25、铅蓄电池在作电源时,用硫酸作为电解质溶液。电池放电时反应如下:Pb+PbO2+2H2SO4==2PbSO4+2H2O。下表是不同质量分数的硫酸对应的密度。
| 质量分数 | 0.220 | 0.252 | 0.283 | 0.314 | 0.344 | 0.374 | 0.403 |
| 密度(g/mL) | 1.155 | 1.180 | 1.205 | 1.230 | 1.255 | 1.280 | 1.305 |
回答下列问题:
(1)写出电池放电时正极的电极反应式:__________________________。
(2)已知铅蓄电池中硫酸溶液的密度低于1.18 g/mL时,将不再放电,此时需要充电;充电过程中,当密度达到1.28 g/mL时,电池自行停止充电。现有某经充分充电后的铅蓄电池(设铅蓄电池的容积为2L,且在充、放电过程中液体体积保持不变),现让该电池充分放电,理论上将释放出多少的电量(以电子数目表示)?
26、有机物X由C、H、O三种元素组成,X的沸点是198℃,已知:①在一定温度和压强下,在密闭容器中把4.2 L X蒸气和16.0 L O2混合点燃,当充分反应后,将温度和压强恢复到原来状况,得混合气体A为26.5 L(已知在该实验状况下气体的摩尔体积为42.0 L·mol-1);②当A处于标准状况下时,气体体积变为7.3 L,此时测得气体对H2的相对密度为19.64。解答下列问题:
(1)推断气体A的组成(简述过程和结论)。
(2)计算A的各组分的物质的量。
(3)确定X的分子式和结构简式。
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.B 2.B 3.C 4.D 5.D 6.A 7.B 8.C
二、(本题包括10小题)
9.A 10.C 11.A 12.C 13.B 14.D 15.D 16.C 17.C 18.BD
三、
19.(1)低 (2)高 低
20.(1)2 5 6 2 5 3
(2)略
(3)①酸式滴定管 ②7.07%
四、
21.(1) (2)4
(3)低 BC2(二氧化碳)是分子晶体,而DC2(二氧化硅)是原子晶体
![]()
(4)CH2=CH2
(5)SiH4+8AgNO3+2H2O===SiO2↓+8Ag↓+8HNO3
22.(1)d+n-2m (2)(a+n+d)/(a+d)
五、
23.(1)CH2=CH2
![]() (2)
COOCH2
(2)
COOCH2
HOCH2CH2OH + HOOCCOOH +2H2O
COOCH2
(3)取代 消去 加成 水解
24.(1)CH3CH(OH)CH(CN)COOH
(2)加成 消去 酯化
(3)CH3-CH=C(CN)COOH +C2H5OH→CH3CH=C(CN)COOC2H5+H2O
六、(本题包括2小题,共20分)
25.(1)PbO2+2e-+4H++SO42-===PbSO4+2H2O
(2)2.23×1024
26.(1)H2O CO2 O2
(2)H2O:0.3mol CO2:0.2mol O2:0.13mol
(3)分子式:C2H6O2 结构简式: HOCH2CH2OH