高三年级第三次月考化学试卷
第I卷(选择题:共50分)
(请将选择题的正确答案填涂在机读卡上)
可能用到的原子量:N:14 O:16 Fe:56 S:32 Cu:64 H:1
一.选择题:(每小题只有一个选项符合题意)
1.目前,我国重点城市空气质量日报的监测项目中不包括( )
A.二氧化硫(SO2) B.二氧化氮(NO2)
C.二氧化碳(CO2) D.总悬浮颗粒物(TSP)
2.下列物质中,具有正四面体结构,属于分子晶体的单质是( )
A.金刚石 B.水晶 C.白磷 D.甲烷
3.18 g ![]() 微粒中含有( )
微粒中含有( )
A.1 mol![]() 离子 B.9 mol中子 C.9 mol电子 D.10 mol质子
离子 B.9 mol中子 C.9 mol电子 D.10 mol质子
4.R、X、Y和Z是4种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这4种离子被还原成0价时表现的氧化性大小符合( )
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
5.在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是( )
A.+4 B.+5 C.+6 D.+7
二.选择题:(每小题有1~2个选项符合题意)
![]() 6.恒温恒压下,在容积可变的器皿中,反应2NO2(g) N2O4(g) 达到平衡后,再向容器中通入一定量NO2,又达到平衡时,N2O4的体积分数( )
6.恒温恒压下,在容积可变的器皿中,反应2NO2(g) N2O4(g) 达到平衡后,再向容器中通入一定量NO2,又达到平衡时,N2O4的体积分数( )
A.不变 B.增大 C.减小 D.无法判断
7.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A.盐酸、水煤气、醋酸、干冰 B.冰醋酸、福尔马林、硫酸钠、乙醇
C.单甘油酯、混甘油酯、苛性钾、石灰石 D.胆矾、漂白粉、氯化钾、氯气
8.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.吸氢材料镧镍合金 B.半导体材料砷化镓
C.透明陶瓷材料硒化锌 D.高温结构陶瓷材料氮化硅
9.下列叙述中的四种非金属元素,所形成的气态氢化物的稳定性最差的是( )
A.构成矿物和岩石的主要元素 B.空气中质量分数最高的元素
C.单质在常温下呈液态的元素 D.形成化合物种类最多的元素
10.下列做法中不正确的是( )
A.水银温度计不慎摔破后,在散落的汞滴上覆盖硫粉
B.苯酚溶液不慎沾到皮肤上,立即用酒精洗涤
C.浓H2SO4不慎沾到皮肤上,尽快用水冲洗
D.做过银镜反应的试管用氨水洗涤
11.重铬酸铵[(NH4)2Cr2O7]是一种受热易分解的盐,下列各组对重铬酸铵受热分解产物的判断,符合氧化还原反应原理的是( )
A.CrO3+NO+H2O B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O D.Cr2O3+N2+H2O
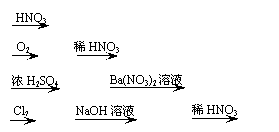 12.“绿色化学”要求从经济,环保和技术上设计符合“原子经济性”(原子节约)要求的化学反应,理想的原子经济反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,下列几种生产Mg(NO3)2的方法中,最符合“绿色化学”新理念的是( )
12.“绿色化学”要求从经济,环保和技术上设计符合“原子经济性”(原子节约)要求的化学反应,理想的原子经济反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放,下列几种生产Mg(NO3)2的方法中,最符合“绿色化学”新理念的是( )
A.Mg Mg(NO3)2
B.Mg MgO Mg(NO3)2
C.Mg MgSO4 Mg(NO3)2
D.Mg MgCl2 Mg(OH)2 Mg(NO3)2
13.若a g FeS2在空气中充分燃烧,共转移n个电子,则阿伏加德罗常数值可表示为( )
A.12n/a B.120n/11a C.60n/a D.11a/120n
14.最近,科学家在实验室成功地在高压下将CO2转化为类似SiO2的原子晶体结构,下列关于CO2晶体的叙述中不正确的是( )
A.晶体中C、O原子个数比为1:2
B.该晶体的熔、沸点高、硬度大
C.晶体中O—C—O键角为180°
D.晶体中C、O原子最外层都满足8电子结构
15.通以相等的电量,分别电解等浓度的硝酸银,硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列表述正确的是( )
A.在两个阴极上得到的银和汞的物质的量之比n(银):n(汞)=2:1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的分子式为HgNO3
D.硝酸亚汞的分子式为Hg2(NO3)2
16.据报道,近日某地一辆满载砒霜的大货车翻下山坡,滑下河道,导致部分砒霜散落到河水中。砒霜的主要成分是As2O3、剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其晶体在193℃升华,微溶于水,并生成H3AsO3。根据媒体的相关报道以及所给信息判断下列说法中正确的是( )
A.砒霜为白色粉末状固体
B.As2O3是砷酸(H3AsO4)的酸酐
C.As2O3的晶体为原子晶体
D.事故发生后采取的应急措施是向受到砒霜污染的河水中洒入生石灰
17.据报道,美国正在研究用锌电池取代目前广泛使用的铅蓄电池,它具有容量大的特点,其电池反应为2Zn+O2=2ZnO,其原料为锌粉,电解液和空气。则下列叙述正确的是( )
A.锌为正极、空气进入负极 B.正极反应为2H2O+O2+4e—=4OH-
C.电解液肯定不是强酸 D.正极发生氧化反应
18.下列离子方程式书写正确的是( )
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-=CO32-+H2O
B.氢氧化铁溶于氢碘酸中 Fe(OH)3+3H+=Fe3++3H2O
C.次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D.氯化亚铁溶液中加入硝酸 3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
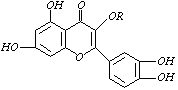 19.天然维生素P(结构如下图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
19.天然维生素P(结构如下图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
A.可以和溴水反应
B.可用有机溶剂萃取
C.分子中有三个苯环
D.1 mol维生素P可以和4 mol NaOH反应
20.下列事实不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
 三.选择题:(每小题只有一个选项符合题意)
三.选择题:(每小题只有一个选项符合题意)
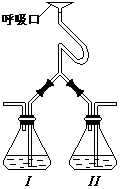
21.为验证人体呼出气体中含有的CO2不是来自空气,而是
人体代谢作用产生的。某学校学生课外活动小组设计了
如图所示装置,你认为该装置应选用的试剂是( )
瓶I 瓶II
A.Ca(OH)2 NaOH
B.NaOH Ca(OH)2
C.稀HCl Ca(OH)2
D.NaOH BaCl2
22.若以w1和w2分别表示浓度为 a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A.2w1=w2 B.2w2=w1 C.w2>2w1 D.w1<w2<2w1
23.把足量的Fe粉投入到硫酸和硫酸铜的混合液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与Cu2+的物质的量浓度之比为( )
A.1:4 B.2:7 C.1:2 D.3:8
24.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
A.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) B.c(Na+) +c(H+)=c(S2-)+ c(HS-)+ c(OH-)
C.c(Na+)= c(HS-)+2c(H2S)+2c(S2-) D.c(OH-)= c(H+)+ c(HS-)+c(H2S)
25.已知高级脂肪酸不能使指示剂显色,安息香酸溶液与甲酸钠不反应,但与醋酸钠混合可闻到醋酸味,则等物质的量浓度的下列溶液,其pH由大到小顺序是( )
①硬脂酸钠 ②安息香酸钠 ③甲酸钠 ④醋酸钠 ⑤纯碱溶液
A.①②④⑤③ B.③②④①⑤ C.①⑤④②③ D.③②④⑤①
第II卷(非选择题,共50分)
四.填空题:(30分)
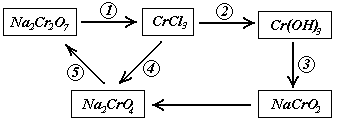 26.(5分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
26.(5分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
(1)在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是______(填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是________(填化学式)
(3)完成并配平步聚①化学方程式:
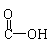
![]()
27.(4分)
(1)5.7 g汽油[主要成分是辛烷(C8H18),相对分子质量为114]完全燃烧生成液态水和CO2放出275.9 kJ的热量,汽油的燃烧热为________________。
(2)由于石油资源有限,且汽油燃烧会产生严重污染,氢气作为一种清洁的能源日益受到各国的重视,许多汽车厂商正努力研究用氢气作为燃料来取代汽油,生产21世纪的环保汽车。已知:
2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ/mol
H2O(l)=H2O(g);△H=+44kJ/mol
写出氢气和氧气反应生成液态水的热化学方程式:
__________________________________________________________________
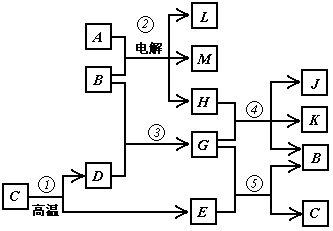 28.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
28.(6分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
(1)单质L是_______________。
(2)化合物B是_____________。
(3)图中除反应①外,还有两个用于工业生产的反应是______和_______(填代号)
它们的化学反应方程式分别是____________________和____________________。
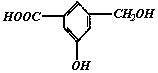
29.(6分)
①有机物A在浓H2SO4存在的条件下,相互作用生成一种环状酯,结构如图所示:
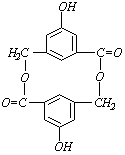 则有机物A的结构简式为____________________。
则有机物A的结构简式为____________________。
②等物质的量的A分别与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为________________
③B与A互为同分异构体,且知苯环上的一氯代物只有2种,B不与NaHCO3反应,能与Na、NaOH溶液反应,等质量的B消耗Na、NaOH物质的量之比为2:3,则B的结构简式为________(只写一种)
30.(9分)据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种,它与雷米封同时服用,可以产生协同作用。
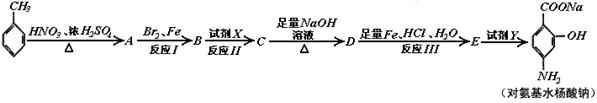
请按要求回答下列问题:
(1)写出下列反应的化学方程式并配平:
:__________________________________________。
A→B: _______________________ 。
(2)写出下列物质的结构简式:C ;D 。
(3)指出反应类型:Ⅰ ;Ⅱ ;Ⅲ 。
(4)所加试剂名称:X ;Y
五.实验题:
31.(14分)
(1)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是______________________。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(2)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
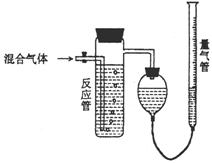 ①混合气体进入反应管中,量气管内增加的水的体
①混合气体进入反应管中,量气管内增加的水的体
积等于 _____ 的体积(填写气体的分子式)。
②反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
③反应管内的碘的淀粉溶液也可以用 代替
(填写物质名称)。
④若碘溶液体积为VamL.,浓度为cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为: 。
⑤将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
六.计算题:(6分)
![]() 32.一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测定平衡时C(A2)=0.5
mol/L,C(B2)=0.1
mol/L,C(C)=1.6
mol/L,若A2、B2、C的起始浓度分别为a mol/L、b mol/L、c mol/L,请回答:
32.一定条件下,可逆反应A2+B2 2C达到了化学平衡状态,经测定平衡时C(A2)=0.5
mol/L,C(B2)=0.1
mol/L,C(C)=1.6
mol/L,若A2、B2、C的起始浓度分别为a mol/L、b mol/L、c mol/L,请回答:
(1)a、b应满足的关系是______________________________
(2)a的取值范围_____________________________________
高三年级第三次月考化学试卷答题纸
第II卷(非选择题,共50分)
班级_________ 姓名__________ 成绩__________
四.填空题:(共30分)
26.(5分)
(1)____________,____________ (2)________________________
![]() (3)
(3)
27.(4分)
(1)________________________
(2)________________________________________________________________
28.(6分)
(1)____________ (2)____________
(3)____________,____________
____________________________________,______________________________
29.(6分)
①______________________ ②__________________ ③________________________
30.(9分)
(1) :___________________________________________________________
A→B: __________________________________________________________
(2)C_______________________ D________________________
(3)I ____________ II____________ III____________
(4)X________________________ Y________________________
五.实验题:(共14分)
31.(1)(4分)________________________________________________
(2)(10分)
①____________________________________
②________________________
③________________________________________________
④________________________________________________
⑤________________________
六.计算题:(6分)
32.(1)____________________________________
(2)____________________________________
高三年级第三次月考化学试卷答案
一、二、三.选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | C | A | B | A | B | C | A | CD |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | B | B | C | D | AD | BC | D | C | B |
| 21 | 22 | 23 | 24 | 25 |
| ||||
| A | C | B | A | C |
| ||||
四.填空题:
26.(5分)
(1)①,④
(2)Cr(OH)3
(3)
![]()
27.(4分)
(1)5518 kJ/mol (2)2H2(g)+O2(g)=2H2O(l);△H=-571.6 kJ/mol
28.(8分)
![]() (1)H2 (2)H2O
(1)H2 (2)H2O
(3)②,④ 2NHCl+2H2O ,2Ca(OH)2+2Cl2=
29.(4分)
(1) (2)3:2:1
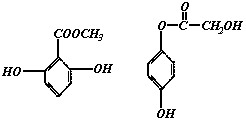
(3) 或
30.(9分)
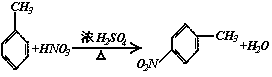
(1)
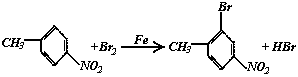
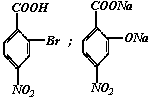 (2)
(2)
(3)取代反应;氧化反应;还原反应
(4)酸性KMnO4;二氧化碳
五.实验题:
31.(1)(5分)①③⑤⑥
(2)①N2、O2 ②偏低 ③高锰酸钾酸性溶液或溴水
④![]() ⑤c、e、g或beg或bceg
⑤c、e、g或beg或bceg
六.计算题:
32.(6分)
(1)a-b=0.4
(2)![]()
参考答案及分析:
一、选择题
1.C
2.C
[思路点拨]此题主要考察审题,所选应符合三点要求:1.正四面体结构。2.属分子晶体。3.属单质,排除A、B、D。
3.C
4.A
[思路点拨]根据题给信息X2+与单质R不反应,说明X2+的氧化性弱于R2+,通过题给的两个能发生的离子方程式,得出氧化性:X2+>22+,22+>Y2+,则总排序为A。
5.B
二、选择题
6.A
7.B
8.C
[思路点拨]对此题做出正确判断的前提是掌握主族元素的名称和符号。
9.A
[思路点拨]判断气态氢化物的稳定性,实质是比较非金属元素非金属性的强弱。题目中并没有直接给出非金属元素的名称,需通过对化学知识的掌握去判断:构成矿物和岩石的主要元素是Si、空气中质量分数最高的元素是N、单质在常温呈液态的非金属元素是Br、形成化合物种类最多的元素是C。四种元素中非金属性最弱的是Si,则其氢化物的稳定性最差。
10.C、D
11.D
[思路点拨]氧化还原反应的原理是发生了电子转移,在表现上表现为元素的化合价在反应前后发生变化,且即有升高,又有降低不可能只有其一方面。依此分析只有D符合题意。
12.B
13.B
14.C
[思路点拨]注意题给信息:高压下将CO2转化为类似SiO2的原子晶体结构。则不再是原来CO2的小分子结构,因此其O—C—O键角不再是180o,而不是109o28’。
15.D
[思路点拨]当通以相等电量时,被还原的+1价银和+1价汞一定等物质的量,而被还原的硝酸银和硝酸亚汞的物质的量为2:1,说明硝酸亚汞的化学式为Hg2(NO3)2。
16.A、D
17.B、C
18.D
[思路点拨]注意反应物的量的关系。A:NaOH过量时,其离子反应为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O B:Fe(OH)3溶于HI溶液后产生的Fe3+与I-会发生氧化还原反应。 C:CO2过量时,CaCO3应转化为Ca(HCO3)2。
19.C
[思路点拨]此天然维生素的结构中有两个苯环而不是三个苯环,且两个苯环上各有两上酚羟基,因此即可与溴水发生取代反应,又能与NaOH反应。有机化合物一般可用有机溶萃剂。
20.B
三.选择题
21.A
[思路点拨]观察I、II两个装置的不同,与呼吸装置相通的是I中的长管(已插入液体中)和II中的短管,因此人呼出的气体进入I的液体中,同时通过II装置吸入空气。为达到实验目的II装置中的液体应可吸收空气中的CO2,I装置中液体应能与人呼出的CO2反应具有现象,则只有A组试剂可达到实验目的。
22.C
[思路点拨]根据题给条件分析:两溶液体积均为V时,质量分数为W1的氨水中溶质的物质的量是质量分数的W2的氨水中的![]() 。由于氨水的密度比纯水小,且浓度越大,密度越小,等体积的两种氨水,溶液总质量W2<W1,则溶质质量分数比W12倍还大。
。由于氨水的密度比纯水小,且浓度越大,密度越小,等体积的两种氨水,溶液总质量W2<W1,则溶质质量分数比W12倍还大。
23.B
24.A
25.C
[思路点拨]先分析所给酸的强弱顺序,再判断对应盐溶液pH的大小。依据:等物质的量浓度的盐溶液,酸根对应酸越弱,其水解能力越强,则盐溶液碱性越强,pH越大。
四.填空题
26.(1)①,④
(2)Cr(OH)3
(3)Na2Cr2O7+6KI+14HCl==2CrCl3+2NaCl+6KCl+3I2+7H2O
27.(1)5518KJ/mol
(2)2H2(g)+O2(g)==2H2O(l) △H=-571.6KJ/mol
[思路点拨]燃烧热指1mol物质完全燃烧生成稳定氧化物所放出的热。根据辛烷的相对分子质量和5.7g汽油燃烧生成液态水和CO2所放出的热即可求出汽油的燃烧热为5518KJ/mol。第(2)问注意H2O的状态变化,2mol气态水转化成液态水放热44×2KJ。
28.(1)H2
|
(3)②,④,2NaCl+2H2O=====2NaOH+Cl2↑+H2↑
2Ca(OH)2+2Cl2==CaCl2+Ca(ClO)2+2H2O
[思路点拨]分析此题的突破点在①,⑤两个反应,一种反应物高温分解且是一种产物的工业制备方法,从我们高中所学的知识判断C为CaCO3,其分解产物为CO2和CaO,而实验室鉴定的应为CO2,由此推出D为CaO,E为CO2,G为Ca(OH)2,B为H2O。从另两个工业制备反应推出L为H2,H为Cl2。进尔推出反应④。
![]() 29.(1) OH
29.(1) OH
![]()
| |||
![]()
(2)3:2:1
|
| ||||
CH3 CH3
![]()
|
|
+HO—NO2 H2O+
![]()
NO2
CH3 CH3
| |||||||
|
![]()
![]() NO2
NO2
NO2
NO2
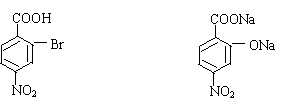 (2)
(2)
(3)取代反应、氧化反应,还原反应。
(4)高锰酸钾;二氧化碳。
[思路点拨]甲笨与浓HNO3,浓H2SO4的混合液加热时,苯环上甲基的邻位或对位上的氢原子可以被硝基(—NO2)取代,从最终产物结构分析,A应为对-硝基甲苯。
五、实验题
31.(1)①③⑤
(2)① N2 O2 ②高 ③高锰酸钾溶液和溴水
④![]()
⑤ c、e、g或b、e、g
32.(1)a=b+0.4
(2)1.3≥a≥0.4
[思路点拨]第(1)问可通过列表计算求得。第(2)问求法和依据是可逆反应不能进行到底。即反应无论从哪个方向开始。平衡时不能有一种物质为零。