高 三 化 学(第12周)
【教学内容】
复习烃的衍生物
【教学目标】
1、熟练掌握醇、酚、醛、羧酸等极为重要的烃的衍生物的化学性质、相互转化关系;
2、在熟练掌握这些基础知识的基础上,充分运用、挖掘题给信息、解决实际问题。
【知识讲解】
一、官能团:基团指化合物分失去某种原子或原子团剩余部分,而官能团是一类特殊的基团,通常指主要决定有机物分子化学性质的原子或原子团,常见官能团有:—X、
![]()
![]() O
O
O
O
![]()
![]()
![]()
![]() —NO2、—OH、—CHO、—C—OH、—NH2、 C=C 、—CºC—、[R—C—(酰基)、R—
—NO2、—OH、—CHO、—C—OH、—NH2、 C=C 、—CºC—、[R—C—(酰基)、R—
![]() O
O
C—O—(酰氧基)、R—O—(烃氧基)]等。
![]()
![]()
![]() O
O
O
O
O
O
思考:1、H—C—OH应有几种官能团?(4种、—C—、—OH、—C—OH、—CHO)
![]() OH
OH
2、 —CHO能发生哪些化学反应?(常见)
CH=CH—COOH
(提示:属于酚类、醛类、羧酸类、烯烃类)
二、卤代烃(R—X)
![]()
![]() 1、取代(水解)反应 R—X+H2O NaOH R—OH+HX
1、取代(水解)反应 R—X+H2O NaOH R—OH+HX
![]()
![]() 2、消去反应 R—CH2—CH2—X NaOH/醇 R—CH=CH2+HX
2、消去反应 R—CH2—CH2—X NaOH/醇 R—CH=CH2+HX
这两个反应均可用于检验卤代烃中卤素原子,检验时一定要用硝酸酸化,再加入AgNO3溶液。
三、乙醇
![]()
![]() H H
H H
![]()
![]()
![]()
![]()
![]() 1、分子结构 H—C—C—O—H 用经典测定乙醇分子结构的实验证明
1、分子结构 H—C—C—O—H 用经典测定乙醇分子结构的实验证明
![]() ④ H ③ H ② ①
④ H ③ H ② ①
2、化学性质:(1)活泼金属(Na、Mg、Al等)反应。根据其分子结构,哪个化学键断裂?反应的基本类型?Na分别与水和乙醇反应哪个更剧烈?乙醇钠水溶液呈酸性还是碱性?
(2)与氢卤酸反应——制卤代烃 (分析乙醇分子中几号键断裂)
![]() NaBr+H2SO4+C2H5OH △ CH3CH2Br+NaHSO4+H2O
NaBr+H2SO4+C2H5OH △ CH3CH2Br+NaHSO4+H2O
思考:该反应用浓还是较浓的H2SO4?产物中NaHSO4能否写成Na2SO4?为什么?
(较浓,不能,都有是因为浓H2SO4的强氧化性,浓度不能太大,温度不能太高)
(3)氧化反应:①燃烧——现象?耗氧量与什么烃燃烧耗氧量相同?
![]()
![]() ②催化氧化(脱氢):CH3CH2OH
—H2 CH2CHO +O2 CH3COOH
②催化氧化(脱氢):CH3CH2OH
—H2 CH2CHO +O2 CH3COOH
(式量46) (式量44) (式量60)
即有一个—CH2OH最终氧化为—COOH式量增大14
③强氧化剂氧化——KMnO4/H+褪色
(4)脱水反应:①分子间脱水——浓H2SO4、140℃(取代反应)
②分子内脱水——浓H2SO4、170℃(消去反应)
以上两种情况是几号键断裂?
思考:下列反应是否属于消去反应:
![]()
![]()
![]()
![]() A、CH2=CH→CHºCH+HX
B、CH2—CH—COOH→CH2=C—COOH+NH3
A、CH2=CH→CHºCH+HX
B、CH2—CH—COOH→CH2=C—COOH+NH3
![]()
![]()
![]() X O
NH2 CH3 CH3
X O
NH2 CH3 CH3
C、CH3—C—O—CH2—CH— →CH2=CH— +CH3COOH
(以上均为消去反应)
(4)酯化反应:断裂几号键?用什么事实证明?(同位素示踪法)
![]()
![]()
![]()
![]() 例:R—CH=CH—R’+R—CH=CH—R’ →R—CH=CH—R+R’—CH=CH—R’对于该反应
例:R—CH=CH—R’+R—CH=CH—R’ →R—CH=CH—R+R’—CH=CH—R’对于该反应
① ② ② ③
有两种解释:一是两分子分别断裂①③键重新结合成新分子,二是分别断②键再两两结合成新分子。请用简单方法证明哪种解释正确。
解:用R—CD=CH—R’的烯烃进行实验,若生成R’—CD=CH—R’和R—CD=CH—R第一种解释正确。若生成R—CD=CD—R和R’CH=CHR’第二种解释正确。
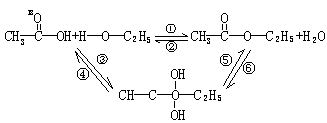 |
例:乙酸和乙醇的酯化反应,可用如下过程表示:
![]() OH
OH
![]() 即酯化反应实质经过中间体CH3—C—O—C2H5再转化为酯和水,以上6个反应均为可
即酯化反应实质经过中间体CH3—C—O—C2H5再转化为酯和水,以上6个反应均为可
OH
逆反应,回答下列问题:
![]() 18O
18O
(1)用CH—C—OH进行该实验,18O可存在于哪些物质中(反应物和生成物),若用CH3—CH2—18O—H进行该实验,结果又如何?
(2)请分别指出①~⑥反应的基本类型。
解析:(1)根据信息:酯化反应实质是C2H5—O—H分子中O—H共价键断裂,H原子加
![]()
![]() 18O O
18O O
到乙酸—C—氧上,C2H5O—加到—C—碳原子上。即③为加成反应,形成中间体
![]() 18OH
18OH
![]() CH3—C—O—C2H5,根据同一碳原子连两个—OH是不稳定的,脱水形成酯,在脱水时,
CH3—C—O—C2H5,根据同一碳原子连两个—OH是不稳定的,脱水形成酯,在脱水时,
OH
可以由—18OH提供羟基与另一羟基上的H或由—OH提供羟基和—18OH上的H脱水,
![]() O
O
且机会是均等的,因此,CH3—C—O—C2H5和水中均含有18O,而反应②实质是酯的水
![]()
![]() O
O
O
O
![]() 解,水解时,酯中断裂的一定是—C—O—,因此—C—一定上结合水中的—OH,所以,在反应物中只有CH3COOH存在18O。
解,水解时,酯中断裂的一定是—C—O—,因此—C—一定上结合水中的—OH,所以,在反应物中只有CH3COOH存在18O。
(2) ①②均为取代反应,③⑥均为加成反应,④和⑤均为消去反应。
![]()
|
乙烯水化法 CH2=CH2+H2O CH3CH2OH
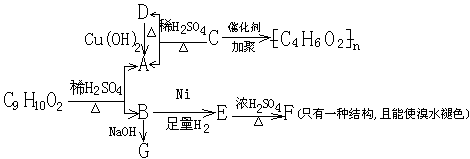
思考:已知有机物C9H10O2有如下转化关系:
(1)写出下列物质的结构简式A__________C__________F____________
(2)写出下列反应的化学方程式C9H10O2→A+B
D→A
![]()
![]() O
O
(答:(1)A:CH3COOH、C:CH3—C—O—CH=CH2 F
![]()
![]()
![]()
![]() O OH CH3
O OH CH3
(2)CH3— —O—C—CH3+H2O→ +CH3COOH
![]() CH3
CH3
![]() CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O)
CH3CHO+2Cu(OH)2 △ CH3COOH+Cu2O↓+2H2O)
![]() 四、苯酚:
四、苯酚:
![]()
![]() 1、定义:现有CH3—CH2—、 —CH2—、C6H5—、 —、CH3— —等烃基连接—OH,哪些属于酚类?
1、定义:现有CH3—CH2—、 —CH2—、C6H5—、 —、CH3— —等烃基连接—OH,哪些属于酚类?
2、化学性质(要从—OH与苯环相互影响的角度去理解)
![]()
![]() (1)活泼金属反应:请比较Na分别与水、 —OH、CH3CH2OH反应剧烈程度,并解释原因。最剧烈为水,最慢为乙醇,主要原因是: —对—OH影响使—OH更易(比乙醇)电离出H+。
(1)活泼金属反应:请比较Na分别与水、 —OH、CH3CH2OH反应剧烈程度,并解释原因。最剧烈为水,最慢为乙醇,主要原因是: —对—OH影响使—OH更易(比乙醇)电离出H+。
![]() 思考:通常认为 —为吸电子基,而CH3CH2—为斥电子基、由此请你分析HO—NO2中—NO2,为吸电子基还是斥电子基?
思考:通常认为 —为吸电子基,而CH3CH2—为斥电子基、由此请你分析HO—NO2中—NO2,为吸电子基还是斥电子基?
(吸电子基、HNO3为强酸、即—OH完全电离出H+)
(2)强碱溶液反应——表现苯酚具有一定的酸性——俗称石炭酸。
注意:①苯酚虽具有酸性,但不能称为有机酸因它属于酚类。
②苯酚的酸性很弱,不能使石蕊试液变红
以上两个性质均为取代反应,但均为侧链取代
(3)与浓溴水的反应
![]()
![]() OH
OH
OH
OH
![]()
![]() +3Br2→Br— —Br↓+3HBr
+3Br2→Br— —Br↓+3HBr
![]() Br
Br
该反应不需要特殊条件,但须浓溴水,可用于定性检验或定量测定苯酚,同时说明—OH对苯环的影响,使苯环上的邻、对位的H原子变得较活泼。
![]() (4)显色反应—— —OH与Fe3+互相检验。
(4)显色反应—— —OH与Fe3+互相检验。
![]() 6C6H5OH+Fe3+ [Fe(C6H5O)6]3-+6H+
6C6H5OH+Fe3+ [Fe(C6H5O)6]3-+6H+
![]() (5)氧化反应 久置于空气中变质(粉红色)
(5)氧化反应 久置于空气中变质(粉红色)
![]()
|
![]()
![]()
![]()
![]()
![]() (6)缩聚反应:n —OH+nHCHO
[ —CH2]n+nH2O
(6)缩聚反应:n —OH+nHCHO
[ —CH2]n+nH2O
![]()
![]()
![]() OH
OH
例:HO— —CH=CH— 1mol与足量Br2或H2反应,需Br2和H2的最大量
![]() OH
OH
分别是多少?
![]() 解析:—C=C—需1molBr2加成,而酚—OH的邻对位H能被Br2取代左侧的酚只有邻位2个H原子,而右侧为二元酚,3个H原子均为邻、对位又需(2+3)molBr2,而1mol
解析:—C=C—需1molBr2加成,而酚—OH的邻对位H能被Br2取代左侧的酚只有邻位2个H原子,而右侧为二元酚,3个H原子均为邻、对位又需(2+3)molBr2,而1mol
需3molH2,则Br2为6mol,H2为7mol。
五、乙醛
![]() 与H2加成——还原反应
与H2加成——还原反应
![]() 1、化学性质:(1)加成反应 HCN加成CH3CHO+HCN→CH3—CH—CN
1、化学性质:(1)加成反应 HCN加成CH3CHO+HCN→CH3—CH—CN
OH
![]()
![]() 自身加成 CH3CHO+CH2—CHO→CH3—CH—CH2—CHO
自身加成 CH3CHO+CH2—CHO→CH3—CH—CH2—CHO
H OH
(2)氧化反应
①燃烧
②银镜反应
③新制Cu(OH)2反应
④KMnO4/H+褪色
![]() 乙醇催化氧化法
乙醇催化氧化法
2、制法 乙烯催化氧化法
乙炔水化法
例:醛可以和NaHSO3发生加成反应,生成水溶性α—羟基磺酸钠:
![]()
![]() O
OH
O
OH
![]() R—C—H+NaHSO3 R—CH—SO3Na
R—C—H+NaHSO3 R—CH—SO3Na
该反应是可逆的,通常70%~90%向正方向转化
(1)若溴苯中混有甲醛,要全部除去杂质,可采用的试剂是_________,分离方法是_______
![]() (2)若在CH—CHSO3Na水溶液中分离出乙醛,可向溶液中加入_______,分离方法是
(2)若在CH—CHSO3Na水溶液中分离出乙醛,可向溶液中加入_______,分离方法是
OH
________。
解析:(1)溴苯相当于有机溶剂,甲醛溶解在其中,要除去甲醛,既要利用信息,又要用到溴苯是不溶于水的油状液体这一性质。由于醛能与NaHSO3加成,形成水溶性的离子化合物α—羟基磺酸钠(显然不能溶于有机溶剂),因此加入的试剂为饱和NaHSO3溶液,采用分液方法除去杂质。
(2)根据信息,醛与NaHSO3的反应为可逆反应,应明确:
![]()
![]() CH3—CHSO3Na CH3CHO+NaSO3,要转化为乙醛显然促使平衡向正方向移动,
CH3—CHSO3Na CH3CHO+NaSO3,要转化为乙醛显然促使平衡向正方向移动,
OH
只有减小NaHSO3浓度,只要利用NaHSO3的性质即可。因此向溶液中加入稀H2SO4(不能加盐酸,为什么?)或NaOH,进行蒸馏即得乙醛。
六、乙酸
1、化学性质:(1)酸的通性——弱酸,但酸性比碳酸强。
![]() 与醇形成酯
与醇形成酯
(2)酯化反应 与酚(严格讲应是乙酸酐)形成酯
与纤维素形成酯(醋酸纤维)
注意:乙酸与乙醇的酯化实验应注意以下问题:
①加入试剂顺序(密度大的加入到密度小的试剂中)
②浓H2SO4的作用(催化、吸水)
③加碎瓷片(防暴沸)
④长导管作用(兼起冷凝器作用)
⑤吸收乙酸乙酯试剂(饱和Na2CO3溶液,其作用是:吸收酯中的酸和醇,使于闻酯的气味,减小酯在水中的溶解度)
2、羧酸
![]() 低级脂肪酸
低级脂肪酸
(1)乙酸的同系物 CnH2nO2 如HCOOH、CH3CH2COOH
高级脂肪酸,如:硬脂酸,软脂酸
(2)烯酸的同系物:最简单的烯酸CH2=CH—COOH,高级脂肪酸:油酸
![]()
![]() (3)芳香酸,如 —COOH
(3)芳香酸,如 —COOH
![]() (4)二元酸,如:COOH、HCOO— —COOH等,注意二元酸形成的酸式盐溶解
(4)二元酸,如:COOH、HCOO— —COOH等,注意二元酸形成的酸式盐溶解
COOH
度比正盐小,类似于NaHCO3和Na2CO3的溶解度。
![]()
![]()
![]()
![]() O
O
O O
O
O
O O
思考:CH3—C—OH+HO—C—CH3→CH3—C—O—C—CH3+H2O
![]() O
O
![]()
![]()
![]() CH3—C
O
CH3—C
O
![]()
![]() O 称之为乙酸酐,H—C—OH
CO↑+H2O,CO能否称为甲酸酐?
O 称之为乙酸酐,H—C—OH
CO↑+H2O,CO能否称为甲酸酐?
![]() CH3—C
CH3—C
O
![]() O
O
![]() 为什么?由此请你写出硝酸酸酐的形成过程(HNO3的结构式HO—N O )
为什么?由此请你写出硝酸酸酐的形成过程(HNO3的结构式HO—N O )
(由乙酸酐的形成可以看出:必须是—OH与—OH之间脱水形成的物质才能称为酸酐,
![]() O
O
而CO是由H—C—OH中—OH和C原子直接相连的H原子脱水,因此,不能称为酸
![]()
![]() O O
O O
酐,甲酸酐应为:H—C—O—C—H。同理硝酸酐的形成为:
![]()
![]()
![]()
![]()
![]() O
O O
O
O
O O
O
![]()
![]()
![]()
![]() N—OH+H—O—N = N—O—N (N2O5)+H2O
N—OH+H—O—N = N—O—N (N2O5)+H2O
O O O O
七、酯
![]() 无机酸酯 (CH3CH2ONO2)
无机酸酯 (CH3CH2ONO2)
![]() 1、分类
低级酯(CH3COOC2H5)
1、分类
低级酯(CH3COOC2H5)
有机酸酯 高级脂肪酸甘油酯——油脂
2、化学性质——水解反应(取代反应)
(1)条件无机酸或碱作催化剂;(2)水浴加热;(3)可逆反应;(4)碱性条件水解程度大(为什么?)
![]()
![]()
![]() O O
O O
例:写出CH—C—O— —C—OH与足量NaOH反应的化学方程式。
解析:该有机物既属于酯类,又属于羧酸类,该酯在碱性条件下水解,形成乙酸与酚,因此1mol需3molNaOH。
![]()
![]()
![]()
![]() O
O
O
O
CH3—C—O— —C—OH+3NaOH→CH3COONa+NaO— —COONa+2H2O
例:某式量不超过300的高级脂肪酸与乙酸完全酯化后其式量为原来的1.14倍,若与足量溴水反应后其式量为原来的1.54倍,请确定该有机物的化学式[用R(OH)nCOOH形式表示]
解析:由于能与乙酸酯化,证明为羟基酸如何确定羟基数目?抓住M≤300和酯化后式
![]() O
O
量为原来的1.14倍,设含一个醇—OH,则R—OH+CH3COOH→M—O—C—CH3+H2O
(式量M) (式量M+42)
![]() M=300 假设成立。
M=300 假设成立。
再设烃基含y个不饱和度则![]() y=1
y=1
则该酸的化学式应为CnH2n-2O3 得出n=18
为C17H32(OH)COOH.
思考:式量为300以下的某脂肪酸1.0g与2.7g碘完全加成,也可被0.2gKOH完全中和,推测其准确的式量。(提示: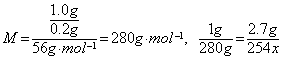 x=3,即有3个不饱和度,其通式为CnH2n-6O2,14n—6+32≈280,n=18,准确式量就为278)
x=3,即有3个不饱和度,其通式为CnH2n-6O2,14n—6+32≈280,n=18,准确式量就为278)
![]() 【能力训练】
【能力训练】
1、化合物A[ ]的同分异构体B中无甲基,但有酚羟基符合此条件的B的同分异构体有_______种,从结构上看,这些同分异构体可属于________类,写出每类同分异构体中的一种同分异构体的结构简式_________________。
2、有机物A的分子量为128,燃烧只生成CO2和H2O。
(1)写出A的可能分子式5种________、________、_________、_________、_________。
(2)若A能与纯碱溶液反应,分子结构有含一个六元碳环,环上的一个H原子被—NH2取代所得产物为B的同分异构体甚多,其中含有一个六元碳环和一个—NO2的同分异构有(写结构简式)_________________________________________
 3、某链烃[CnHm]属烷、烯或炔烃中的一种,使若干克该烃在足量O2中完全燃烧,生成xLCO2和1L水蒸气(120℃ 1.03×105Pa)试根据x的不同取值范围来确定该烃所属类型及其分子内所含碳原子n值。
3、某链烃[CnHm]属烷、烯或炔烃中的一种,使若干克该烃在足量O2中完全燃烧,生成xLCO2和1L水蒸气(120℃ 1.03×105Pa)试根据x的不同取值范围来确定该烃所属类型及其分子内所含碳原子n值。
【能力训练答案】
1、27种,烯酚或环酚类。
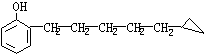 |
和
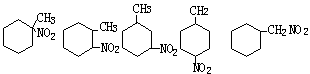 |
2、(1) C10H8、C9H20、C8H16O、C7H12O2、C6H8O3
(2)
3、当![]() ≤x<1为烷烃,当x=1为烯烃,当1<x≤2为炔烃
≤x<1为烷烃,当x=1为烯烃,当1<x≤2为炔烃